不同基原八爪金龙药材中黄酮、香豆素类化学成分分析
2021-04-08李晓石慧丁晶鑫俸婷婷刘雄伟刘畅周英
李晓 石慧 丁晶鑫 俸婷婷 刘雄伟 刘畅 周英
摘 要 目的:鉴定并分析不同基原八爪金龙药材中黄酮及香豆素类成分。方法:采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法(UPLC-QE-HF-MS/MS)。色谱柱为Zorbax Eclipse-C18,流动相为乙腈-0.1%甲酸水溶液(梯度洗脱),柱温为30 ℃,流速为0.3 mL/min,自動进样器温度为4 ℃,进样量为2 μL。离子源为电喷雾离子源,扫描模式为正、负离子模式,加热器温度为325 ℃,鞘气压力为45 arb,辅助气压力为15 arb,吹扫气压力为1 arb,电喷雾电压为3.5 kV,毛细管温度为330 ℃,透镜电压为55%,扫描模式为一级全扫描(m/z 100~1 500)、数据依赖性二级质谱扫描(dd-MS2,Top N=10),分辨率为70 000(一级质谱)、17 500(二级质谱),碰撞模式为高能量碰撞解离。通过参考ChemSpider、mzCloud、mzVault、PubChem等国内外专业数据库,同时结合相关文献和对照品数据对化合物结构进行鉴定并比较含量。结果与结论:从朱砂根、百两金、红凉伞等3种不同基原的八爪金龙药材中共分离47个成分,鉴定出17个黄酮类化合物,包括9个黄酮醇类(槲皮素3-O-鼠李糖苷7-O-葡糖苷、杨梅素、芦丁、毛里求斯排草素、山柰酚、槲皮素、异鼠李素、槲皮苷、美恩西汀)、3个黄烷-3-醇类(表棓儿茶素、儿茶素、表没食子儿茶素没食子酸酯)、2个二氢黄酮类(黄颜木素、圣草酚)及3个其他类{3-(2,3-二氢苯并[1,4]二噁英-6-基)-7-羟基-2-三氟甲基-4-酮、墨沙酮、Oriciacridone F},10个香豆素类化合物{岩白菜素、[(7-羟基-4-甲基-2-氧代-2H-色烯-6-基)氧基]乙酸、[7-(羧基甲氧基)-4-甲基-2-氧-2-羟色基-3-基]乙酸、4,9-二羟基7H-呋喃并[3,2-g]色烯-7-酮、6,7-二羟基-4-甲基香豆素、七叶内酯、秦皮素、7,8-二羟基-4-甲基香豆素、4-甲基伞形酮葡萄糖醛酸、二十烷酮}。含量分析结果显示,黄酮、香豆素类化合物中,3种不同基原八爪金龙药材中共有5个共有成分,分别为岩白菜素(2号峰)、[7-(羧基甲氧基)-4-甲基-2-氧-2-羟色基-3-基]乙酸(5号峰)、墨沙酮(16号峰)、槲皮素(18号峰)、Oriciacridone F(26号峰),且共有成分的含量存在明显差异。除5个共有成分外,其余22个成分均为差异化学成分,分别为1、3、4、6~15、17、19~25、27号峰对应的化合物,其中3、6、8、23号峰对应的化合物仅存在于红凉伞中;12~15、19号峰对应的化合物仅存在于百两金中。UPLC-QE-HF-MS/MS法可高效、精确、快速地鉴别不同基原八爪金龙药材中黄酮类、香豆素类化学成分。
关键词 八爪金龙;超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法;黄酮类成分;香豆素类成分;结构鉴定;含量
ABSTRACT OBJECTIVE: To identify and analyze the flavonoids and coumarins in Radix Ardisiae from different sources. METHODS: UPLC-QE-HF-MS/MS was adopted. The determination was performed on Zorbax Eclipse-C18 column with mobile phase consisted of acetonitrile-0.1% formic acid solution (gradient elution) at the flow rate of 0.3 mL/min. The column temperature was 30 ℃, and the temperature of injector was 4 ℃. The sample size was 2 ?L; ESI source was applied in negative and positive scanning ion mode, the heater temperature was 325 ℃, the sheath gas pressure was 45 arb, the auxiliary gas pressure was 15 arb, the purge gas pressure was 1 arb, the electrospray voltage was 3.5 kV, the capillary temperature was 330 ℃, S-lens RF level was 55%, scan mode was first-order full scan m/z 100-1 500, data-dependent secondary mass spectrometry scanning (dd-MS2, Top N=10),the resolution was 70 000 (first mass spectrometry) , 17 500 (secondary mass spectrometry), the collision mode was high-energy collision dissociation. Through retrieving foreign and domestic databases as ChemSpider, mzCloud, mzVault, PubChem, the structure of the compound was identified on the basis of related literatures and reference data, and the contents were compared. RESULTS & CONCLUSIONS: A total of 47 components were separated from Radix Ardisiae of 3 kinds of sources as Ardisia crenata Sims, A. crispa (Thunb.)A. DC., A. crenata Sims var. bicolor (Walk)C. Y. Wu et C. Chen. A total of 17 flavonoids were identified, including 9 flavonols (quercetin 3-O-rhamnoside-7-O-glucoside, myricetin, rutin, mauritanin, kaempferol, quercetin, isorhamnetin, quercetin, mearnsitrin), 3 flavan-3-ols [(-)-epigallocatechin, catechin, epigallocatechin gallate) 2 dihydroflavonoids [fustin, eriodictyol] and 3 other types [3-(2,3-dihydro-benzo[1,4]dioxin-6-yl)-7-hydroxy-2-trifluoromethyl-chromen-4-one, methadone, oriciacridone F], 10 coumarins {bergenin, [(7-hydroxy-4-methyl-2-oxo-2H-chromen-6-yl)oxy]acetic acid, [7-(carboxymethoxy)- 4-methyl-2-oxo-2hydroxychromo-3-yl]acetic acid, 4,9-dihydroxy-7H-furo[3,2-g]chromen-7-one, 6,7-dihydroxy-4-methylcoumarin, esculetin, fraxetin, 7,8-dihydroxy-4-methylcoumarin, 4-methylumbelliferyl glucuronide, scoparone}. Results of content analysis showed that in flavonoids and coumarins, there were 5 common components in Radix Ardisiae from 3 kinds of sources, i.e. bergenin (peak 2), [7-(carboxymethoxy)-4-methyl-2-oxo-2-hydroxychromo-3-yl] acetic acid (peak 5), methadone (peak 16), quercetin (peak 18), oriciacridone F (peak 26); the contents of common components were significantly different. In addition to 5 common components, there were 22 different chemical components, which were compounds corresponding to peaks 1, 3, 4, 6-15, 17, 19-25 and 27, respectively. Among them, compounds corresponding to peaks 3, 6, 8 and 23 were only found in A. crenata Sims var. bicolor (Walk)C. Y. Wu et C. Chen; compounds corresponding to peaks 12-15, 19 were only found in A. crispa (Thunb.) A. DC. UPLC-QE-HF-MS/MS method can efficiently, accurately and quickly identify the flavonoids and coumarins in Radix Ardisiae from different sources.
KEYWORDS Radix Ardisiae; UPLC-QE-HF-MS/MS; Flavonoids; Coumarins; Structure identification; Content
八爪金龙为紫金牛科植物朱砂根Ardisia crenata Sims、百两金Ardisia crispa(Thunb.)A. DC.和红凉伞Ardisia crenata Sims var. bicolor(Walk)C. Y. Wu et C. Chen的根及根茎,为贵州省特色民族药材,也是苗族常用药材,现收载于2003年版《贵州省中药材、民族药材质量标准》[1]。其性凉,味苦、辛,归肺、胃经,具有清热解毒、散瘀止痛、祛风除湿的功效,临床用于治疗急性咽炎、扁桃体炎等症,疗效显著[2-3]。目前,关于八爪金龙的研究大多集中在含量测定、药理作用等方面[4-6]。有研究表明,八爪金龙的主要化学成分为香豆素类、黄酮类和三萜皂苷类化合物,其中香豆素类成分岩白菜素的含量最高,且具有止咳、抗炎、镇痛等活性,是公认的质量控制指标性成分和活性物质[7]。黄酮类成分也具有多种生物活性,如杨梅素具有抗病毒、抑菌抗炎等活性[8],槲皮素、芦丁等具有抗炎和抗肿瘤等活性[9]。因此,鉴定八爪金龙中的香豆素类、黄酮类成分对其质量控制、资源开发和临床应用具有重要价值。
近年来,液质联用技术(LC-MS)已被广泛应用于中药现代化研究,该技术同时具备液相色谱的高分离能力和质谱的高灵敏度和选择性,实现了色谱和质谱的优势互补[10]。电喷雾电离法(ESI)是目前最常用的离子化技术之一,离子化效率高,且多与离子阱质谱仪和三重四极杆质量分析器联用,可快速交替正负离子扫描模式,并具有支持复杂分析方法、节约分析时间等优势[11]。基于此,本研究采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法(UPLC-QE-HF-MS/MS)对不同基原八爪金龙药材中的黄酮类和香豆素类成分进行分离、鉴定,并总结裂解规律,旨在区分不同基原的八爪金龙药材,以保证研究的可持续性和药效的稳定性,同时也为进一步阐明八爪金龙药材的药效物质基础及其深入开发、临床应用提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有Thermo Vanquish型UPLC系统(配有在线脱气机、二元高压泵、自动进样器、柱温箱)、Thermo Q-ExactiveTM HF组合型四极杆-静电场轨道阱高分辨质谱系统[配有ESI、Tune 2.9工作软件、Trace Finder 4.1数据处理软件、Thermo Sientific Xcalibur 4.1.31.9编辑方法软件、Compound Discoverer 3.1定性分析软件、Thermo Mzcloud在线数据库、Thermo Mzvalut本地数据库]均购自美国Thermo Fisher Scientific公司;XS205型十万分之一电子天平(瑞士Mettler Toledo公司);JP2-160型万分之一电子天平(日本CBC公司);SB-600DTY型超声波清洗器(宁波新芝生物科技股份有限公司)。
1.2 主要药品与试剂
实验所用主要药品与试剂有:岩白菜素对照品(成都普思生物科技有限公司,批号PS1330-0025,纯度>98%);甲醇、乙腈、甲酸为色谱纯,其余试剂均为分析纯,水为纯净水。
实验用朱砂根药材(编号S1,批号20190817)采集于贵州省黔南布依族苗族自治州长顺县,百两金药材(编号S2,批号20190819)采集于贵州省贵阳市白云区,红凉伞药材(编号S3,批号20190822)采集于贵州省凯里市雷山县雷公山,经贵州中医药大学药学院魏升华教授鉴定分别为紫金牛科植物朱砂根A. crenata Sims、百两金A. crispa(Thunb.)A. DC.、红凉伞A. crenata Sims var. bicolor(Walk)C. Y. Wu et C. Chen的根及根莖。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件 以Zorbax Eclipse-C18(100 mm×2.1 mm,1.8 μm)为色谱柱,以乙腈(A)-0.1%甲酸水溶液(B)为流动相进行梯度洗脱(0~2 min,95%B;2~7 min,95%B→70%B;7~14 min,70%B→22%B;14~18 min,22%B→5%B;18~25 min,5%B→95%B),柱温为30 ℃,流速为0.3 mL/min,自动进样器温度为4 ℃,进样量为2 μL。
2.1.2 质谱条件 离子源为ESI,扫描模式为正、负离子模式,加热器温度为325 ℃,鞘气压力为45 arb,辅助气压力为15 arb,吹扫气压力为1 arb,电喷雾电压为3.5 kV,毛细管温度为330 ℃,透镜电压为55%;扫描模式为一级全扫描(Full scan,m/z 100~1 500)、数据依赖性二级质谱扫描(dd-MS2,Top N=10),分辨率为70 000(一级质谱)、17 500(二级质谱),碰撞模式为高能量碰撞解离。
2.2 溶液的制备
2.2.1 供试品溶液 取朱砂根、百两金、红凉伞药材鲜品,自然晾干,切片,各取250 g,分别加10倍量(mL/g)水煎煮2 h,共2次,趁热滤过,合并提取液,浓缩,真空干燥,得各药材提取物。分别取上述各药材提取物0.5 g,精密称定,置于具塞锥形瓶中,加甲醇20 mL,密塞,称定质量,超声(功率180 W,频率40 kHz)处理40 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液5 mL,置于10 mL量瓶中,加甲醇定容,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.2 对照品溶液 精密称取岩白菜素对照品10 mg,置于10 mL量瓶中,加甲醇定容,制得质量浓度为1 mg/mL的对照品贮备液。精密量取上述对照品贮备液500 μL,置于10 mL量瓶中,加甲醇定容,即得。
2.3 化学结构数据库建立
一级质谱数据参考ChemSpider化学结构与文献数据库(http://www.chemspider.com/),二级质谱数据参考mzCloud(https://www.mzcloud.org/)、mzVault(https://www.mzcloud.org/)等未知物鉴定的新型数据库,结合PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)与国内外相关文献[12-20],构建八爪金龙的化学结构数据库(可能含有的化学成分及其代谢物),主要包括中英文名称、分子式、相对分子量、结构式、分子离子以及合理的碎片离子、理论上精确的同位素质量和美国化学文摘服务社为化学物质制定的登记号(CAS)等信息。
2.4 八爪金龙药材中黄酮类、香豆素类化合物分析
取“2.2.1”项下3种供试品溶液各适量,按“2.1”项下色谱与质谱条件进样分析,得3种不同基原八爪金龙的总离子流图(见图1)。根据得到的质谱信息、精确质量、碎片离子和保留时间,同时与“2.3”项下所建的化学结构数据库进行匹配。结果,供试品溶液在正、负离子模式下均有响应值较高的特征性吸收峰。从3种不同基原八爪金龙药材中共分离47个成分,鉴定出17个黄酮类化合物和10个香豆素类化合物。其中,从朱砂根药材中分离29个成分,共鉴定出10个黄酮类化合物和7个香豆素类化合物;从百两金药材中分离27个成分,共鉴定出8个黄酮类化合物和4个香豆素类化合物;从红凉伞药材分离30个成分,共鉴定出13个黄酮类化合物和8个香豆素类化合物,结果见表1。
2.5 黄酮及其苷类化合物的鉴定及裂解规律
据文献报道,八爪金龙药材中黄酮类化学成分含量较高[18]。本研究从朱砂根、百两金、红凉伞药材中共鉴定出17个黄酮及其苷类化合物,包括9个黄酮醇类、2个二氢黄酮类、3个黄烷-3-醇类及3个其他类化合物。
2.5.1 黄酮醇及其苷类化合物的裂解规律 通过对准分子离子峰[M+H]+及[M-H]-进行分析发现,苷类化合物主要在糖苷键处发生断裂,形成失去1个或多个糖的次级苷或苷元碎片离子[21],苷类含有的糖基主要是葡萄糖、鼠李糖、芸香糖、甘露糖和半乳糖。在正、负离子模式下,共鉴定出9个黄酮醇类成分,分别为槲皮素3-O-鼠李糖苷7-O-葡糖苷、杨梅素、芦丁、毛里求斯排草素、山柰酚、槲皮素、异鼠李素、槲皮苷、美恩西汀[22] 。
在正离子模式下,该类化合物主要产生了丢失相应糖基的[M+H-C9H8O3]+、[M+H-C6H10O4]+、[M+H-C6H10O4-C6H10O5]+碎片离子。
以保留时间为6.282 min的化合物为例,其获得m/z 611.160[M+H]+的一级质谱信号,二级质谱出现脱去1分子鼠李糖的碎片离子m/z 465.102[M+H-C6H10O4]+和脱去1分子芸香糖的碎片离子m/z 303.050[M+H-C12H20O9]+,根据“2.3”项下数据库得到分子式C27H30O16,再结合文献[23],推测该化合物为芦丁。
以保留时间为6.707 min的化合物为例,其获得m/z 317.065[M+H]+的一级质谱信号,二级质谱出现m/z 302.042[M+H-CH3]+、153.018[M+H-C9H8O3]+的碎片离子峰,根据“2.3”项下数据库得到分子式C16H12O7,再结合文献[24],推测该化合物为异鼠李素。
以保留时间为6.514 min的化合物为例,其获得m/z 287.055[M+H]+的一级质谱信号,二级质谱出现m/z 153.018[C8H8O3]+、137.023[C8H8O2]+、121.029[M+H-CO-C8H10O2]+的碎片离子峰,根据“2.3”项下数据库得到分子式C15H10O6,再結合文献[25],推测该化合物为山柰酚。
以保留时间为6.513 min的化合物为例,其获得m/z 741.223[M+H]+的一级质谱信号,二级质谱出现依次脱去3分子糖基的碎片离子峰m/z 595.166[M+H-C6H10O4]+、449.108[M+H-C6H10O4-C6H10O4]+、287.055
[M+H-C6H10O4-C6H10O4-C9H8O3]+,根据“2.3”项下数据库得到分子式C33H40O19,再结合相关文献[26],推测该化合物为毛里求斯排草素。
可见,m/z 465.102、303.050、302.042、153.018、151.003、129.055、85.029等碎片离子是黄酮醇及苷类化合物裂解和糖断裂的特征离子。黄酮醇类化合物结构见图2。
2.5.2 黄烷-3-醇类化合物的裂解规律 在正、负离子模式下,共鉴定出3个黄烷-3-醇类成分,分别为表棓儿茶素、儿茶素、表没食子儿茶素没食子酸酯[27]。
通过对准分子离子峰[M+H]+及[M-H]-进行分析发现,在正离子模式下,以上3个化合物均得到脱去1分子水[M+H-H2O]+的碎片离子,如289.070[M+H-H2O]+、273.075[M+H-H2O]+,经过黄酮逆-狄尔斯-阿尔德反应(RDA)裂解途径得到碎片离子139.039[M+H-C8H8O4]+(A1+.)。表棓儿茶素较儿茶素多1个羟基,表没食子儿茶素没食子酸酯在表棓儿茶素的3位羟基处通过酯基连接1个苯环,因此表没食子儿茶素没食子酸酯在裂解过程中脱去苯环得到表棓儿茶素碎片离子,之后裂解规律同儿茶素,C环不同键位断裂获得多种A环碎片离子与B环碎片离子,或者丢失1分子H2O、1分子CO2获得碎片离子。可见,m/z 163.039、151.039、139.039等碎片离子是黄烷-3-醇类裂解和基团断裂的特征离子。黄烷-3-醇类化合物的结构式见图3。
2.5.3 二氢黄酮类化合物的裂解规律 在正、负离子模式下,共鉴定出2个二氢黄酮类成分,分别为黄颜木素、圣草酚[28]。
通过对准分子离子峰[M+H]+及[M-H]-进行分析发现,在正离子模式下,以保留时间为6.225 min的化合物为例,其获得m/z 289.070[M+H]+的一级质谱信号,二级质谱出现m/z 271.060[M+H-H2O]+和再依次脱去一氧化碳的碎片离子m/z 243.065[M+H-H2O-CO]+、215.070[M+H-H2O-CO-CO]+、187.131[M+H-H2O-CO-CO-CO]+,通过黄酮RDA裂解途径得到m/z 153.018[C8H8O3]+(B1+.)和m/z 137.079[C7H4O3]+(A1+.)的碎片峰,通过黄酮类裂解途径Ⅱ得到m/z 139.039[C8H10O2]+
(B2+.)的碎片峰,根据“2.3”项下数据库得到分子式C15H12O6,再结合文献[29],推测该化合物为黄颜木素。
以保留时间为9.063 min的化合物为例,其获得m/z 289.070[M+H]+的一级质谱信号,二级质谱出现m/z 271.060[M+H-H2O]+、153.018[C8H8O3]+(A1+.)的碎片峰,根据“2.3”项下数据库得到分子式C15H12O6,再结合文献[30],推测该化合物为圣草酚。圣草酚与黄颜木素的相对分子量相同,区别在于后者为二氢黄酮醇类,前者羟基连接在A环5位上。
可见,m/z 271.060、258.073、215.070、153.018、187.131、58.066等碎片离子是二氢黄酮类裂解和基团断裂的特征离子。二氢黄酮类化合物的结构式见图4。
2.5.4 其他黄酮类化合物的裂解规律 在正、负离子模式下共鉴定出3个其他黄酮类成分,分别为3-(2,3-二氢苯并[1,4]二噁英-6-基)-7-羟基-2-三氟甲基-4-酮、墨沙酮、Oriciacridone F[31]。其结构式见图5。
通过对准分子离子峰[M+H]+及[M-H]-进行分析发现,在负离子模式下,以保留时间为4.577 min的化合物为例,其获得m/z 363.049[M-H]-的一级质谱信号,二级质谱出现m/z 290.186[M-H-CO-C2H5O]-、177.874[C10H10O3]-的碎片峰,根据“2.3”项下数据库得到分子式C18H11F3O5,推测该化合物为3-(2,3-二氢苯并[1,4]二噁英-6-基)-7-羟基-2-三氟甲基-4-酮,属于异黄酮类化合物。
在正离子模式下,以保留时间为10.054 min的化合物为例,其获得m/z 621.223[M+H]+的一级质谱信号,二级质谱产生1分子 酮的碎片离子m/z 309.118[M+H-C18H17NO4]+,根据“2.3”项下数据库得到分子式C36H32N2O8,再结合文献[31],推测该化合物为Oriciacridone F,其基本骨架为 酮类,由2分子含氮 酮构成。
综上,黄酮及其苷类化合物的主要裂解方式是通过RDA裂解与黄酮类的基本裂解途径Ⅱ得到碎片离子A1+.、B1+.、B2+.,以及丢失芸香糖、葡萄糖、鼠李糖、甘露糖、半乳糖残基与OH、OCH3、CO等母环上的功能基团[32]。以黄颜木素为例,其裂解规律见图6。
2.6 香豆素类化合物的鉴定及裂解规律
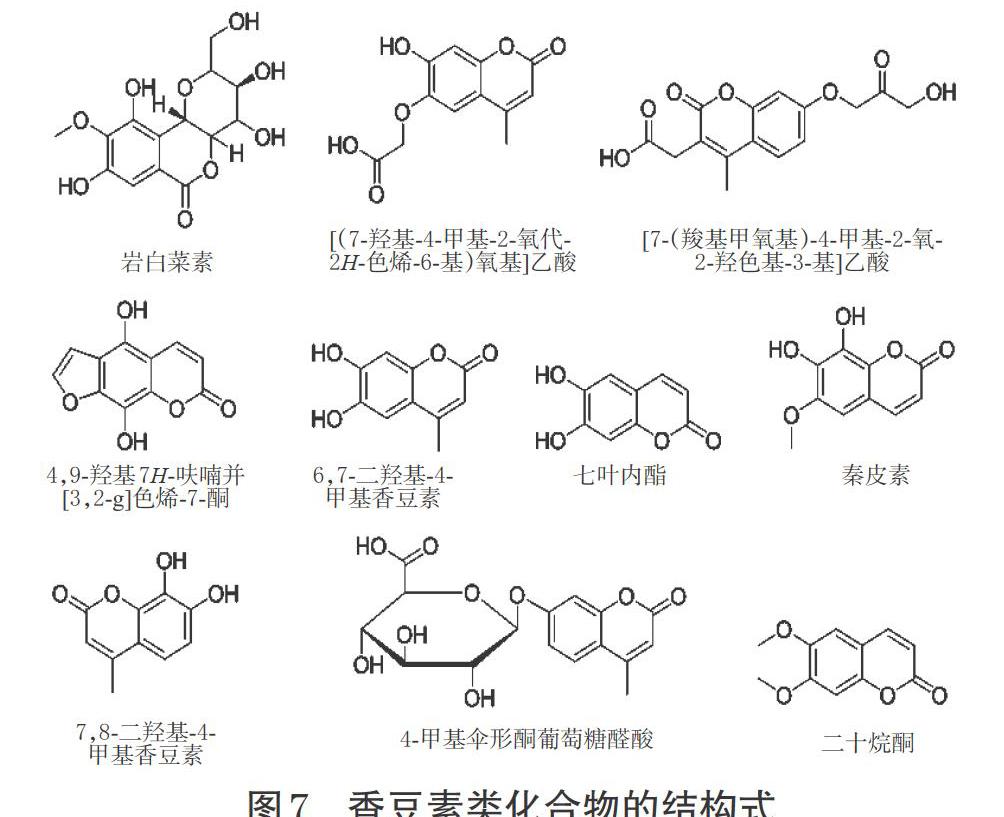
有研究发现,岩白菜素及其衍生物是八爪金龙药材中含量较高的成分[33]。岩白菜素属于异香豆素类化合物。在正、负离子模式下,共鉴定出10个香豆素类化合物,包括简单香豆素类化合物{[(7-羟基-4-甲基-2-氧代-2H-色烯-6-基)氧基]乙酸、[7-(羧基甲氧基)-4-甲基-2-氧-2-羟色基-3-基]乙酸、6,7-二羟基-4-甲基香豆素、七叶内酯、秦皮素、7,8-二羟基-4-甲基香豆素、4-甲基伞形酮葡萄糖醛酸、二十烷酮}、呋喃香豆素类化合物[4,9-二羟基7H-呋喃并(3,2-g)色烯-7-酮]及异香豆素类化合物(岩白菜素)。香豆素类化合物结构式见图7。
通过对准分子离子峰[M+H]+及[M-H]-进行分析发现,在负离子模式下,以保留时间为4.556 min的化合物为例,其获得m/z 327.072[M-H]-的一级质谱信号,二级质谱产生脱去1分子CH2O[M-H-CH2O]-的碎片峰m/z 297.333,再以及脱去1分子CH3O和1分子OH的碎片峰m/z 249.040[M-H-CH2O-CH3O-OH]-,根据“2.3”项下数据库得到分子式C14H16O9,再结合文献[34],推测该化合物为岩白菜素。
以保留时间为6.395 min的化合物为例,其获得m/z 193.049[M+H]+的一级质谱信号,二级质谱出现m/z 165.055[M+H-CO]+、147.117[M+H-CO-H2O]+的碎片峰,根据“2.3”项下数据库得到分子式C10H8O4,再结合文献[35]推测该化合物为6,7-二羟基-4-甲基香豆素。
可见,m/z 233.044、219.065、193.050、191.070、187.039、177.055、175.075、149.060、147.117、137.060、133.065、119.086、91.055、85.065等碎片離子是香豆素类裂解和糖苷键断裂的特征离子。
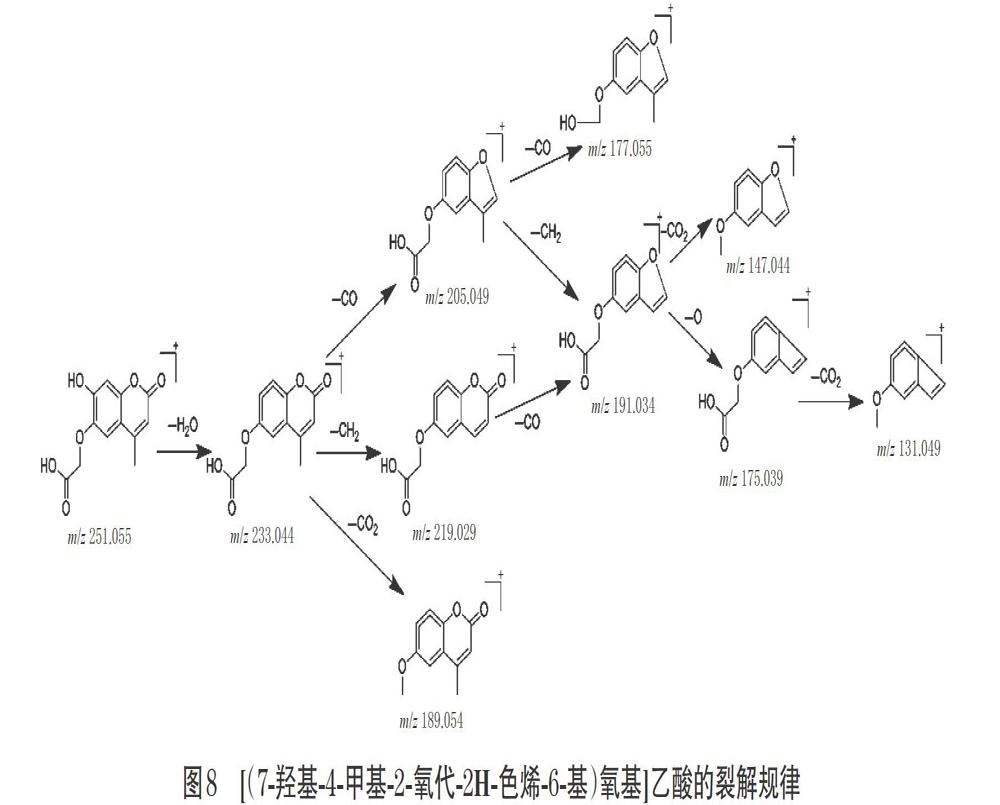
综上,香豆素类化合物的主要裂解途径是母核侧链上的H2O、CH3、OCH3、CO、CO2、COOH以及其他功能基团的断裂与丢失[36]。以[(7-羟基-4-甲基-2-氧代-2H-色烯-6-基)氧基]乙酸为例,其裂解规律[37]见图8。
2.7 岩白菜素的验证
取“2.2.1”项下3种供试品溶液及“2.2.2”项下对照品溶液适量,分别按“2.1”项下色谱与质谱条件进样分析,将供试品溶液得到的2号峰与岩白菜素对照品的保留时间、分子量和裂解碎片进行比对。结果,供试品溶液中2号峰的裂解规律与岩白菜素对照品基本一致;同时,结合现有文献[34,36],确定为2号峰为岩白菜素。
2.8 3种不同基原八爪金龙药材中黄酮类、香豆素类化合物的相对含量变化
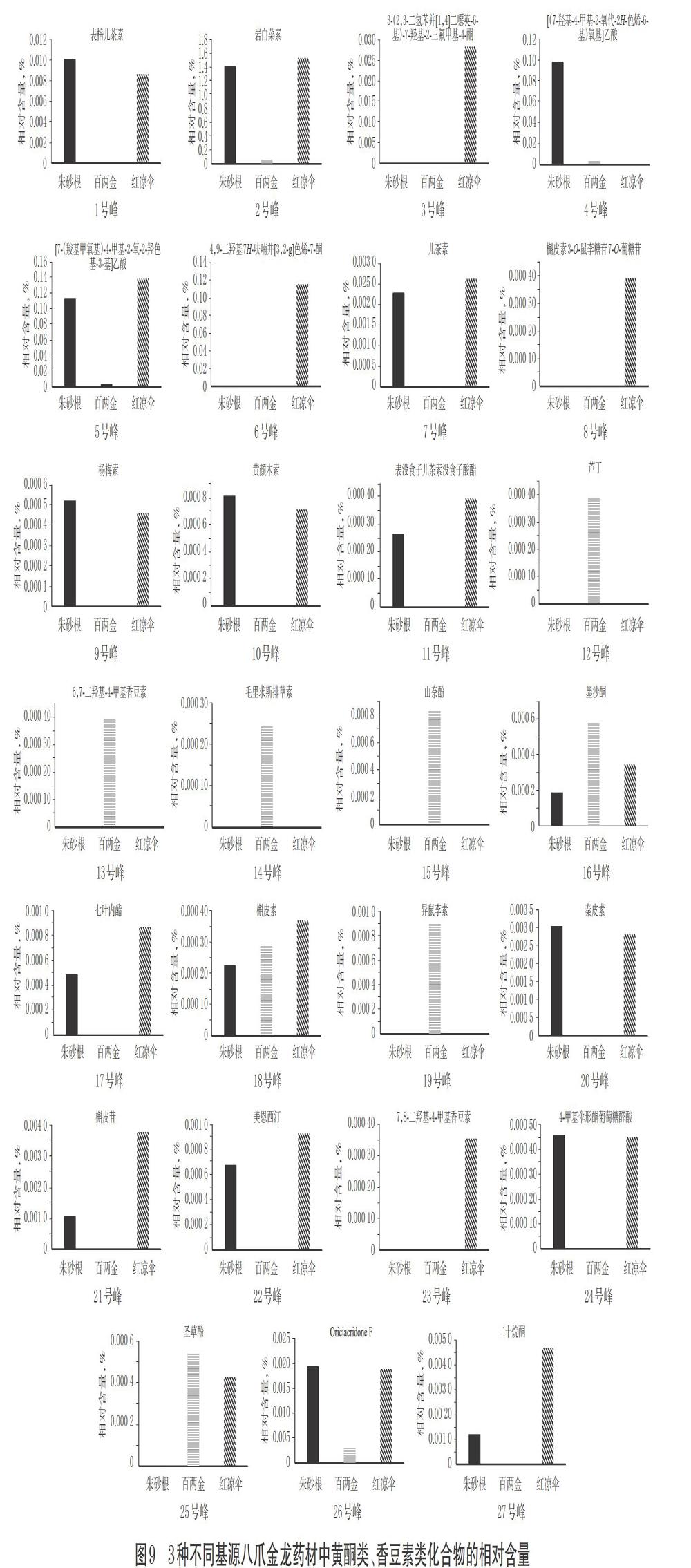
本研究以17个黄酮类及10个香豆素类化合物峰面积与岩白菜素峰面积的比值,作为前者的相对含量(2号峰以其峰面积均值计)。2003年版《贵州省中药材、民族药材质量标准》中规定以岩白菜素为八爪金龙药材的鉴别和含量测定的指标[1],加之岩白菜素峰面积较大、含量较高,故以岩白菜素为参照,在Compound Discoverer 3.1定性分析软件提取峰面积的基础上对数据进行处理分析,得到3种不同基原八爪金龙药材中同一化合物的相对含量。结果,黄酮类、香豆素类化合物中,3种不同基原八爪金龙药材中共有5个共有成分,分别为岩白菜素(2号峰)、[7-(羧基甲氧基)-4-甲基-2-氧-2-羟色基-3-基]乙酸(5号峰)、墨沙酮(16号峰)、槲皮素(18号峰)、Oriciacridone F(26号峰),且共有成分的含量存在明显差异。
其中,2、5号峰对应的化合物在朱砂根、红凉伞中的相对含量较高,说明其是重要的香豆素类成分;16号峰对应的化合物在百两金中的含量明显高于朱砂根和红凉伞;18号峰对应的化合物在红凉伞中的含量较高,在朱砂根中的含量较低,相对含量顺序依次为红凉伞>百两金>朱砂根;2、5、26号峰对应的化合物在朱砂根和红凉伞中含量相近且均明显高于百两金。
除5个共有成分外,其余22个成分均为差异化学成分,分别为1、3~4、6~15、17、19~25、27号峰对应的化合物,其中1、7、9~11、17、20~22、24、27号峰对应的化合物存在于朱砂根和红凉伞中,且大多含量相近;3、6、8、23号峰对应的化合物仅存在于红凉伞中;12~15、19号峰对应的化合物仅存在于百两金中,详见图9。
3 讨论
本研究采用四极杆-静电场轨道阱高分辨质谱法在正、负离子模式下对不同基原八爪金龙药材进行了鉴定。结果,共鉴定出17个黄酮类化合物和10个香豆素类化合物。同时,对其主要质谱裂解碎片进行了归属,并分析了其可能的裂解规律[38]。这17个黄酮类化合物包括槲皮素3-O-鼠李糖苷7-O-葡糖苷、杨梅素、芦丁、毛里求斯排草素、山柰酚、槲皮素、异鼠李素、槲皮苷、美恩西汀、表棓儿茶素、儿茶素、表没食子儿茶素没食子酸酯、黄颜木素、圣草酚、3-(2,3-二氢苯并[1,4]二噁英-6-基)-7-羟基-2-三氟甲基-4-酮、墨沙酮、Oriciacridone F,10个香豆素类化合物包括[(7-羟基-4-甲基-2-氧代-2H-色烯-6-基)氧基]乙酸、[7-(羧基甲氧基)-4-甲基-2-氧-2-羟色基-3-基]乙酸、6,7-二羟基-4-甲基香豆素、七叶内酯、秦皮素、7,8-二羟基-4-甲基香豆素、4-甲基伞形酮葡萄糖醛酸、二十烷酮、4,9-二羟基7H-呋喃并[3,2-g]色烯-7-酮、岩白菜素;黄酮类化合物的特征断裂主要為C环开裂及基团丢失导致C环变形,C环上的化学键能够以任意组合发生裂解,得到A环和B环碎片离子;此外,A环能够配合C环的断裂而发生改变,如生成三键或双键变单键,苷类化合物的糖基多为C-3位取代,也有C-7位取代,但糖基的断裂首先发生在C-3位。香豆素类化合物的特征断裂主要为所连基团的丢失及内酯环的变化。
本研究中,不同基原八爪金龙药材中黄酮类及香豆素类化合物共有5个共有成分,且其相对含量存在明显差异,其中2、5和26号峰对应的化合物在朱砂根和红凉伞中的相对含量相近,且高于百两金;16号峰对应的化合物在百两金中的相对含量高于朱砂根和红凉伞,18号峰对应化合物的相对含量顺序依次为红凉伞>百两金>朱砂根。有4个黄酮类(12、14、15、19号峰对应的化合物)、1个香豆素类(13号峰对应的化合物)化合物仅存在于百两金中,其中19号峰对应的化合物(异鼠李素)的相对含量较高,可作为区别百两金与其他两种基原八爪金龙药材的指标成分。异鼠李素是一种黄酮醇类化合物,具有抗肿瘤、降血压、降血脂、抗氧化及扩张冠状动脉等药理作用[39]。有2个黄酮类(3、8号峰对应的化合物),2个香豆素类(6、23号峰对应的化合物)仅存在于红凉伞中,其中6号峰对应的化合物(4,9-二羟基7H-呋喃并[3,2-g]色烯-7-酮)相对含量较高,可作为区别红凉伞与其他两种基原八爪金龙药材的指标成分。槲皮素3-O-鼠李糖苷-7-O-葡糖苷是一种黄酮苷类化合物,具有较强的抗氧化活性[40]。但黄酮类及香豆素类化合物的有无及含量差异是否会导致八爪金龙药理活性的不同尚无法确定,仍有待进一步研究。此外,百两金中黄酮类化合物的种类和含量均多于朱砂根和红凉伞,其他化合物的相对含量差异较大,而朱砂根与红凉伞较相似,因此百两金与朱砂根、红凉伞是否能够作为同一基原八爪金龙药材入药尚有待进一步探讨。
综上所述,UPLC-QE-HF-MS/MS法可高效、精确、快速地鉴别不同基原八爪金龙药材中黄酮类、香豆素类化学成分。
参考文献
[ 1 ] 贵州省药品监督管理局.贵州省中药材、民族药材质量标准:2003年版[S].贵阳:贵州科技出版社,2003:164.
[ 2 ] 项楠.慢咽散治疗慢性咽炎133例[J].云南中医中药杂志,1996(4):72-73.
[ 3 ] 项楠.八爪金龙为主治疗慢性咽炎的临床疗效观察:附:133例病例报告[J].成都中医药大学学报,1996,19(4):24-25、29.
[ 4 ] 何国菊,熊朋飞.苗药八爪金龙中岩白菜素的碱法提取工艺研究[J].贵阳学院学报(自然科学版),2014,9(2):64-68.
[ 5 ] 樊丹怡,常宏,邹嵘,等.紫外-可见分光光度法测定八爪金龙中总皂苷的含量[J].中国医院用药评价与分析,2015,15(7):864-866.
[ 6 ] 王瑞,刘晓燕,马立志,等.苗药八爪金龙半仿生提取工艺优选及其提取物抑菌活性研究[J].时珍国医国药,2009,20(12):3092-3094.
[ 7 ] 刘斌,谭成玉,池晓会,等.岩白菜素的研究进展[J].西北药学杂志,2015,30(5):660-662.
[ 8 ] 徐畅,刘意隆,高志伟,等.杨梅素及其苷类药理活性研究进展[J].中国中药杂志,2020,45(15):3575-3583.
[ 9 ] RAO AS,ADAV SS,SINGH P,et al. A comprehensive review on ethnomedicine,phytochemistry,pharmacology,and toxicity of Tephrosia purpurea(L.)Pers[J]. Phytother Res,2020,34(8):1902-1925.
[10] 蒋虎刚,赵信科,蔺文燕,等.基于HPLC-Q-TOF-MS/MS定性分析当归中多种香豆素类成分[J].中国实验方剂学杂志,2019,25(13):157-162.
[11] 许文,傅志勤,林婧,等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J].药学学报,2014,49(12):1711-1717.
[12] WANG RL,ZHANG L,ZHANG ZJ,et al. Comparison of ESI-and APCI-LC-MS/MS methods:a case study of levonorgestrel in human plasma[J]. J Pharm Anal,2016,6(6):356-362.
[13] 刘岱琳.朱砂根和密花石豆兰活性成分的研究[D].沈阳:沈阳药科大学,2004.
[14] 黄伟.百两金抗肿瘤活性成分研究[D].长沙:中南大学,2007.
[15] 王雪.红凉伞抗肿瘤转移化学成分研究[D].天津:天津医科大学,2011.
[16] 张伟,李锟,李东,等.朱砂根化学成分和药理作用研究进展[J].中国实验方剂学杂志,2011,17(11):279-282.
[17] 蔡佳仲.朱砂根和树豆叶的化学成分及抗肿瘤作用研究[D].广州:广州中医药大学,2012.
[18] 赵欧,杜莹,班大明,等.苗药八爪金龙中生物活性成分的研究:Ⅰ[J].湖北农业科学,2013,52(19):4723-4725、4747.
[19] MA L,LI W,WANG HQ,et al. A simple and rapid method to identify and quantitatively analyze triterpenoid saponins in Ardisia crenata using ultrafast liquid chromatography coupled with electrospray ionization quadrupole mass spectrometry[J]. J Pharm Biomed Anal,2015. DOI:10.1016/j.jpba.2014.10.013.
[20] 朱思.朱砂根品質评价及其相关药效学研究[D].福州:福建中医药大学,2016.
[21] 党立志,张翼鹏,张健,等. LC-MS技术快速识别迷迭香中黄酮苷类化合物[J].云南农业大学学报(自然科学),2017,32(2):358-365.
[22] MA CY,LV HP,ZHANG XZ,et al. Identification of regioisomers of methylated kaempferol and quercetin by ultra high performance liquid chromatography quadrupole time-of-flight(UHPLC-QTOF)tandem mass spectrometry combined with diagnostic fragmentation pattern analysis[J]. Anal Chim Acta,2013. DOI:10.1016/j.aca.2013.07. 038.
[23] 伍明江,吴晓磊,张德芹,等. UPLC-Q-TOF/MS鉴定芦丁在大鼠体内的代谢产物[J].中国实验方剂学杂志,2017,23(17):91-97.
[24] 曾美玲,沈耐涛,吴赛伟,等.基于UPLC-Triple-TOF/MS方法的三叶青化学成分分析[J].中草药,2017,48(5):874-883.
[25] 夏玮,古丽加玛丽·阿比斯,潘晨,等.腊梅花中黄酮类化合物的UHPLC/QTOF-MS分析[J].中成药,2014,36(11):2345-2349.
[26] 吕子明,张庆建,陈若芸,等.陵水暗罗枝、叶中的化学成分[J].中国中药杂志,2011,36(8):1024-1027.
[27] 刘国强,董静,王弘,等. 4种儿茶素类化合物电喷雾质谱裂解规律的研究[J].高等学校化学学报,2009,30(8):1566-1570.
[28] MENEZES JCJMDS,CAVALEIRO JAS,KAMAT SP,et al. Electrospray tandem mass spectrometry analysis of methylenedioxy chalcones,flavanones and flavones[J].Rapid Commun Mass Spectrom,2013,27(12):1303- 1310.
[29] ZHANG X,YIN JT,LIANG CJ,et al. UHPLC-Q-TOF- MS/MS method based on four-step strategy for metabolism study of fisetin in vitro and in vivo[J]. J Agric Food Chem,2017,65(50):10959-10972.
[30] 张栋健,李薇,何庆文,等. UHPLC-Q-TOF-MS分析枳壳炮制前后成分变化[J].中国中药杂志,2016,41(11):2070-2080.
[31] WANSI JD,WANDJI J,MEVAA LM,et al. Α-glucosidase inhibitory and antioxidant acridone alkaloids from the stem bark of Oriciopsis glaberrima E NGL.(Rutaceae)[J]. Chem Pharm Bull(Tokyo),2006,54(3):292-296.
[32] 李偉,冯育林,黎田儿,等. UPLC-Q-TOF/MS技术结合诊断离子方法快速分析连钱草中黄酮类化合物[J].质谱学报,2016,37(6):504-516.
[33] 赵欧,杜莹.高效液相色谱法测定八爪金龙及组方制剂中岩白菜素的含量[J].湖北农业科学,2016,55(1):186-188.
[34] LI BH,WU JD,LI XL. LC-MS/MS determination and pharmacokinetic study of bergenin,the main bioactive component of Bergenia purpurascens after oral administration in rats[J]. J Pharm Anal,2013,3(4):229-234.
[35] UNC Institute. 6,7-dihydroxy-4-methylcoumarin[J]. Acta Crystallographica,2007. DOI:10.1107/s160053680705- 9272.
[36] 任晓蕾,霍金海,孙国东,等. UPLC-Q-TOF-MS法分析防风中香豆素类化学成分[J].中国药房,2019,30(3):349-354.
[37] REN YP,WAN CC,LIAO M,et al. Pharmacokinetics and excretion study of bergenin and its phase II metabolite in rats by liquid chromatography tandem mass spectrometry[J]. Biomed Chromatogr,2019. DOI:10.1002/bmc.4513.
[38] 徐雨,王建.头孢菌素类药物在负离子模式下电喷雾质谱裂解规律研究[J].药物分析杂志,2019,39(6):1019- 1030.
[39] SHI H,HE J,LI X,et al. Isorhamnetin,the active constituent of a Chinese herb Hippophae rhamnoides L,is a potent suppressor of dendritic-cell maturation and trafficking[J]. Int Immunopharmacol,2018. DOI:10.1016/j.intimp.2017.12.014.
[40] ZHU JF,ZHONG L,KONG SS,et al. Comprehensive evaluation of the antioxidant capacity of Sceptridium ternatum using multiple colorimetric methods and 1,1-diphenyl-2-picrylhydrazyl-high-performance liquid chromatography analysis[J]. J Sep Sci,2020,43(18):3615-3624.
(收稿日期:2020-11-01 修回日期:2021-01-06)
(编辑:陈 宏)
