免疫抑制合并重症肺炎患者预后评估指标的筛选
2021-04-08邢夏胡春玲段甲利刘洋孙孟飞邢丽华
邢夏,胡春玲,段甲利,刘洋,孙孟飞,邢丽华
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
近年来,免疫抑制患者不断增多。研究表明,近20%社区获得性肺炎(community-acquired pneumonia, CAP)患者存在免疫抑制[1]。然而免疫抑制患者往往起病隐匿,进展迅速,预后极差。文献报道,免疫抑制并急性低氧性呼吸衰竭患者的短期病死率约50%,其中大部分由肺部感染引起[2]。因此,早期识别潜在预后不良患者,及时优化医疗资源配置对于免疫抑制并重症肺炎患者至关重要。然而,多数研究均将免疫抑制人群排除在外[3-5],故开展本研究以筛选有助于评估免疫抑制合并重症肺炎患者预后的临床指标。
1 资料与方法
1.1 研究对象
1.1.1研究对象的选取 回顾性分析2018年8月至2020年1月郑州大学第一附属医院呼吸重症监护病房(respiratory intensive care unit,RICU)收治的83例免疫抑制合并重症肺炎患者的临床资料。纳入标准:(1)符合2007年美国感染病学会/美国胸科协会(Infectious Diseases Society of America/American Thoracic Society,IDSA/ATS)重症肺炎诊断标准[6];(2)满足以下至少1项免疫抑制条件[7-8],①接受长期(≥3个月)或大剂量[>0.5 mg·(kg·d)-1]皮质类固醇或其他免疫抑制剂,②接受实体器官移植,③近5年需要接受放化疗,④活动性结核病。排除标准:(1)年龄<18岁;(2)妊娠妇女;(3)急性心脑血管疾病;(4)血液系统肿瘤;(5)获得性免疫缺陷综合征;(6)ICU住院时间<48 h;(7)临床资料不完整。
1.1.2分组 根据28 d预后将患者分为好转组(48例)和恶化组(35例)。(1)好转组:①临床症状(脓性气道分泌物、咳嗽、咳痰、呼吸困难)减轻或缓解;②体温恢复正常或保持正常;③胸部影像学提示肺部病变好转。(2)恶化组:①临床症状加重;②经过积极治疗后,体温仍控制不佳(>38 ℃);③胸部影像学示新出现或进展性的浸润影、实变影或磨玻璃影、胸腔积液等;④出现新的并发症;⑤住院28 d内死亡。
1.1.3一般资料 好转组男29例,女19例,年龄18~97(51.15±16.21)岁;其中活动性结核病2例,实体器官恶性肿瘤9例,自身免疫性疾病16例,肾病综合征13例,实体器官移植术后8例。恶化组男19例,女16例,年龄21~81(56.17±17.09)岁;其中活动性结核病2例,实体器官恶性肿瘤13例,自身免疫性疾病10例,肾病综合征8例,实体器官移植术后2例。两组性别、年龄、基础疾病差异无统计学意义(P>0.05)。本研究为回顾性研究,经过郑州大学第一附属医院医学伦理委员会批准(2020-KY-368),所有检验项目均获得患者或家属的知情同意。
1.2 观察指标
1.2.1数据收集 (1)所有患者均于入ICU 24 h内根据生理学参数及实验室检查结果计算急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation,APACHE Ⅱ)及英国胸科协会改良肺炎评分(confusion, urea, respiratory rate, blood pressure plus age ≥65 years,CURB-65);(2)收集患者入ICU第1天外周血淋巴细胞亚群结果,记录入ICU第1、3、5、7天血常规、降钙素原(procalcitonin,PCT)及C反应蛋白(C reactive protein,CRP)结果,并根据中性粒细胞、血小板、淋巴细胞计数分别计算中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)及血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)。
1.2.2检测方法 (1)外周血淋巴细胞亚群分析:采用三色流式细胞术,分别对CD3-PE、CD4-FITC、CD8-APC抗体及同行对照抗体标记(购自美国BD公司),并于BD公司的FACScalibur流式细胞仪分析总T细胞(CD3+T细胞)、CD4+T细胞、CD8+T细胞及CD4+/CD8+比值。(2)PCT及CRP水平测定:选用德国罗氏Cobas-8000全自动生化免疫流水线,PCT检测采用双抗体夹心免疫荧光法,CRP水平测定采用免疫速率比浊法。(3)血常规:采用美国Beckman-Coulter 750/800全自动五分类血液分析流水线测定。所有检测步骤均严格按照操作指导执行,检测中使用室内质量控制程序确保结果准确、可靠。

2 结果
2.1 两组患者炎症指标、免疫状态及病情严重程度恶化组NLR、APACHE Ⅱ评分及CURB-65评分高于好转组,CD4+、CD3+T细胞计数低于好转组,差异有统计学意义(P<0.05)。两组间PLR、PCT、CRP、CD8+T细胞、CD4+/CD8+差异无统计学意义(P>0.05)。见表1。
2.2 各指标在免疫抑制并重症肺炎早期病程中的变化入ICU 7 d内,恶化组患者各测量时间NLR均高于好转组同期,差异有统计学意义(P<0.05)。两组间各时间点PLR差异均无统计学意义(P>0.05)。好转组PCT、CRP在入ICU第3天达到峰值,之后呈下降趋势,且第5、7天的PCT、CRP均低于恶化组同期,差异有统计学意义(P<0.05)。见表2。
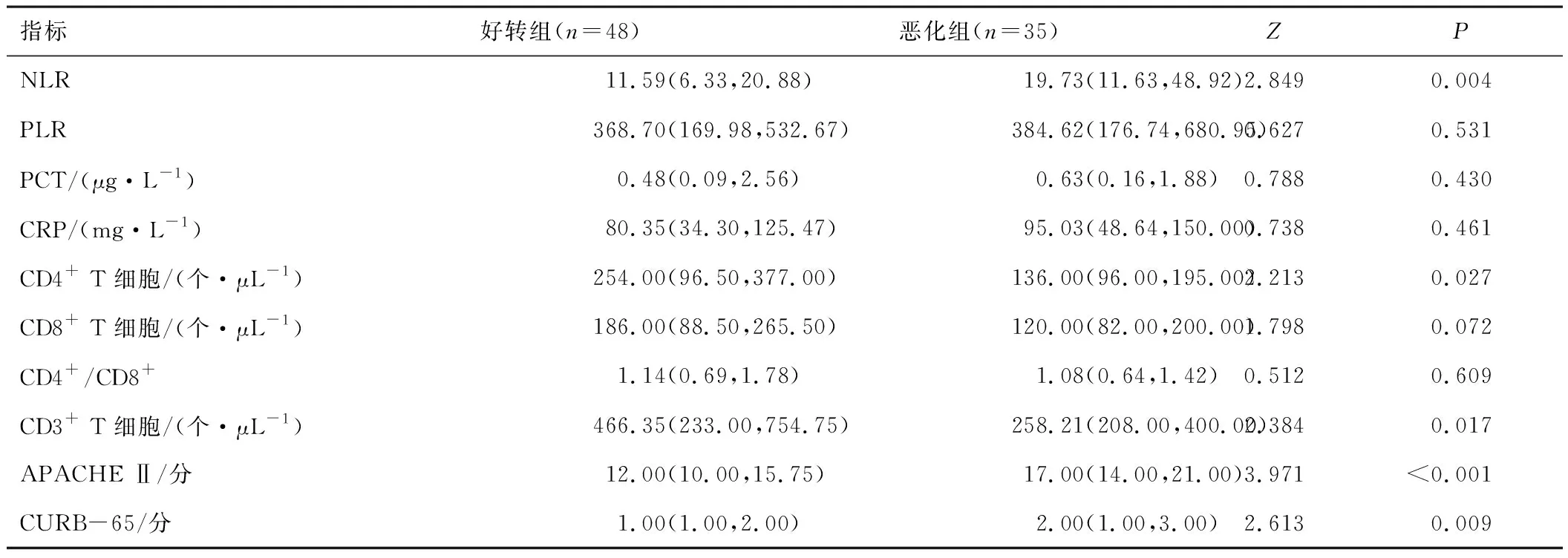
表1 两组患者NLR、PCT、CRP、淋巴细胞亚群及病情严重程度评分的比较[ M(P25,P75)]
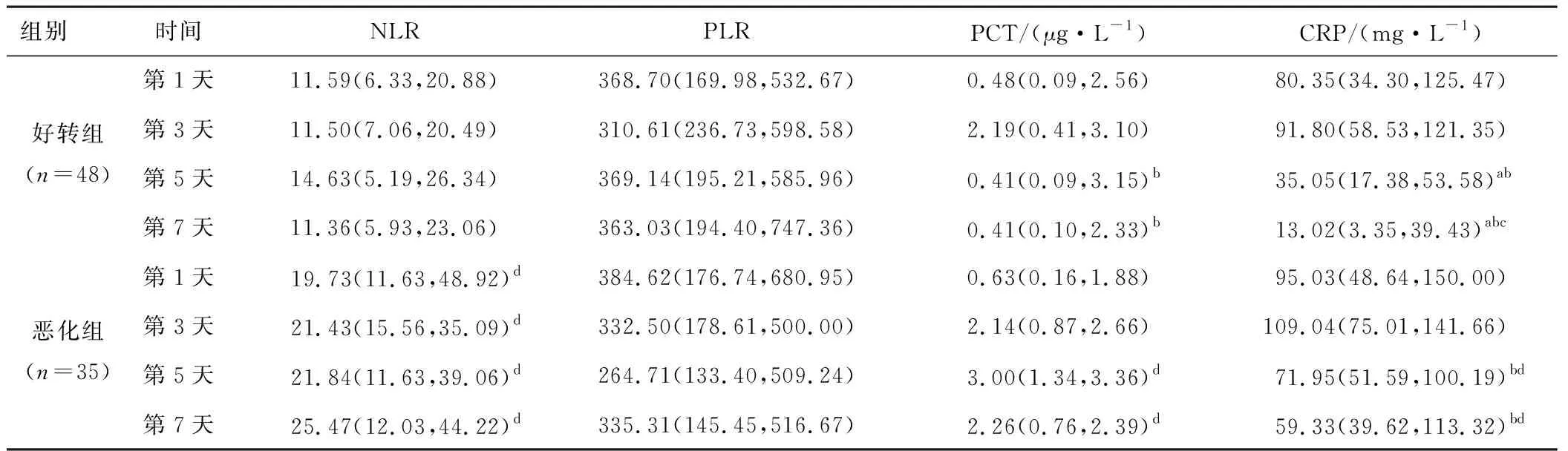
表2 两组患者入ICU 7 d内临床指标的变化比较[M(P25,P75)]
2.3 入ICU 24 h内NLR与各指标的相关性入ICU 24 h内,NLR与APACHE Ⅱ评分(r=0.261,P=0.017)、CURB-65评分(r=0.227,P=0.039)呈正相关,与CD3+T细胞计数(r=-0.396,P<0.001)、CD4+T细胞计数 (r=-0.352,P=0.001)呈负相关,与PCT(r=0.206,P=0.062)、CRP(r=0.030,P=0.785)无相关性。
2.4 各指标对于免疫抑制合并重症肺炎28 d预后的预测价值ROC曲线分析显示, 入ICU第1、3、5、7天NLR及入ICU 24 h内的APACHE Ⅱ、CURB-65评分、CD3+T细胞计数、CD4+T细胞计数对于免疫抑制合并重症肺炎患者28 d预后均有一定的预测价值(P<0.05),通过计算各AUC发现:AUCAPACHE Ⅱ(0.756)>AUC第3天NLR(0.703)>AUC第1天NLR(0.684)>AUC第7天NLR(0.675)>AUC第5天NLR(0.666)>AUCCURB-65(0.660)>AUCCD3+ T细胞计数(0.654)> AUCCD4+ T细胞计数(0.643),而入ICU 24 h内的PCT、CRP及PLR对其28 d预后的预测效果欠佳(P>0.05)。见表3。
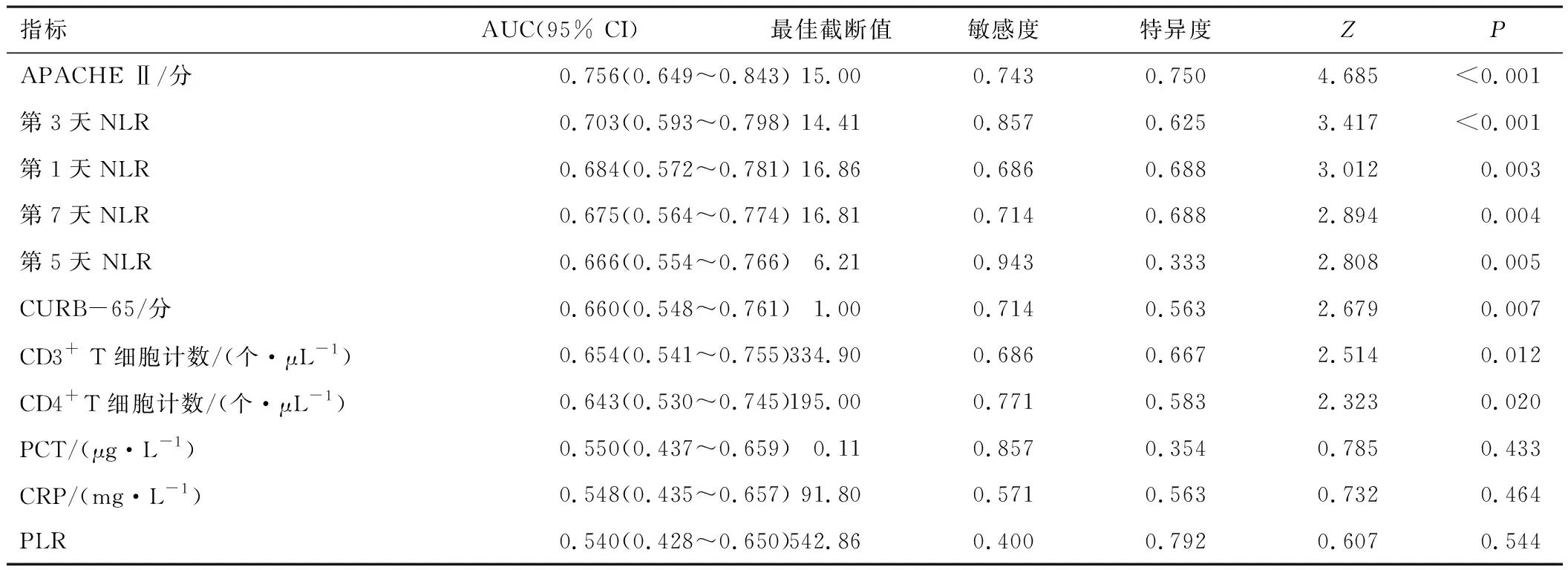
表3 各指标对免疫抑制并重症肺炎28 d预后的评估效能
3 讨论
免疫抑制患者极易并发感染,肺是常见的靶器官之一。炎症反应失控和免疫失衡是重症感染的核心问题之一,在重症感染状态下,人体的固有免疫和适应性免疫系统被过度激活,促炎反应与抗炎反应失衡,淋巴细胞大量消耗并凋亡,导致固有免疫功能异常及适应性免疫功能障碍[9]。而这一过程在本身具备免疫抑制高危因素的患者中更为错综复杂。对于长期接受糖皮质激素、免疫抑制剂或其他细胞毒性药物治疗的患者而言,适应性免疫,尤其细胞免疫是免疫缺陷的主要类型之一。CD4+T细胞是适应性免疫中不可替代的组成部分,也是促使CD8+T细胞激活的基础,在调节免疫细胞功能、介导体液免疫和细胞免疫应答中发挥重要作用[9],本研究发现在入ICU 24 h内恶化组CD3+T细胞、CD4+T细胞计数显著低于好转组,提示恶化组患者的免疫抑制更为严重。
尽管越来越多旨在评估病情严重程度、预测转归的临床指标在不断开发,但CRP、PCT仍是目前肺炎诊断和病情评估中应用最广泛的生物标志物[10]。然而,CRP特异性较差,易受到基础疾病的影响[11],研究表明其判断CAP预后的作用欠佳[4];PCT常用于判断细菌感染和指导抗菌药物合理使用[12],然而免疫抑制患者更易存在病毒、真菌感染[7],因此,其在免疫抑制合并重症肺炎中的应用价值仍有待进一步证实。本研究中,两组患者入ICU第1 、3天 PCT、CRP水平无明显差异,提示PCT、CRP无法早期评估免疫抑制合并重症肺炎患者的预后。近年来,简单、廉价的血细胞参数再次引起研究者们的关注,PLR等作为炎症指标被用于多种疾病的病情及预后评估中[13-14]。然而,本研究发现,两组患者的PLR水平在入ICU第1、3、5、7天均无显著差异,提示对于免疫抑制合并重症肺炎患者而言,PLR并不是评估预后的良好指标。
本研究ROC曲线结果显示,CRP、PCT及PLR这些在免疫功能正常人群中表现良好的炎症指标均无法达到早期、敏感地评估免疫抑制合并重症肺炎患者28 d预后的目的。NLR作为中性粒细胞与淋巴细胞计数的比值,能够更加准确地反映中性粒细胞与淋巴细胞之间的动态平衡及机体炎症反应与免疫状态的相对关系。本研究相关性分析发现,NLR与CD3+、CD4+T细胞计数呈负相关,提示NLR能够在一定程度上反映患者的免疫状态;同时,NLR与APACHE Ⅱ评分及CURB-65评分呈正相关,分别与Zahorec[15]、De Jager[16]等的研究结果类似,表明NLR能够在一定程度上反映免疫抑制并重症肺炎患者的病情严重程度。通过对入ICU早期的NLR动态观察发现,恶化组的NLR在入ICU第1、3、5、7天均高于好转组,这一发现与Curbelo等[17]的研究一致,提示NLR的长期升高与患者预后不良有关,长期的炎症反应失控和免疫功能低下是导致免疫抑制合并重症肺炎患者预后不良的主要原因。
在对免疫抑制合并重症肺炎患者28 d预后的评估方面,APACHE Ⅱ评分的AUC最大(0.756),提示其预测效能最佳,而入ICU后第1、3、5、7天的NLR均有一定的预测能力,其中以第3天NLR预测能力较优(AUC=0.703,仅次于APACHE Ⅱ评分的AUC)。这一发现与Curbelo J等[17]的研究相一致,该研究表明入院时及病情进展早期(入院3~5 d)的NLR对于CAP患者预后均具有预测能力,并以后者的预测效能更优。另有研究表明NLR对于CAP患者30 d病死率的预测能力优于CURB-65评分[18],与本研究相一致。APACHE Ⅱ评分是重症监护室目前应用最为广泛的病情评价系统之一[19],但其计算过程较为繁琐,且需要众多相关化验结果,在实际临床工作中很难快速获得,在病程中的及时动态评估也较难实现。CURB-65评分是常用的判断CAP严重程度的评分系统,其计算简单,便于临床应用[20],但在本研究中对于免疫抑制并重症肺炎患者的预后评估效果不佳,可能的原因在于:(1) 其开发并不只针对重症人群,对于重症肺炎而言,这一评分系统显得不够全面;(2) 本研究中纳入的免疫抑制患者普遍较年轻,其中有60例(72.3%)患者年龄<65岁,应用于把年龄作为重要参数的CURB-65评分并不合适。而NLR是从血常规的两项指标中通过简单计算得到,获取方便,价格低廉,能够实现对于免疫抑制并重症肺炎患者病程中的动态监测与及时评估。
综上,APACHE Ⅱ评分、CURB-65评分、CD3+T细胞计数、CD4+T细胞计数及NLR均对免疫抑制并重症肺炎患者28 d预后有一定的预测能力。NLR能在一定程度上反映该部分患者的免疫状态及病情严重程度,NLR长期维持较高水平提示患者预后不良。因此,早期动态监测NLR有助于临床医生敏锐了解患者的病情变化及合理分配医疗资源。
