辛二酰苯胺异羟肟酸对胃癌MKN-28细胞增殖、凋亡的影响
2021-04-08冯华夷张晓威陆航
冯华夷,张晓威,陆航
(1.上海市徐汇区中心医院 普通外科,上海 200031;2.锦州医科大学附属第一医院 普通外科,辽宁 锦州 121000)
作为最常见的消化系统恶性肿瘤之一,胃癌在我国消化道恶性肿瘤中位居第二。胃癌同一些恶性肿瘤一样具有早期诊断率低和死亡率高的特征[1]。在世界范围内每年有成千上万的新增病例和相关死亡病例,因此胃癌是一种严重威胁人类健康的疾病。而目前针对这种严重威胁人类生命健康的疾病只有根治性手术是有效的治疗手段。但是,许多患者在诊断时已经进展到不可切除的阶段或已有远处转移。虽然新辅助化疗能够延长进展期胃癌患者的生存期,但是其中位生存率依然较低。对于那些不能切除或已发生远处转移的患者,姑息性化疗能够提高患者的生存率和生活质量。然而,包括氟尿嘧啶和顺铂在内的作为进展期胃癌治疗标准的化疗药物对进展期胃癌最终的治疗效果仍然不佳。因此,进一步从分子水平上更好地了解这种疾病以及探索新的更有效的治疗药物是非常必要的。近年来,针对恶性肿瘤的分子靶向治疗成为研究的热门领域,其中一些分子靶向药物获得了预期的临床治疗效果[2-3]。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)作为一种新型的组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI),能够改变包括肿瘤细胞的增殖和基因表达的调节等相关过程中的组蛋白和非组蛋白的乙酰化水平。之前的研究发现,HDACI能够通过翻译后修饰导致与肿瘤细胞生长抑制、分化、凋亡和自噬相关的细胞死亡[4]。此外,当与其他药物联合使用时,HDACI具有协同效应[5]。现在,SAHA已经应用于难治性皮肤淋巴瘤的治疗,因为其能够通过诱导细胞调节和分化使细胞周期阻滞[6]。最近,许多组织机构研究其在治疗其他肿瘤方面的效应[7-8]。近些年,SAHA在治疗胃肠道肿瘤方面获得了良好的效果[9]。然而,SAHA对胃癌的抗癌效应分子机制尚不清晰。所以,我们通过研究胃癌细胞株MKN-28暴露于SAHA后细胞增殖、衰老及凋亡的变化,希望对于胃癌的分子靶向治疗提供一种理论和实验基础以及对胃癌临床治疗的新理解。
1 材料与方法
1.1 材料实验材料包括胃癌MKN-28(上海细胞库)细胞株、二甲亚砜 (DMSO)、四甲基偶氮唑蓝 (MTT)、RPMI-1640培养基、胰蛋白酶、小牛血清、Triton X-100及碘化丙啶PI(美国Sigma公司),检测细胞周期、细胞凋亡的试剂盒(南京凯基生物科技发展有限公司)。抗体包括乙酰化组蛋白H3(actylation-histone 3,AC-H3)抗体、乙酰化组蛋白H4(actylation-histone 4,AC-H4)抗体、细胞周期蛋白(cyclin D1)、β-actin抗体、兔Ⅱ抗、鼠Ⅱ抗(Santa Cruz公司)。SAHA(20 mg)先以DMSO溶解后,再以培养基RPMI-1640稀释至1 mmol·L-1,作为母液备用。
1.2 细胞培养在RPMI-1640培养基内(其中含体积分数为10%的小牛血清),37 ℃ ,体积分数为5%的CO2的孵箱内培养细胞,每48~72 h 传代,2.5 g·L-1胰酶消化。选取对数期的细胞实施后续的实验。
1.3 MTT比色法检测细胞的增殖选用处于对数期的细胞,依照大约每孔1×10个接种到96孔板,实验组分别加入药物,且使SAHA终浓度为0.5、1.0、1.5、2.0、3.0、5.0、10.0 μmol·L-1,而将同等量的DMSO加在对照组中,每个实验组设5个重复孔。完全培养基中,37 ℃,体积分数为5%的CO2培养箱培养24、48、72 h后,每孔加20 μL MTT,继续孵育4 h,丢弃上清液,然后将150 μL DMSO加入其中溶解,震荡混合均匀,用酶标仪测定在490 nm处样品的吸光度值,并取其平均值后绘制生长曲线。对照组与实验组吸光度的差值占对照组吸光度值的百分比为细胞的生长抑制率。
1.4 细胞衰老检测按照细胞衰老β-半乳糖苷酶染色试剂盒说明书中的实验步骤检测与β-半乳糖苷酶相关的细胞衰老。首先,丢弃细胞培养液后用磷酸盐缓冲液(PBS)对MKN-28细胞进行3次清洗,然后用40 g·L-1多聚甲醛对MKN-28细胞进行固定15 min。再对MKN-28细胞使用PBS清洗3次,在其中加入0.05 g·L-1X-gal后将样品放在37 ℃温度且避光的培养箱内孵育过夜。最后,在显微镜(Olympus,Tokyo,Japan)下(400×)观察细胞并拍照。实验重复3次。
1.5 凋亡实验细胞培养及处理如前述。使用流式细胞仪测定碘化丙啶(PI)染色和荧光素(FTIC)标记的Annexin Ⅴ,从而检测MKN-28细胞的凋亡。简言之,用PBS清洗细胞后重悬细胞于1× Binding Buffer中,然后加入5 μL PI和5 μL Annexin Ⅴ FITC孵育。轻轻涡旋混合后将样品在黑暗中孵育15 min,然后向每管中加入400 μL 1× Binding Buffer。最后,在孵育后的1 h的时间内对样品进行流式细胞仪检测。MKN-28细胞的早期凋亡细胞率即Annexin Ⅴ FITC+/PI-的细胞百分率,而其晚期凋亡细胞率为Annexin Ⅴ FITC+/PI+的细胞百分率,二者之和为总凋亡率。实验重复3次。
1.6 Western blotting检测蛋白表达收集生长至对数期且经暴露于终浓度为1.0、2.0 μmol·L-1SAHA处理36 h后的MKN-28细胞,然后将每个样品中加入适量的RIPA蛋白裂解液(含蛋白酶抑制剂),涡旋混匀,静置于冰上10 min,进行充分裂解,然后在13 000 r·min-14 ℃温度条件下离心20 min。取上清液,弃去沉淀。用牛血清白蛋白(BSA)作为参照的Bio-Rad公司的蛋白实验试剂盒对对照组及实验组的蛋白浓度进行定量。通过运用聚丙烯酰胺凝胶电泳对不同大小的蛋白进行分离,然后将蛋白转印至聚偏二氟乙烯膜(PVDF膜),对于膜内非特异性抗体运用体积分数为5%的脱脂牛奶进行封闭。然后加入相应的一抗使其与PVDF膜上的目的蛋白相反应,在4 ℃的条件下孵育2 h。用等渗缓冲盐溶液(TBST)对膜进行洗涤,在室温环境下加入相应二抗并孵育1 h,最后再次用TBST对孵育后的PVDF膜进行3次洗涤。在PVDF膜上滴加化学发光试剂后通过X射线曝光、显像,并记录。用β-actin作为内参,观察各组MKN-28细胞内AC-H3及AC-H4、凋亡诱导因子(apoptosis-inducing factor,AIF)蛋白的表达情况。实验重复3次。
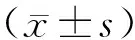
2 结果
2.1 SAHA对胃癌细胞MKN-28增殖及衰老的效应将胃癌MKN-28细胞暴露于不同药物浓度的SAHA后,观察到SAHA能够通过剂量依赖和时间依赖的方式抑制MKN-28细胞的增殖。基于这种结果,从中选取用SAHA处理72 h抑制率为(64.26±1.02)%的药物浓度1.0 μmol·L-1及(79.55±0.94)%的药物浓度2.0 μmol·L-1进行后续的实验(P<0.05)(图1)。同样观察到相对于对照组,用SAHA处理的实验组细胞衰老相关的β-半乳糖苷酶染色率较高(图2)。
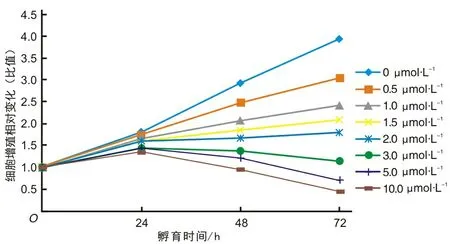
图1 SAHA对MKN-28细胞增殖的影响(P<0.05)
A为对照组;B为SAHA 1 μmol·L-1处理组;C为SAHA 2 μmol·L-1处理组。
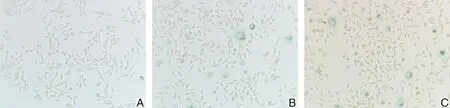
2.2 SAHA对胃癌细胞MKN-28细胞凋亡的影响凋亡实验显示SAHA能够通过剂量依赖方式诱导MKN-28细胞凋亡。用SAHA处理细胞48 h后,MKN-28细胞凋亡中细胞总凋亡率百分比由(11.69±0.17)%增至(15.37±0.51)%(SAHA 1.0 μmol·L-1)及(19.93±0.36)%(SAHA 2.0 μmol·L-1),相对于对照组差异具有统计学意义(图3、4)。
A为对照组;B为SAHA 1 μmol·L-1处理组;C为SAHA 2 μmol·L-1处理组。
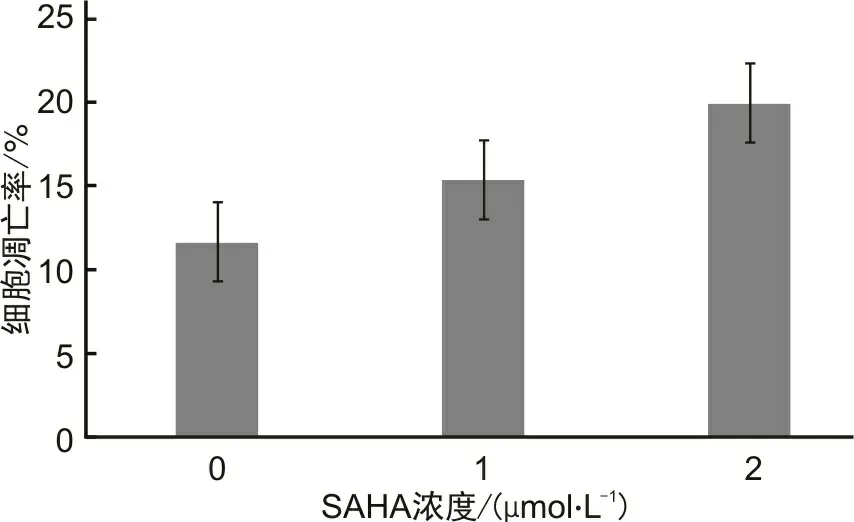
图4 SAHA对MKN-28细胞凋亡的影响柱状图(P<0.01)
2.3 SAHA对胃癌细胞MKN-28相关蛋白表达的影响作为一种组蛋白去乙酰化酶抑制剂,SAHA应该使暴露于其中的细胞的乙酰化组蛋白增加。Western blotting结果显示SAHA可以通过剂量依赖的方式使AC-H3、AC-H4的表达水平增加(图5)。Western blotting结果显示SAHA通过剂量依赖的方式使AC-H3、AC-H4、AIF蛋白表达水平上调(图6)。

GAPDH为甘油醛-3-磷酸脱氢酶;AC-H3为乙酰化组蛋白H3;AC-H4为乙酰化组蛋白H4;AIF为凋亡诱导因子。

AC-H3为乙酰化组蛋白H3;AC-H4为乙酰化组蛋白H4;AIF为凋亡诱导因子。
3 讨论
SAHA作为新型的组蛋白去乙酰化酶抑制剂之一,可以通过干扰去乙酰化酶来提高抑癌基因的表达水平,从而抑制肿瘤细胞生长并导致肿瘤细胞凋亡[4,10-11]。之前的研究显示SAHA对胃肠道肿瘤具有抗肿瘤效应[9,12]。近年来,SAHA对胃癌抗肿瘤的效应引起人们关注,但其机制尚不清晰。在本研究中,用MKN-28细胞研究SAHA对胃癌细胞生长的抑制作用。MTT实验显示SAHA通过剂量依赖方式明显抑制MKN-28细胞生长。SAHA同样提高MKN-28细胞的衰老率。
细胞凋亡实验结果提示SAHA同样可以诱导胃癌MKN-28细胞凋亡。为了进一步深入探究SAHA对胃癌细胞凋亡的影响的相关分子机制,本研究进行了Western blotting实验。和先前研究的结果相同,本实验结果也证明了SAHA明显增加乙酰化组蛋白H3和H4的水平[13-15]。通过乙酰基转移酶的作用将一个乙酰基分子嫁接在蛋白质分子链内的氨基酸上的过程即蛋白质乙酰化。组蛋白乙酰化酶的主要功能是促进基因转录,而去蛋白去乙酰化酶则是抑制基因转录。而这种主要发生在赖氨酸上的乙酰化修饰调节是维持细胞正常功能的重要途径[16]。先前的相关研究证实蛋白乙酰化及去乙酰化的异常导致其结构及功能异常,通过升高组蛋白H3及H4乙酰化水平,组蛋白去乙酰化酶抑制剂能够导致细胞内凋亡程序启动,从而诱导细胞发生凋亡[17-18]。AIF是一种线粒体蛋白,其具有氧化还原酶和诱导细胞凋亡两种活性。AIF从线粒体到细胞核的转位足以介导以非caspases依赖的体外细胞凋亡的发生[19-20]。SAHA通过剂量依赖的方式使AIF蛋白表达水平上调。综上,本实验结果显示SAHA能够通过上调AIF蛋白表达,从而诱导MKN-28细胞的凋亡。
本实验结果显示SAHA在体外抑制MKN-28细胞增殖及诱导MKN-28细胞衰老、凋亡的机制可能是通过上调相关基因表达实现的,而其中的具体分子机制有待进一步研究。
