甜叶菊体内聚果糖类化合物分布特性研究
2021-04-08
(南京农业大学园艺学院,南京 210095)
0 引言
聚果糖类化合物(Polyfructosans)指由多个果糖经β糖苷键连接而成末端常带一个α-D-葡萄糖基的线性直链多糖类化合物,广泛存在于双子叶植物的菊科(如菊芋、菊苣和大丽花)、橘梗科、龙胆科、萝摩科、金虎尾科、半边莲科、报春花科、紫草科及单子叶植物的百合科(如韭菜、洋葱、大蒜和芦笋)、禾本科等植物中,聚合度(Degree of polymerization,DP)通常为2~65,其中聚合度较低(DP=2~9)者常称为低聚果糖(Fructooligo‐saccharide,FOS),聚合度较高(DP=10~65,平均为12~15)者常称为菊糖(Inulin),又名菊淀粉、菊粉[1]。
聚果糖类化合物在食品、医药、化工和化妆品等行业已显示出广泛的应用价值。在食品领域,随着肠道微生物组学的发展,人们发现,作为一种水溶性膳食纤维,聚果糖类化合物能通过小肠直接进入结肠,选择性地促进双歧杆菌和乳酸菌定殖,促进结肠内糖发酵生成醋酸、丙酸等短链脂肪酸(SCFA),降低肠道pH值,促进对钙、铁等矿物质的吸收及多余氮素向盲肠的转移,抑制外源致病菌及肠内固有腐败菌的生长,调节肠道菌群平衡,同时聚果糖类化合物可吸收肠道水分,使大便柔软[2]。医学上,巴戟天低聚果糖对抑郁症、阿尔兹海默症显示出治疗活性[3-4]。
甜叶菊[Stevia rebaudiana(Bertoni)Hemsl.]原产于南美洲巴拉圭和巴西交界的阿曼拜山脉,最初被当地人作为可提高人体免疫力的甜茶饮用,后因其叶内富含口感接近蔗糖、可作低能量高倍甜味剂使用的四环二萜类化合物甜菊糖苷(Steviol glycosides)而被广为栽培利用,我国于1976 年引进试种,现已成为甜叶菊种植面积、甜菊糖苷提取加工产能及出口量最大的国家[5-6]。当前甜叶菊种植主要目的为提取其叶内所含甜菊糖苷类化合物,有资料表明甜叶菊根、茎、叶内存在不同聚合度的聚果糖类化合物[7-8],为促进甜叶菊物料的综合利用,本研究以RA(莱鲍迪苷A,Rebaudioside A)、STV(蛇菊苷,Steviolside)、RC(莱鲍迪苷C,Rebaudioside C)和RD(莱鲍迪苷D,Rebaudioside D)化学型甜叶菊植株为研究对象,探讨不同生育期叶片、茎秆及生育后期根部聚果糖类化合物检出最大聚合度及聚果糖类化合物含量情况,为甜叶菊聚果糖类化合物开发提供依据,推动甜叶菊物料的综合利用,促进甜叶菊产业可持续发展。
1 材料与方法
1.1 材料
以按常规方法种植于南京农业大学江浦实验站的实验室自育甜叶菊STV型品系(材料编号分别为:325、392、511)、RA 型品系(材料编号分别为:657、522、B14)、RC 型品系(材料编号分别为:618、699、B9)和RD 型品系(材料编号分别为:339、620、737)植株为材料,各材料现蕾期叶内各主要甜菊糖苷的相对百分含量及甜菊糖苷总量(收率)情况见表1。
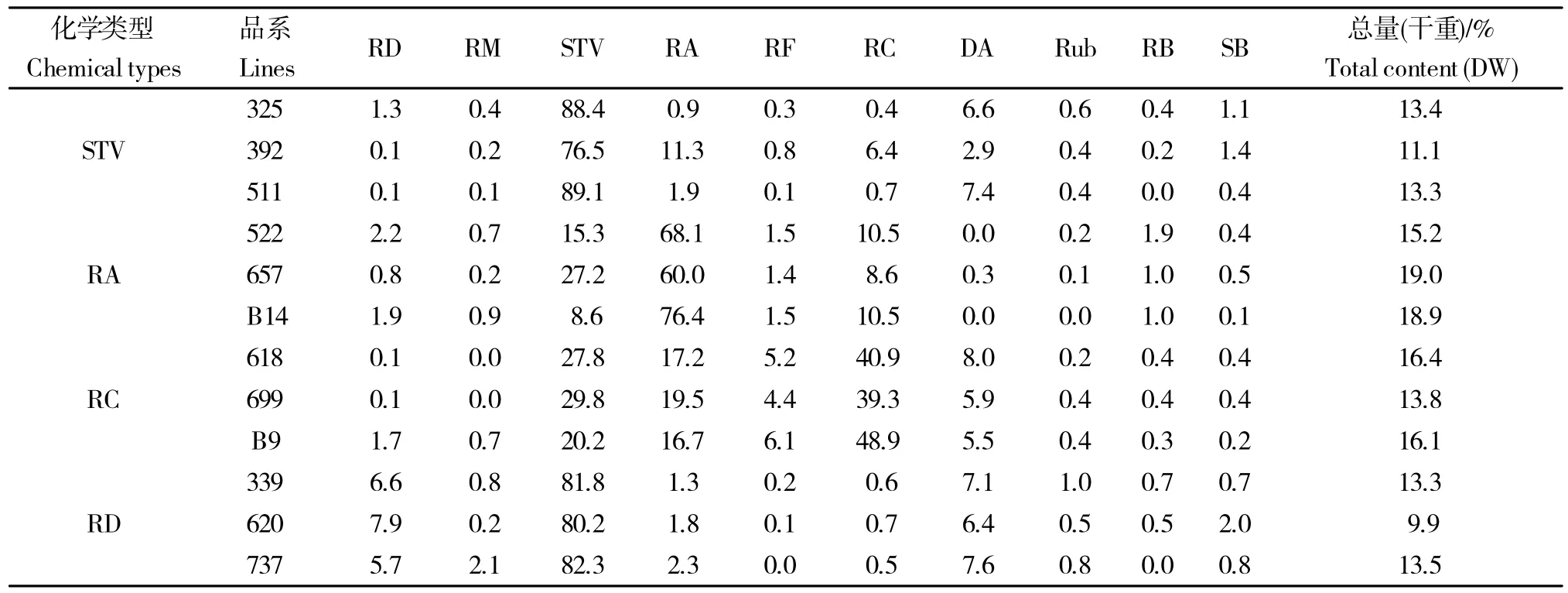
表1 参试材料现蕾期叶内10种主要甜菊糖苷的相对百分含量及甜菊糖收率情况Table 1 Relative percentage content of 10 steviol glycosides(SGs)and total content of SGs in leaves of materials used in this study
1.2 分析样品的准备
分别于十叶一心期(生育前期,以下简称“前期”)、现蕾期(生育中期,以下简称“中期”)采集植株茎、叶部,于种子成熟期(生育后期,以下简称“后期”)采集植株根、茎、叶部,趁鲜清洗,105 ℃杀青15 min,80 ℃烘干,研磨至全部通过60 目筛,混匀,取样100.0 mg,加水1.50 mL,60 ℃水浴45 min,10 000 r/min 离心10 min,上清保存于4 ℃,用孔径为0.22 μm的水系微孔滤膜过滤后上机检测[9-12]。
1.3 样品检测
参照李辉等[13]方法,以蔗糖、蔗果三糖、蔗果四糖、蔗果五糖为标准品,利用高效液相色谱-激光蒸发光散射检测法(简称“蒸发光散射法”,HPLC-ELSD)分离检测甜叶菊样品内各聚合度的聚果糖类化合物。所使用的高效液相色谱仪为Agilent1200、蒸发光检测器为Alltech ELSD 3300、高效液相柱为Prevail Carboydrate ES 5µm、流动相为乙腈/水(梯度洗脱流程见表2)、流动相流速为1.0 mL/min、柱温30 ℃。ELSD 参数为:漂移管温度80℃、氮气流速1.5 L/min;进样量为10µL。

表2 甜叶菊聚果糖类化合物HPLC-ELSD检测用乙腈/水梯度洗脱流程Table 2 Gradient elution process of acetonitrile/water for HPLC-ELSD detection of polyfructosans in stevia
1.4 各聚果糖类化合物聚合度的确定
由于植物体内聚果糖类化合物是以聚合度低者为底物依次合成聚合度高者,且聚合度低者水溶性高于聚合度高者,在蒸发光散射检测中显示出随聚合度的增加而保留时间逐渐增大,本研究在参照蔗糖、蔗果三糖、蔗果四糖、蔗果五糖等标准品保留时间基础上通过保留时间差异来确定各聚果糖类化合物的聚合度。
1.5 各聚果糖类化合物含量的确定
本研究目标为通过对甜叶菊各品系植株根、茎、叶部聚果糖类化合物聚合度及含量随生育期变化情况的分析,为甜叶菊聚果糖类化合物的开发确定适宜的提取加工部位和采收时期,由于聚果糖类化合物种类繁多,无适宜标准品可对各聚合度聚果糖类化合物进行一一定量,本研究以蔗糖为参照统一测算各聚果糖类化合物含量y(%)=0.00048665x(x为峰面积)(R2=0.9906)。
2 结果与分析
2.1 各生育期甜叶菊各部位聚果糖类化合物检出最大聚合度变化情况
最大聚合度、平均聚合度和各聚合度组分所占比例是影响肠道微生物对聚果糖类化合物利用的关键因素,在聚果糖类化合物源植物开发价值评估中具有重要作用,植株相关部位聚果糖类化合物检出最大聚合度反映了该部位聚果糖类化合物形成能力。图1 和图2结果显示,在十叶一心期和现蕾期,甜叶菊植株茎中聚果糖类化合物检出最大聚合度高于同时期叶内聚果糖类化合物的检出最大聚合度;在种子成熟期,根中聚果糖类化合物检出最大聚合度高于同时期茎秆和叶片中聚果糖类化合物检出最大聚合度。这些结果表明,聚果糖类化合物形成能力在甜叶菊植株各部位间差异明显,以根中最强,茎秆次之,叶内最弱。
聚果糖类化合物在植物各部位的形成积累和降解利用是一个相互转化过程,当形成能力大于降解时,聚果糖类化合物的检出最大聚合度表现为逐渐增大的趋势,反之则表现为下降趋势。图1和图2结果显示,由十叶一心期到现蕾期及种子成熟期,随生育期的延后,叶内聚果糖类化合物的检出最大聚合度总体呈现为降低趋势;相反地,随生育期的延后,茎秆内聚果糖类化合物的检出最大聚合度呈现为上升趋势。
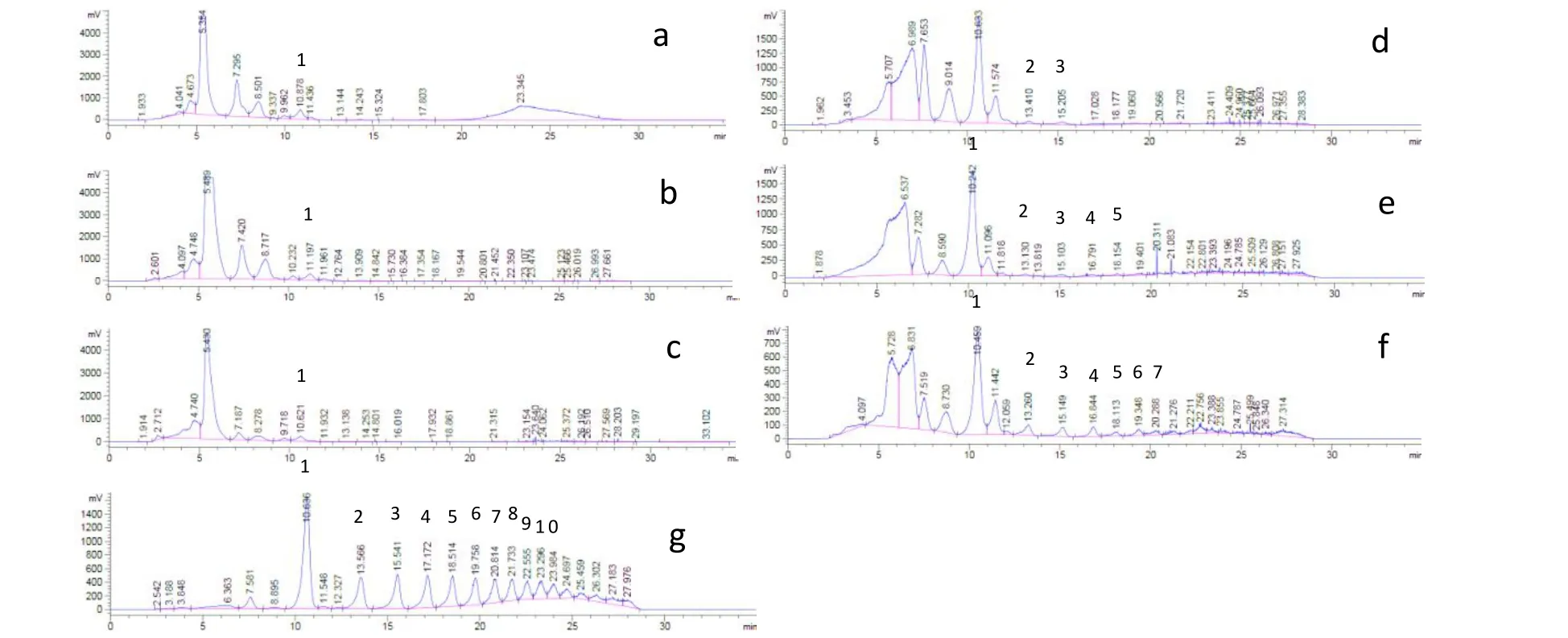
图1 各生育期甜叶菊叶片(a~c)、茎秆(d~f)和根部(g)聚果糖类化合物HPLC-ELSD检出图Fig.1 HPLC-ELSD detection of polyfructosans in leaves(a-c),stems(d-f)and roots(g)of stevia seedlings at various growth stages
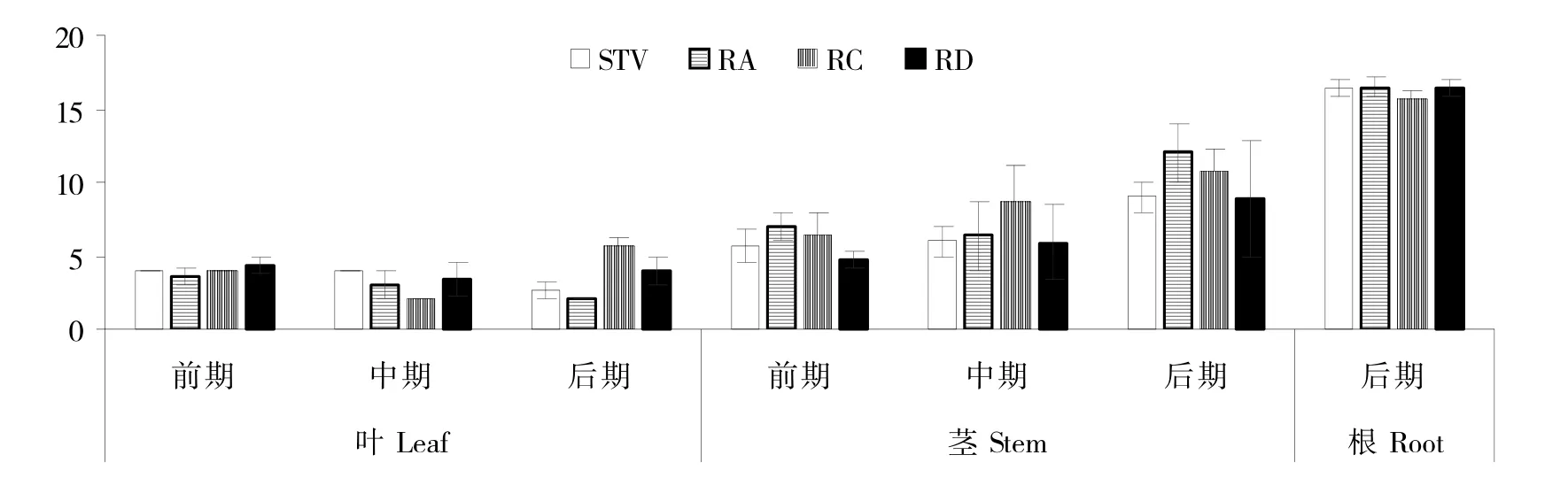
图2 各生育期各化学型甜叶菊植株各部位聚果糖类化合物检出最大聚合度情况Fig.2 Maximum degree of polymerization detected in different parts of stevia seedlings of various chemical type at different growth stages
此外,图1和图2结果显示,在十叶一心期、现蕾期和种子成熟期,RA、STV、RC 和RD 四类参试甜叶菊品系同部位的聚果糖类化合物检出最大聚合度间差异不显著,表明聚果糖类化合物的形成特性为各化学类型甜叶菊植株所共有,为与其叶内所含甜菊糖苷类化合物特性无关的性状。
2.2 各生育期叶内聚果糖类化合物含量变化情况
在各生育期,甜叶菊叶内可检测到蔗果三糖至蔗果六糖4种类型,积累的聚果糖类化合物主要为低聚合度的蔗果三糖和蔗果四糖,且各参试品系叶内聚果糖类化合物组分差异明显。图3 结果显示,RA 型品系叶内蔗果三糖含量明显高于同期其他化学类型;在种子成熟期,RC 型品系叶内蔗果五糖和蔗果六糖的含量较其他生育期增高明显,而同期其他化学类型品系叶内未检出蔗果五糖和蔗果六糖;从十叶一心期、现蕾期到种子成熟期,随生育期的延后,各参试品系叶内聚果糖类化合物各组分含量及其总量下降趋势明显。
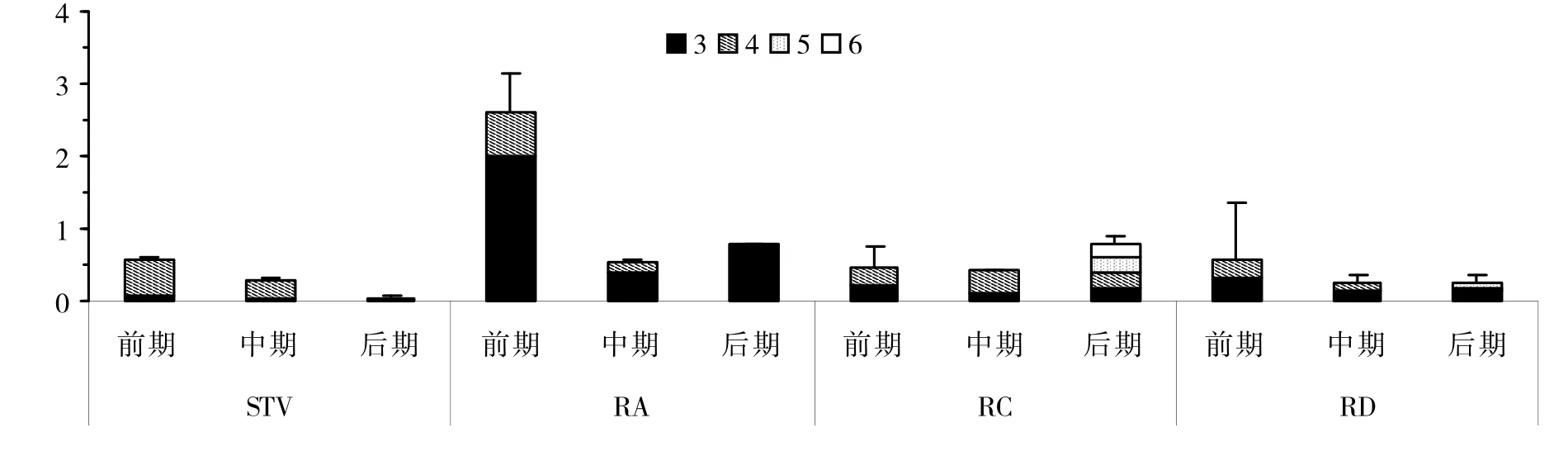
图3 各生育期各化学类型甜叶菊叶内聚果糖类化合物百分含量(%)情况Fig.3 Content(%)of polyfructosans in leaves of stevia seedlings of various chemical type at different growth stages
2.3 各生育期茎内聚果糖类化合物含量变化情况
图4结果显示,从十叶一心期、现蕾期到种子成熟期,随生育期的延后,所有参试品系茎内聚果糖类化合物各组分含量及其总量都不同程度地升高,可检测到蔗果三糖至蔗果十四糖12种类型;到现蕾期,与十叶一心期相比较,除RC 型甜叶菊的茎内聚果糖类化合物各组分及总量明显升高外,其余各参试材料的茎内聚果糖类化合物各组分及其总量保持基本不变;到种子成熟期,各参试品系茎内各聚果糖类化合物组分含量及其总量较十叶一心期和现蕾期上升明显,且各参试品系茎内聚果糖类化合物总量差异明显,以RC型品系茎内聚果糖类化合物总量最高,其次为RA和RD型品系,STV 型品系最低。

图4 各生育期各化学类型甜叶菊茎内聚果糖类化合物百分含量(%)情况Fig.4 Content(%)of polyfructosans in stems of stevia seedlings of various chemical type at different growth stages
2.4 种子成熟期根内聚果糖类化合物含量情况
图5 结果显示,在种子成熟期,各参试品系根内聚果糖类化合物总量差异明显,可检测到蔗果三糖至蔗果十七糖15种类型,以RD 型甜叶菊品系根内聚果糖类化合物总量最高(43%);其次为RC型品系,其根内聚果糖类化合物总量为28%;STV和RA型品系最低,分别为16%和12%。
3 讨论与结论
3.1 甜叶菊植株所含聚果糖类化合物积累特性的生物学意义探讨
本研究数据显示,甜叶菊植株内聚果糖类化合物的积累特性为:(1)同时期,随器官在植株所处部位的向内、向下,其所含聚果糖类化合物检出最大聚合度越大、各聚合度的聚果糖类化合物总量越高。本文所列数据显示聚果糖类化合物总量由低到高顺序为叶片、茎秆和根;同时,文内未列出数据显示,茎秆内聚果糖类化合物总量由低到高顺序为上部、中部和基部。(2)各生育期间,随生育期的延后,聚果糖类化合物表现为向内、向下集聚。随生育期的延后,叶内聚果糖类化合物检出最大聚合度下降、各聚合度聚果糖类化合物含量降低,茎内聚果糖类化合物检出最大聚合度增大、各聚合度聚果糖类化合物含量增高,在种子成熟期以根内聚果糖类化合物检出最大聚合度最大、各聚合度聚果糖类化合物含量最高。
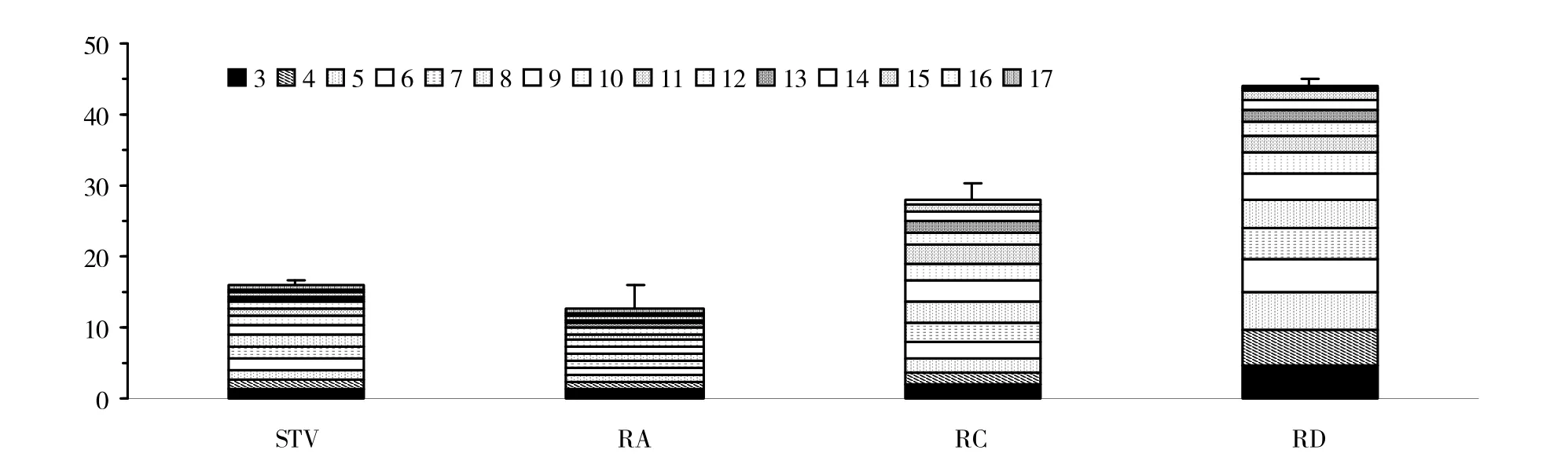
图5 种子成熟期各化学类型甜叶菊根内聚果糖类化合物百分含量(%)情况Fig.5 Content(%)of polyfructosans in roots of stevia seedlings of various chemical type at growth stages of seed maturity
聚果糖类化合物,由果糖基和葡萄糖基组成,其所含糖苷键及果糖和葡萄糖单体的水解可释放大量能量,为此,可将聚果糖类化合物理解为植物体贮存能量的一种物质形式[14]。基于聚果糖类化合物的上述集聚特性,可以推测的是,植物积累聚果糖类化合物的目的在于为植株的下一次发育贮存能量。在包括甜叶菊植株在内的植物体生长发育中,叶片和茎秆是最易受损部位,以本研究所关注的聚果糖类化合物为代表的物质(能量)的向内向下集聚,有利于植株在外部叶片或茎秆受损后萌发新的叶片或枝条。在温带冬季低温下,包括甜叶菊在内的各宿根性草本植株多通过叶片和上部茎秆的枯萎来避免低温伤害,枯萎前,以聚果糖类化合物为代表的物质(能量)由叶片向内(茎秆)向下(茎基和根)聚集,既利于保护植株下部茎秆和根部免受低温伤害,也利于第二年春季气温恢复后茎基不定芽和根部分蘖的萌发。
3.2 甜叶菊体内聚果糖类化合物形成积累能力与叶内甜菊糖苷类化合物形成特性之间关系探讨
本研究数据显示,各参试品系间聚果糖类化合物的积累特性为:(1)在各相同生育期,4类参试甜叶菊品系同部位聚果糖类化合物检出最大聚合度间差异不明显,表明聚果糖类化合物种类的形成特性为各化学类型甜叶菊植株所共有。(2)在各生育期,甜叶菊叶内积累的聚果糖类化合物主要为低聚合度的蔗果三糖和蔗果四糖,各参试品系叶内聚果糖类化合物组分差异明显。各生育期,RA 型品系叶内蔗果三糖含量明显高于同生育期其他化学类型品系;种子成熟期,RC型品系叶内蔗果五糖和蔗果六糖的含量较其他生育期增高明显。(3)从十叶一心期、现蕾期到种子成熟期,RC 型品系茎内聚果糖类化合物各组分含量及其总量明显高于其余各参试材料;在种子成熟期,各参试品系茎内各聚果糖类化合物组分含量及其总量都较现蕾期上升明显,且以RC 型甜叶菊茎内聚果糖类化合物总量最高,其次为RA 和RD 型品系,STV 型品系最低。(4)在种子成熟期,各参试品系根内聚果糖类化合物各组分含量及其总量差异明显,以RD 型甜叶菊品系根内最高,RC型品系其次,STV和RA型品系最低。
上述结果揭示,参试品系同部位对各聚果糖类化合物的形成能力相近但积累能力不同,最终表现为同时期各品系相同部位所含聚果糖类化合物的检出最大聚合度相近但各组分含量及其总量不同。结合各化学型甜叶菊品系植株性状初步推测:(1)叶片光合能力差异是影响各品系甜叶菊叶对蔗果三糖等各聚果糖类化合物积累的重要因素之一。在研究中,我们注意到,RA 型甜叶菊品系植株叶内甜菊糖苷总量往往较其他化学型叶片高,在大田种植中,RA 型甜叶菊品系植株相对其他参试品系植株的特征之一为其叶色深,光合能力强,这可能也是RA 型甜叶菊叶内蔗果三糖含量高于同生育期其他化学类型品系的原因之一,具体原因有待进一步探讨。(2)叶内形成果糖、葡萄糖能力不同可能是RC型甜叶菊品系叶片中特异地合成RC和在种子成熟期其叶内蔗果五糖和蔗果六糖的含量较其化学型甜叶菊叶片高的共同原因之一。(3)甜叶菊植株对各聚果糖类化合物合成可能以叶片为主,形成后输送并贮存到茎秆及根部,这也可能是本研究所观测到的在生育后期叶内聚果糖类化合物含量减少而茎秆和根内聚果糖类化合物含量升高的原因之一。
3.3 甜叶菊物料所含聚果糖类化合物开发策略探讨
包括低聚果糖和菊糖在内的聚果糖类化合物为一类可为肠道有益微生物所利用的化合物,可促进该类有益微生物在肠道内的定殖,增大有益微生物种群相对密度,提高肠道有益代谢物比例,改善人体心理和生理状况,已在食品、保健和医药产业中广泛应用。本研究结合前人有关甜叶菊体内存在菊糖的相关报道,针对当前主要加工利用的RA、STV、RC和RD 型甜叶菊植株,综合比较各型甜叶菊植株根、茎、叶部聚果糖类化合物含量情况,为甜叶菊物料的综合应用提供依据。
在人们将甜叶菊作为新型糖料作物开发利用前,原产地居民将甜叶菊叶当作可提高人体免疫力的甜茶饮用。本研究结果揭示,在各生育期,甜叶菊叶内以聚合度低于5 的聚果糖类化合物为主,军事医学科学院毒物药物研究所和中科院广东微生物研究所的研究结果揭示低聚果糖(DP=4~7)具有抑郁症和阿尔兹海默症治疗活性[3-4],同时,有研究结果显示低聚果糖具有调节机体免疫力的作用[2]。表明,甜叶菊原产地居民将甜叶菊叶作为提高人体免疫力的甜茶饮用是有一定依据的,提示我们可以甜叶菊叶为原料开发提高人体免疫力、对抑郁症和阿尔兹海默症具有调理作用的专用品。由于甜叶菊叶是甜菊糖苷提取的基本原料,来源丰富,且甜叶菊叶内基本不含其他高聚合度的聚果糖类化合物,若将聚果糖类化合物分离工艺嫁接到甜菊糖苷提取工艺中,可有效降低开发成本。
甜叶菊叶除作为甜菊糖苷提取原料利用外,甜菊茶也是甜叶菊叶片的重要应用方向之一,以甜菊茶等方式直接利用的叶片总量占整个甜叶菊叶年产量的10%~15%。甜菊茶生产方式包括:(1)甜菊茶用叶专收农户通过利用甜叶菊老蔸或提前移植,在甜叶菊十叶一心期前后割伐植株中上部,让植株地上部抽生新的分枝,于现蕾前再次收获叶片作甜菊茶售卖使用;(2)甜菊茶和甜菊糖苷提取用叶兼收农户通过提前种植,将甜叶菊十叶一心期前后割伐植株中上部所获叶片作甜菊茶售卖使用;(3)甜叶菊种子生产农户为促进甜叶菊植株地上部分枝,将甜叶菊十叶一心期前后割伐植株中上部所获叶片作甜菊茶售卖使用;(4)甜菊糖苷提取用甜叶菊叶大田生产农户在十叶一心期前后打顶茎尖作甜菊茶售卖使用。本研究数据表明,在十叶一心期甜叶菊叶内聚果糖类化合物各组分含量最高,结合前述有关低聚果糖类化合物对抑郁症、阿尔兹海默症患者和免疫力等方面的有益作用,揭示利用十叶一心期前后所获叶片作为甜菊茶,更有利于发挥甜叶菊叶对相关疾患和免疫力的调节作用,即,宜选用早期叶作茶用甜叶菊叶。
本研究结果还揭示,现蕾期参试各化学类型甜叶菊茎秆所含聚果糖类化合物为最大聚合度低于10的寡聚糖,因寡聚糖具有提高免疫力的作用,为此,当前以现蕾期甜菊糖苷提取用叶收获后所留茎秆作饲料用的利用方案具有可行性,后期,可将甜叶菊茎秆作为可提高免疫力、具有保健价值的物料进行开发利用。
普通人体肠道微生物对聚合度大于10的聚果糖类化合物(又称“菊糖”)生物利用度低,但双歧杆菌等有益菌类可对其进行利用,为此,当前多将菊糖用于改善肠道微生物的菌群结构[1-2]。本研究结果揭示,甜叶菊根中所含聚果糖类化合物的最大聚合度为16及以上,明显高于茎秆和叶内所含聚果糖类化合物的最大聚合度,并与巴戟天、菊芋等植物根茎所含聚果糖类化合物的最大聚合度相近[13,15],据此,可将甜叶菊根作为用于改善肠道微生物菌群结构的物料进行开发利用。甜叶菊根干重约占甜叶菊植株总重1/3(未发表数据),若不开发利用,既是对甜叶菊物料的浪费也是造成甜叶菊种植地块连作障碍的重要原因。若能对甜叶菊根进行开发利用,以甜叶菊植株平均总干物质积累量18~22.5 t/hm2、我国年均种植面积1.6 万hm2~2 万hm2计算,甜叶菊根的可利用干物质量可达10 万t~15 万t。以本研究图5 所示根中聚果糖类化合物最低含量12%计算,我国每年甜叶菊根中可利用的聚果糖类化合物最小量为1.2万t~1.8万t。
需说明的是,本研究所列结论是对同类型多品系甜叶菊相关部位总体性状的综合描述,在实际测定中,我们注意到,在同一生育期,同类型甜叶菊品系相同部位所含聚果糖各组分含量及总量波动幅度大,在甜叶菊源聚果糖类化合物开发中,有必要在参考本研究结论基础上,对具体材料内聚果糖类化合物的含有情况进行具体分析。此外,我们的研究数据显示,同一品系不同部位所含聚果糖类化合物的种类、各聚果糖组分含量及其总量差异明显,该结果对甜叶菊源聚果糖类化合物开发指导意义明显。
致谢:本研究内容由罗庆云、袁鎏柳和杨凯祺等共同设计,实验数据的采集由袁鎏柳和杨凯祺负责,定稿的撰写由罗庆云负责。聚果糖类化合物HPLC-ELSD 检测方法的建立及检测得到了我校资源与环境科学学院隆小华实验室陈咏文、焦娇等及该院测试中心赵海燕、顾祖丽等的指导和帮助,在此一并致谢!
