甘蔗双向糖转运蛋白ShSWEET2a基因的克隆与表达分析
2021-04-08
(福建农林大学国家甘蔗工程技术研究中心,福州 350002)
0 引言
在植物细胞中,大气中的CO2通过光合作用转化为植物可利用的糖源。糖不仅是植物中许多生物活动的能量来源,也是重要的信号转导分子。在植物中,糖是由叶片等营养器官通过胞间连丝或质外体途径转运至异养细胞或组织中(如种子)[1]。研究发现,有3 个基因家族编码的蛋白在糖的细胞间运输中起着关键作用:单糖转运蛋白(Mono saccharide transporters,MSTs),蔗糖转运体/蔗糖载体(Sucrose transporters/Sucrose carriers,SUT)[2-5]和双向糖转运蛋白(Sugars will eventually be exported transporters,SWEET)[6-8]。糖转运蛋白的前两个基因家族,MSTs 和SUT 在过去几十年已经得到了广泛的研究[4,9-10]。而SWEET基因家族最近才被鉴定认为是糖转运蛋白,通过对SWEET基因家族特征研究发现,它包含MtN3/saliva结构域和7 个跨膜结构域,参与了胞间和胞内己糖和蔗糖的运输[7]。在植物体的生长发育、糖分代谢、植物与动物互作[11]等生物学过程中发挥重要作用。植物不能通过顺浓度梯度直接吸收糖分,必须借助转运蛋白来完成糖分的转运及生物代谢。研究表明SWEET 糖分转运蛋白可以双向转运糖类,促进糖类顺浓度梯度扩散以及调控植物体内糖类化合物的运输等[12-14],因此研究SWEET基因对糖类化合物的转运调控与表达机理对提高甘蔗蔗杆糖含量等具有重要的理论意义[15]。
SWEET 蛋白广泛存在于多种植物中,不仅在拟南芥、木薯、桉树等双子叶植物种存在,也在水稻、小麦、高粱等单子叶植物中存在[16]。研究证实了SWEET基因参与多种植物的生理生化过程和抗逆反应[17]。如在水稻中Xa13/Os8N3/OsSWEET11小花和雄蕊中的表达量远高于其他组织,表明Xa13/Os8N3/OsSWEET11三个基因在水稻受精结实过程中发挥重要作用[18];水稻OsSWEET4 和玉米的直系同源基因ZmSWEET4C都能够编码己糖转运体,这两个基因的突变体导致种子不能正常灌浆,说明谷类籽粒胚乳基本传递层(BETL)缺乏己糖转运,不能维持淀粉贮藏胚乳的发育[19]。在拟南芥中,AtSWEET11 和AtSWEET12 定位于韧皮部薄壁细胞的质膜上,SWEET11/12双突变体植株叶片蔗糖输出能力显著降低[8,19]。SWEET基因还参与植物的非生物胁迫过程,水稻黄单胞菌(Xanthomonas oryzaepv.oryzaeXoo)可以通过攻击OsSWEET11/Os8N3/Xa13和OsSWEET14/Xa25基因,以获取营养支持自身生长,从而导致水稻白叶枯病[20];ShSWEET1和ShSWEET2基因在甘蔗抗寒胁迫中发挥重要作用[21]。因此,现代研究认为SWEET基因家族蛋白参与植物的不同的生物学和生理过程中,包括韧皮部负荷、叶片衰老、果糖保存、花粉营养、花蜜分泌和种子填充、病原菌敏感性等。
甘蔗(Saccharumspp.hybrids)是我国最主要的糖料作物,广泛分布于我国广西、广东、云南等南方热带地区。目前,我国食糖总产仅次于巴西和印度,其中蔗糖是我国食糖主要来源,占食糖总量的92%以上[22]。此外,甘蔗还是重要的工业作物,可用于生产乙醇等生物能源[23]。由于SWEET基因负责糖类物质的转运,可以将甘蔗叶片中经过光合作用转化的蔗糖转移到韧皮部薄壁细胞进行装载,最终转入茎秆中的薄壁细胞进行存储积累。此外,SWEET基因可能还参与甘蔗的器官生长发育以及响应病原细菌的互作过程[15]。因此研究甘蔗SWEET基因对于了解糖料物质在甘蔗中的转运作用和糖分积累有着重要的理论价值。本研究中,我们通过前期转录组测序发现一个甘蔗的SWEET基因,通过同源序列比对将其命名为ShSWEET2a。进一步对该基因进行了生物信息学分析、组织表达和不同逆境胁迫下的表达模式研究,旨在为深入研究该基因在甘蔗生长发育中的作用,为甘蔗品种改良、抗逆育种等领域奠定理论基础。
1 材料与方法
1.1 植物材料
本研究所用甘蔗品种‘新台糖22号’由国家甘蔗工程技术研究中心提供。挑选健壮的蔗茎单芽,用含有1.0 g/L 多菌灵的热水(52 ℃)浸泡2 h,置于光照培养箱(宁波江南仪器厂)催芽,培养条件为:温度30 ℃、光照16 h、相对湿度65%。
1.2 实验方法
1.2.1 植物样品处理
不同部位组织取样:选生理成熟期‘新台糖22 号’品种植株6 株,取蔗茎表皮、蔗茎茎髓、蔗芽,最高可见肥厚带叶(+1)叶片和地下部分蔗根供组织特异性分析。
非生物胁迫和外源物质处理:(1)将两个长势相近的蔗苗移至清水中培养,待有新根长出来(5~7 d),用Hongland 营养液培养2 周。(2)选取长势一致的植株幼苗分为3 组,第一组置于25%PEG6000 的Hongland 营养液中培养,并于0、3、6、12 h 取样;第二组置于250 mmol/L NaCl的Hongland 营养液中培养,在0、6、12、24 h取样;第三组用0.1 mmol/L ABA 对叶面进行喷施处理,于0、6、12、24 h 取样;第四组用0.1 mmol/L SA(含0.01%吐温-20,v/v)对叶面进行喷施处理,于0、6、12、24 h 取样。每个处理每个时间点选取植株叶片、根部和假茎。以上样品均设置3个生物学重复,每个重复取5株混合。样品用液氮速冻后,存于-80 ℃冰箱备用。
1.2.2 RNA提取
Trizol(Invitrogen,CA,USA)法提取上述实验材料中的各处理甘蔗总RNA,1%琼脂糖凝胶检测已获得的RNA 质量与浓度,若合格,放入-80 ℃冰箱保存。
1.2.3 目标基因片段克隆
参照PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TaKaRa,大连)操作步骤,以甘蔗叶片总RNA 为模板,合成cDNA,用于克隆。根据本实验室测序的转录组数据库得到甘蔗ShSWEET的unigene 序列,利用Primer5.0 软件进行基因特异性克隆引物的设计(表1),PCR 反应程序为:94 ℃,3 min;94 ℃,30 s,50 ℃(根据上下游引物计算),30 s,72 ℃,2 min,35 个循环数;72 ℃,10 min;4 ℃,∞。将扩增产物利用琼脂糖胶回收试剂盒(北京天根生物科技有限公司)进行回收纯化,然后连接至pMD19-T(TaKaRa,大连)载体,再转化到大肠杆菌感受态DH5α(TaKaRa,大连)中,涂至含有氨苄抗性的LB固体营养培养基上,挑取单菌落菌液PCR检测,将获得阳性克隆子的菌液送往福州博尚测序公司测序。

表1 本研究所用引物Table 1 Sequence of primers used in this study
1.2.4 目标基因的表达分析
根据所克隆的基因序列设计特异性定量PCR 引物,以磷酸甘油醛脱氢酶(GAPDH)为内参基因。使用在线网址(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)进行定量引物设计,详细引物序列见表1。以GAPDH基因作为内参,以1.2.1 中得到的RNA 为模板进行逆转录,以逆转录后的cDNA 为模板进行qRTPCR 分析。PCR反应体系为20µL,包括HieffTMqPCR SYBR Green Master Mix 10µL(Yeasen,上海)、上下游引物(10 µmol/L)各0.4 µL、cDNA 模板1 µL、其余用DEPC-H2O 补足。PCR 扩增反应程序为:95 ℃,5 min;95 ℃10 s;60 ℃,30 s,进行40 个循环后增加溶解曲线环节。每次反应做3 次生物重复,3 次技术重复,并采用2-△△Ct法计算基因相对表达量,同时计算其标准差。
1.2.5 目标基因生物信息学分析
通过在线网站https://web.expasy.org/protparam 进行氨基酸序列分析;利用NCBI 的Blast 数据库寻找相似氨基酸序列;利用MEGA6.0 软件中的邻近法(Neighbor-Joining)(1000bootstrap)构建系统进化树及应用DNAMAN8.0 软件分析蛋白相似性。分别利用在线网站TMHMM Server v 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0)、https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html预测目的蛋白的跨膜结构域以及二级结构。
2 结果与分析
2.1 甘蔗ShSWEET2a的基因克隆与基本性质分析
经过克隆测序最终我们得到包含一个840 bp 的开放读码框,编码279 个氨基酸(图1)的ShSWEET2a基因序列。ShSWEET2a基因编码的氨基酸序列含有2 个MtN3_slv 保守结构域,等电点和分子量分别为8.83和31 031.16 Da,不稳定指数(Instability Index)为34.71,脂溶指数(Aliphatic index)为125.05,亲水性(GRAVY)为1.031,具有7 个跨膜区。带负电荷残基(Asp+Glu)的总数为11,带正电残基(Arg+Lys)总数为16,由于基因的不稳定系数小于40,所以ShSWEET2a基因编码的蛋白质相对稳定。

图1 ShSWEET2a基因序列分析Fig.1 Sequence analysis of ShSWEET2a gene
2.2 ShSWEET2a蛋白编码的氨基酸序列分析
利用NCBI 的BLAST 数据库对序列进行同源性分析,结果表明该蛋白与SWEET 蛋白家族的同源性最高。为了进一步研究该基因与其他基因的同源关系,利用DNAMAN 做同源性矩阵分析(表2)。结果发现,其与来源于玉米(Zea mays)、粟(Setaria italica)、高粱(Sorghum bicolor)、稷(Panicum miliaceum)、黍(Panicum hallii)、水稻(Oryza sativa)、二型花(Dichanthelium oligosanthes)的SWEET 蛋白相似性较高,其中与Sb-SWEET2a蛋白序列相似性达到了0.967,具有最高的相似性;与PmSWEET2a蛋白相似性最低,仅0.692。

表2 不同植物的SWEET2a 氨基酸序列同源性比较Table 2 Comparison of SWEET2a amino acid sequences from different plants
利用NCBI的BLASTP数据库进行序列同源性查询,得到同源性大于60%的氨基酸序列,并以此构建系统进化树,采用邻近法(Neighbor-Joining)BOOTSTRAP 值为1 000,泊松模型,其余均为默认设置(图2)。结果发现:ShSWEeT2a 与SbSWEETt2a 和ZmSWEET2a 亲缘关系最近。表明甘蔗中的ShSWEET2a 属于SWEET 蛋白家族的Clade I分支[17]。
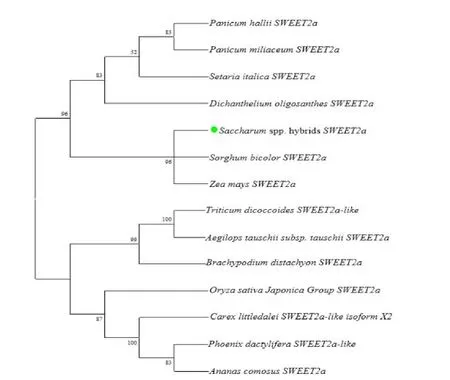
图2 甘蔗糖转运蛋白ShSWEET2a系统进化树分析Fig.2 Phylogenetic tree analysis of sugar transporter ShSWEET2a in sugarcane
2.3 氨基酸序列跨膜分析及二级结构预测分析
利用TMHMM Server v 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对ShSWEET2a 进行蛋白结构预测(图3),结果表明,ShSWEET2a 具有7 个保守的跨膜结构域,分别位于15~37、58~80、85~107、116~138、148~170、177~199和219~241。

图3 ShSWEET2a跨膜结构域预测Fig.3 The ShSWEET2a transmembrane domain prediction
蛋白二级结构预测结果表明在ShSWEET2a氨基酸序列中有α-螺旋占37.28%、延伸链占25.45%、无规则卷曲占37.28%,α-螺旋和无规则卷曲是其基因结构中的主要组成结构元件(图4)。

图4 ShSWEET2a二级结构预测Fig.4 Secondary structure prediction of ShSWEET2a
2.4 ShSWEET2a基因的组织特异性表达
利用qRT-PCR 对ShSWEET2a基因在甘蔗‘新台糖22 号’品种不同组织器官中的表达模式进行分析,结果表明(图5),该基因在根、茎、叶中均有表达,其中叶中的表达量最高,茎中表达量仅次于叶,根中表达量最低。推测该基因在茎、叶中特异性表达。

图5 ShSWEET2a基因在根、茎、叶中的相对表达量Fig.5 Relative expression of ShSWEET2a gene in roots,stalks and leaves
2.5 逆境胁迫下ShSWEET2a基因的表达
为进一步了解ShSWEET2a基因在逆境胁迫下的表达情况,采用qRT-PCR技术,分析在PEG、NaCl、脱落酸(ABA)、水杨酸(SA)处理下,甘蔗幼苗中该基因的表达情况(图6)。结果表明,该基因对PEG 胁迫敏感,基因表达量持续上升,在6h 时表达量最高,约为处理前的3 倍,随后表达量下降,但仍高于处理前水平(图6A);在NaCl胁迫处理下,表达量先下降后上升,在24 h时达到最高,约为处理前的1.8 倍(图6B);在ABA胁迫处理下6 h后,该基因表达量急剧上升至处理前的4.4倍,达到最高值,随后表达量下降(图6C);在SA胁迫处理下,该基因表达量呈现下调趋势,胁迫处理6h后,表达量最低(图6D)。
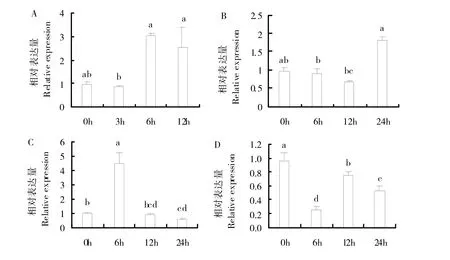
图6 胁迫处理PEG(A)、NaCl(B)、ABA(C)、SA(D)甘蔗幼苗中ShSWEET2a基因的相对表达量Fig.6 Relative expression levels of ShSWEET2a in sugarcane seedlings under PEG(A),NaCl(B),ABA(C)and SA(D)stress
3 讨论与结论
SWEET 糖转运蛋白在高等植物中广泛存在,并且在水稻、玉米、拟南芥、木薯等植物中具有较为详细的研究。甘蔗作为中国最重要的糖料作物,其SWEET基因的研究较少。本研究通过本实验室的转录组测序结果,对克隆出的SWEET基因进行生物信息学分析,该基因包含一个840 bp 的开放读码框,编码279 个氨基酸。其编码的蛋白含有SWEET蛋白的MtN3_slv 保守结构域,蛋白预测结果表明其存在7 个跨膜结构域,符合SWEET蛋白典型结构特征。同源性矩阵分析得出,ShSWEET2a与SbSWEET2a、OsSweet2a、ZmSweet2a等具有较高相似性,其中与SbSWEET2a相似性最高。同时在进化树结果分析也显示,我们克隆的这个基因编码的蛋白也与高粱的SbSWEET2a聚集在一支,这些结果表明我们克隆的基因ShSWEET2a是现代栽培种甘蔗的双向糖转运蛋白基因。
许多研究表明,植物SWEET基因的表达具有组织特异性,并且与其所参与的植物生理代谢调控关系密切。如在拟南芥中,AtSWEET17在根中表达量最高,进一步的研究证实该基因参与果糖的双向运输从而维持根部胞质果糖的稳态;AtSWEET8和AtSWEET13则在花药中特异性表达,参与花粉壁的外壁沉积和形成[24-25];而AtSWEET15主要在拟南芥的衰老组织中表达与植物衰老有一定关系[26-27]。在最新的研究表明玉米籽粒灌浆期间ZmSWEET1b基因在叶片中高表达,是碳水化合物积累的正调节因子,ZmSWEET1b的突变会导致叶片碳饥饿、气孔关闭等[28]。本研究表明ShSWEET2a在甘蔗叶和茎部的表达量显著高于根部,意味着该基因可能参与经过叶片光合作用转化蔗糖的转移,以及糖分在维管束中的运输存储。而目前SWEET介导的糖转运过程在甘蔗中的具体作用机制尚不清楚,该基因编码的蛋白如何起作用,这些科学问题需要进一步的深入研究。
植物在逆境条件下,往往会通过提高体内糖含量,来降低体内渗透压,以安全度过逆境,而SWEET蛋白作为重要的糖转运蛋白,在众多植物中发现这类基因对许多非生物胁迫均有响应[29]。在拟南芥中发现,在干旱环境下通过提高AtSWEET11、AtSWEET12和AtSWEET15的表达以提高蔗糖转运的效率,促进碳水化合物向根部的运输,从而起到保护根系的目的[30]。本研究中我们发现,在PEG 胁迫下,ShSWEET2a基因同样也出现了高表达,因此推测该基因参与了甘蔗抗旱的过程。类似的结果也在木薯的研究中发现,在干旱胁迫条件下大部分木薯MeSWEET基因的表达均发生了变化,其中表达量上调的基因中有近一半在进化关系上较近[31]。在拟南芥中,AtSWEET15基因可以通过调节脱落酸途径的信号通路从而提高植株对渗透胁迫的能力[24]。同样我们的研究中发现,ABA 胁迫下,ShSWEET2a基因在24 h出现了明显上调,这可能与其上游启动子中相应ABA的顺式作用元件相关。因此,未来需要通过进一步克隆上游启动子序列来研究可能存在的顺式作用元件,从而为研究该基因在甘蔗抗逆过程中的作用奠定基础。而在SA胁迫下,我们发现ShSWEET2a基因的表达量呈现下调趋势,由于SA 能够对多种植物病毒、真菌以及细菌病害产生抗性,同时SA 是植物产生HR和SAR必不可少的条件[32]。因此推测当甘蔗受到病原侵染时,受侵细胞直接坏死,ShSWEET2a基因表达量降低,减少糖分转运量,以减少病原生存所需营养物质。SWEET基因不仅参与着对非生物胁迫的响应,还参与着生物胁迫的响应,StSWEET11基因在晚疫病病菌的诱导下,出现高表达现象[33]。因此,我们推测ShSWEET2a基因可能在甘蔗发病过程中起着某种作用。
SWEET基因除了参与植物体的生长发育、糖分代谢、植物与微生物互作[11,15]等生物学过程以外,可能还具有其他功能。如小麦TaSWEET6在小孢子时期雄蕊中高表达,TaSWEET6基因参与了雄蕊发育的过程[17]。SWEET基因可能还具有调节动植物体内营养元素的功能,如苜蓿MtN3/saliva/SWEET基因在硼/钙离子平衡中可能发挥作用[34];SWEET基因也可能影响植物产量,YANG 等[35]发现SWEET还与棉花产量性状有关。因此,SWEET基因的作用还存在着极大的空间等着被挖掘,SWEET 蛋白具体的转运机制,是否参与糖信号转导过程及如何提高该蛋白的转运效率等问题仍有待我们去深入研究[36]。本研究只是初步的对甘蔗ShSWEET2a基因进行基因克隆与表达分析,为进一步研究甘蔗SWEET基因提供理论依据。
