黄连花薹HPLC指纹图谱的建立及其抗氧化和抑菌作用谱效关系研究
2021-04-07杨慧张佳刘博文刘钱李松洋吴磊徐玉玲刘涛
杨慧 张佳 刘博文 刘钱 李松洋 吴磊 徐玉玲 刘涛

摘 要 目的:建立黃连花薹的高效液相色谱(HPLC)指纹图谱,并研究其与抗氧化和抑菌作用的谱效关系。方法:以14批不同产地的黄连花薹为对象,采用HPLC法测定。色谱柱为Supersil C18,流动相为乙腈-0.1%磷酸溶液(梯度洗脱),流速为1.0 mL/min,柱温为25 ℃,检测波长为329 nm,进样量为10 μL。采用《中药指纹图谱相似度评价系统》(2012A版)建立14批黄连花薹的指纹图谱并进行相似度评价和共有峰指认。以DPPH自由基清除率和羟自由基清除率为抗氧化作用指标,以相对抑菌活性(大肠埃希菌)为抑菌作用指标,利用SPSS 21.0软件对黄连花薹共有峰与上述两种药效指标进行Pearson相关性分析,建立谱效关系模型,并进行验证。结果:黄连花薹的HPLC指纹图谱中共得到7个共有峰,相似度均不低于0.916,并指认5号峰为盐酸小檗碱。7个共有峰均与DPPH自由基清除率呈正相关;1~3、4、6、7号峰与羟自由基清除率呈正相关,5号峰与羟自由基清除率呈负相关;5号峰与相对抑菌活性呈正相关。经验证,黄连花薹样品的DPPH自由基清除率、羟自由基清除率、相对抑菌活性的预测值与测量值的相对误差为0.92%~14.5%。结论:所建立的谱效关系模型可用于黄连花薹抗氧化、抑菌作用的评价;1、2、3、4、6、7号峰所代表化学成分是黄连花薹抗氧化作用的物质基础,盐酸小檗碱是其抑菌作用的物质基础。
关键词 黄连花薹;高效液相色谱;指纹图谱;抗氧化作用;抑菌作用;物质基础
中图分类号 R284.1;R285.5 文献标志码 A 文章编号 1001-0408(2021)05-0559-06
ABSTRACT OBJECTIVE:To establish HPLC fingerprint of Coptis chinensis inflorescence, and study its spectrum-effect relationship with antioxidant and antibacterial effects. METHODS:Taking 14 batches of C. chinensis inflorescence from different producing areas as the object, HPLC method was adopted. The determination was performed on Supersil C18 column with mobile phase consisted of acetonitrile-0.1% phosphoric acid solution (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 25 ℃. The detection wavelength was set at 329 nm, and sample size was 10 μL. The fingerprints of 14 batches of C. chinensis inflorescence were established by Similarity Evaluation System of TCM Fingerprint (2012 A edition), and the similarity evaluation and common peak identification were carried out. Taking DPPH free radical scavenging rate and hydroxyl radical scavenging rate as antioxidant effects index, relative antibacterial activity (Escherichia coli) as antibacterial effect index, SPSS 21.0 software was adopted to analyze the Pearson correlation between common peaks of C. chinensis inflorescence and above efficacy indexes; their spectrum-effect relationship was established and validated. RESULTS:A total of 7 common peaks were obtained in HPLC fingerprint of C. chinensis inflorescence, and the similarity was no less than 0.916. No. 5 peak was identified as berberine hydrochloride. Seven common peaks were positively correlated with DPPH free radical scavenging rate; No. 1-3, 4, 6, 7 peaks were positively correlated with hydroxyl radical scavenging rate, while No. 5 peak was negatively correlated with hydroxyl radical scavenging rate. There was a positive correlation between No. 5 peak and antibacterial activity in vitro. After validation, relative error between the predicted values and the measured values of DPPH free radical scavenging rate, hydroxyl radical scavenging rate and relative antibacterial activity was 0.92%- 14.5%. CONLUSIONS:The established spectrum-effect relationship model can be used to evaluate antioxidant and antibacterial effects of C. chinensis inflorescence. The chemical components represented by No. 1, 2, 3, 4, 6, 7 peaks are the material basis of antioxidant effect of C. chinensis inflorescence, and berberine hydrochloride is the material basis of antibacterial effect.
KEYWORDS Coptis chinensis inflorescence; HPLC; Fingerprint; Antioxidant activity; Antibacterial activity; Material basis
黄连花薹系毛茛科植物黄连Coptis chinensis Franch.、三角叶黄连Coptis deltoidea C. Y. Cheng et Hsiao或云连Coptis teeta Wall.所开的花。经现代药理研究发现,黄连花薹的化学活性物质在体内外具有清热解毒、抗炎、抗病毒、保护胃肠道、抗肿瘤、降血糖、降血脂、降血壓等药理作用[1]。屠大伟等[2]测定黄连花薹的抗氧化能力时发现,黄连花薹水浸出物具有清除羟自由基、超氧自由基和过氧化氢的能力。相关研究显示,黄连花薹中盐酸小檗碱和黄酮类成分含量较高,其中盐酸小檗碱具有明显的抑菌作用[3-4]。但黄连花薹具体是哪种成分发挥抗氧化、抑菌作用目前尚不明确,基于此,本课题组采用高效液相色谱法(HPLC)建立黄连花薹的指纹图谱,对其指纹图谱中的共有峰与其抗氧化作用和抑菌作用进行相关性分析,建立谱效关系,以期为其药效物质基础的明确和质量评价提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:Waters 2695型HPLC仪(美国Waters公司)、SQP型万分之一电子分析天平(赛多利斯科学仪器北京有限公司)、PS-40型超声波清洗器(深圳市深华泰超声洗净设备有限公司)、TU-1810 型紫外可见分光光度计(北京普析通用仪器有限责任公司)、JJ-CJ-2FD型洁净工作台(苏州市金净净化设备科技有限公司)、DH3006A型电热恒温培养箱(西安禾普生物科技有限公司)、XFS-280型手提式压力蒸汽灭菌器(浙江新丰医疗器械有限公司)。
1.2 主要药品与试剂
本研究所用黄连花薹采自不同的黄连种植基地(样品信息见表1),经成都大学药学与生物工程学院刘涛教授鉴定为毛茛科植物黄连C. chinensis Franch.所开的花;其它药品与试剂有:盐酸小檗碱对照品(四川省维克奇生物科技有限公司,批号wkq18020208,纯度≥98%),DPPH(上海麦克林生化科技有限公司,批号201424),阿莫西林胶囊(国药集团汕头金石制药有限公司,批号170616,规格0.25 g),无水乙醇、水杨酸、七水硫酸亚铁、30% H2O2(成都市科隆化学品有限公司,批号分别为2018071701、2017021001、2019040201、2019032101),牛肉浸膏(北京双旋微生物培养基制品厂,批号20160303),蛋白胨、营养肉汤(北京奥博星生物技术有限责任公司,批号分别为20181022、20170108),甲醇、乙腈(色谱纯),纯净水。
1.3 菌种
本研究所用大肠埃希菌由成都大学附属医院提供。
2 方法与结果
2.1 色谱条件
色谱柱为Supersil C18(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.1%磷酸溶液(每1 000 mL中含有20 μL三乙胺,B),梯度洗脱(0~18 min,18%A→21%A;18~40 min,21%A→27%A;40~58 min,27%A→60%A;58~65 min,60%A→18%A;65~70 min,18%A);流速为1.0 mL/min;柱温为25 ℃;检测波长为329 nm;进样量为10 μL。
2.2 溶液的制备
2.2.1 供试品溶液的制备 精密称取黄连花薹粉末(过二号筛,下同)0.2 g置于锥形瓶内,精密加入甲醇24.6 mL、盐酸0.4 mL,摇匀,称定质量,静置12 h后,超声(频率40 kHz ,功率240 W,下同)30 min后冷却至室温,以甲醇补足减失的质量,过滤,取续滤液适量,经0.45 ?m微孔滤膜滤过,即得供试品溶液。
2.2.2 对照品溶液的制备 取盐酸小檗碱对照品适量,精密称定,置于25 mL量瓶中,加入甲醇溶解并定容,摇匀,即得质量浓度为1.037 mg/mL的对照品溶液。
2.3 方法学考察
2.3.1 精密度试验 取黄连花薹粉末(编号S1)适量,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件连续进样6次。以5号峰(盐酸小檗碱,因其峰分离度良好、峰面积大且稳定,故以其峰面积为参照)的峰面积和保留时间为参照,记录各共有峰的相对峰面积和相对保留时间。结果,7个共有峰的相对峰面积的RSD均小于4.0%,相对保留时间的RSD均小于1.0%,表明仪器精密度良好。
2.3.2 重复性试验 取黄连花薹粉末(编号S1)适量,共6份,按“2.2.1”项下方法平行制备供试品溶液,再按“2.1”项下色谱条件进样测定。以5号峰的峰面积和保留时间为参照,记录各共有峰的相对峰面积和相对保留时间。结果,7个共有峰的相对峰面积的RSD均小于5.0%,相对保留时间的RSD均小于2.5%,表明本方法的重复性良好。
2.3.3 稳定性试验 取黄连花薹粉末(编号S1)适量,按“2.2.1”项下方法制备供试品溶液,分别于室温下放置0、2、4、8、10、24 h后,再按“2.1”项下色谱条件进样测定。以5号峰的峰面积和保留时间为参照,记录各共有峰的相对峰面积和相对保留时间。结果,7个共有峰的相对峰面积的RSD均小于7.0%,相对保留时间的RSD均小于2.5%,表明供试品溶液在室温下放置24 h内稳定性良好。
2.4 黄连花薹HPLC指纹图谱的生成、相似度评价和共有峰指认
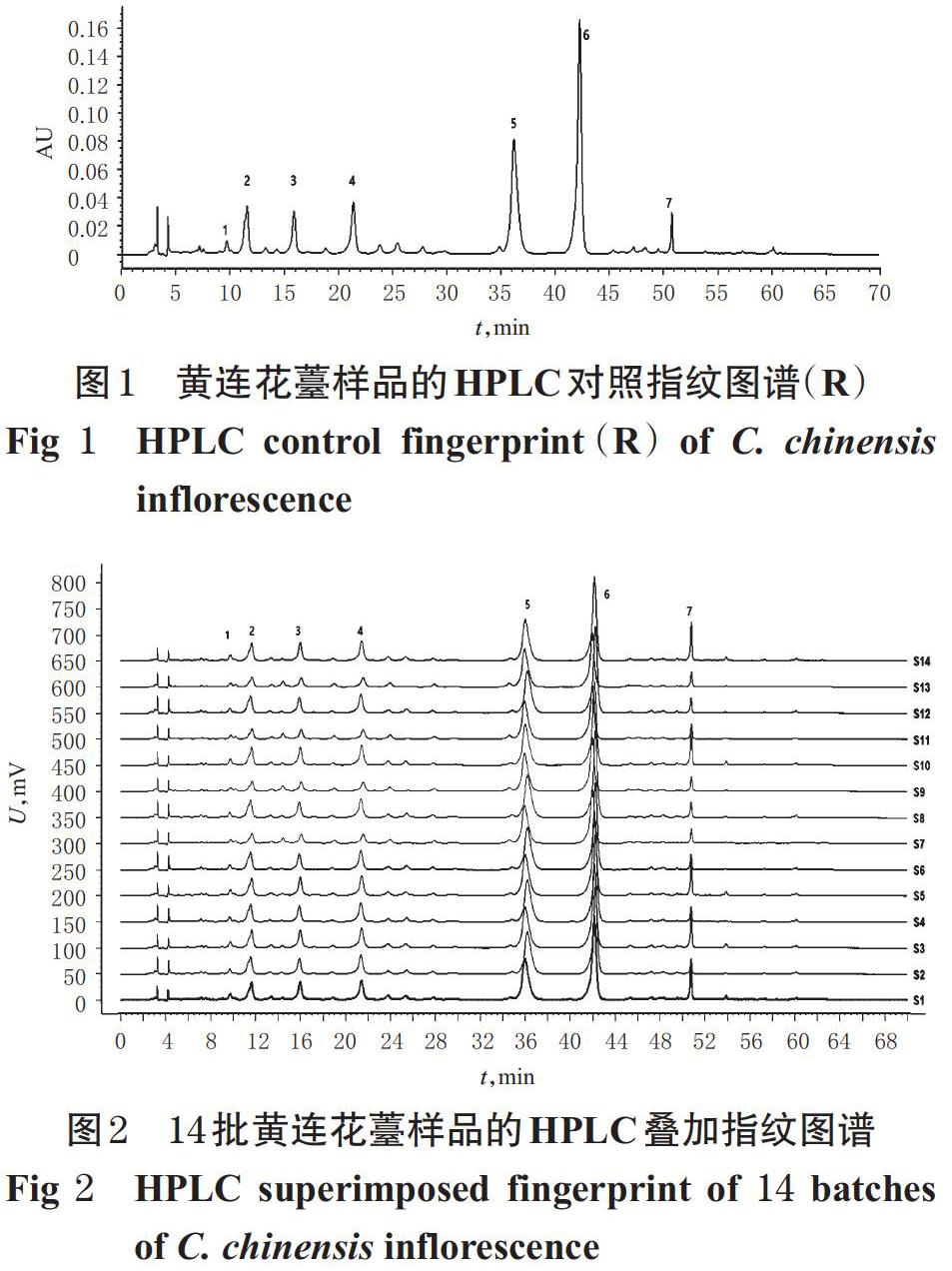
2.4.1 HPLC指纹图谱的生成 取14批黄连花薹粉末适量,分别按“2.2.1”方法制备供试品溶液,再按“2.1” 项下色谱条件进样测定。采用《中药色谱指纹图谱相似度评价系统》(2012版)对14批黄连花薹样品的指纹图谱进行分析,得黄连花薹样品HPLC对照指纹图谱(R)和叠加指纹谱图,详见图1、图2。
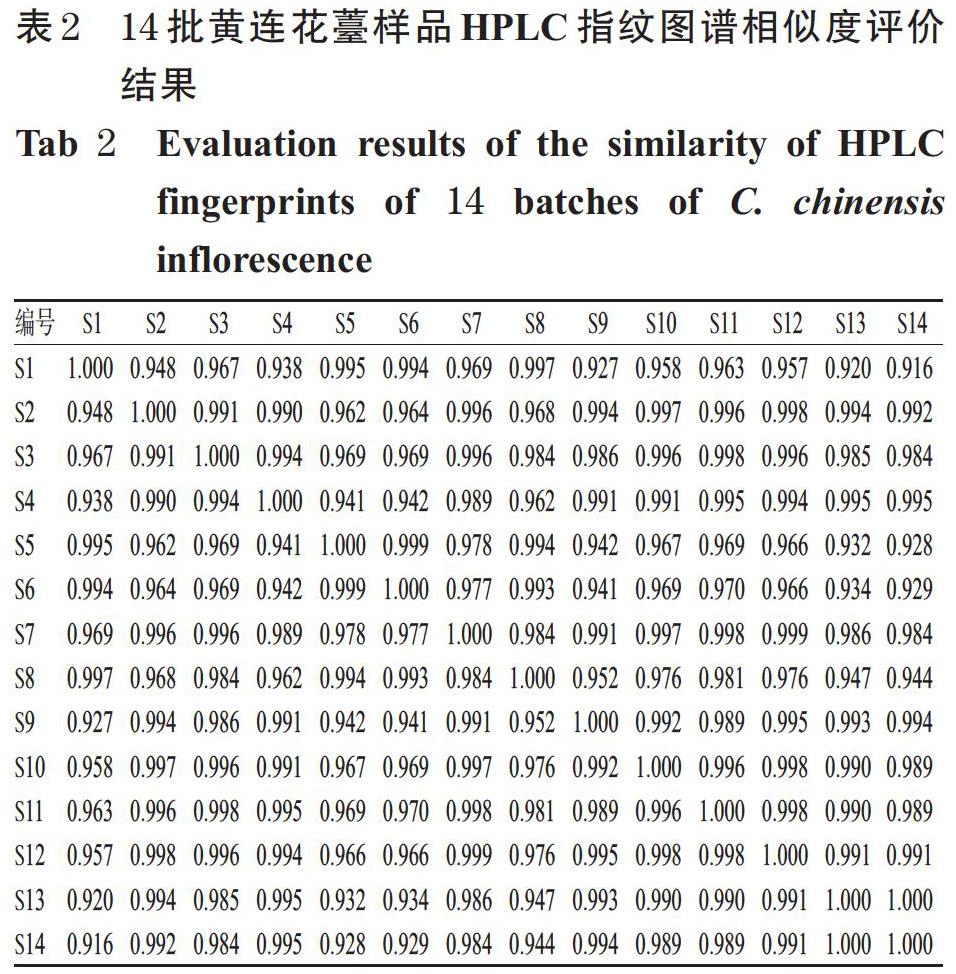
2.4.2 相似度评价 采用《中药色谱指纹图谱相似度评价系统》(2012版)进行相似度评价。结果,14批黄连花薹样品的相似度均不低于0.916,提示不同产地的黄连花薹样品间的化学成分差异较小,详见表2。
2.4.3 共有峰的指认 以14批黄连花薹的HPLC指纹图谱为研究对象,采用《中药色谱指纹图谱相似度评价系统》(2012版)软件,设置时间窗口为0.1 min,选择指纹图谱中峰形较好的色谱峰进行多点校正,采用中位数法生成对照图谱,可知其共有7个共有峰;结合对照品的HPLC图谱,指认出5号峰为盐酸小檗碱,详见图3。以盐酸小檗碱峰面积为参照,计算共有峰的相对保留时间和相对峰面积,详见表3、表4。
2.5 黄连花薹抗氧化作用考察
2.5.1 DPPH自由基清除率测定 精密称取黄连花薹粉末0.12 g于锥形瓶内,精密加入水100 mL,超声提取30 min后,冷却至室温,快速滤过;取其续滤液3.3 mL于10 mL量瓶中,加水稀释至刻度,制成质量浓度为0.4 mg/mL的样品溶液。精密移取样品溶液2 mL和DPPH溶液2 mL于25 mL比色管中避光反应20 min后,采用紫外分光光度计于517 nm波长下测定吸光度值Ai;另移取样品溶液2 mL和水2 mL于25 mL比色管中避光反应20 min,于相同波长下测定吸光度值Aj;另移取DPPH溶液2 mL与水2 mL于25 mL比色管中避光反应20 min,于相同波长下测定吸光度值Ac。上述试验平行操作3次,取平均值,并计算DPPH自由基清除率,DPPH清除率=[1-(Ai-Aj)/Ac]×100%。根据文献[5]方法,对DPPH自由基清除率结果进行回归分析,预测半数抑制浓度(IC50),结果见表5。
2.5.2 羟自由基清除率测定 精密称取黄连花薹粉末0.12 g于锥形瓶内,按“2.5.1”项下“精密量取水100 mL……0.4 mg/mL样品溶液”方法操作,然后移取样品溶液2 mL和6 mmol/L FeSO4溶液2 mL于25 mL比色管中,加入6 mmol/L H2O2溶液2 mL,摇匀后静置10 min,加入6 mmol/L水杨酸溶液2 mL,摇匀后静置30 min,采用紫外分光光度计于510 nm波长下测定吸光度值Ai;另移取6 mmol/L FeSO4溶液2 mL和水2 mL于25 mL比色管中,加入6 mmol/L H2O2溶液2 mL,摇匀后静置10 min,加入6 mmol/L水杨酸溶液2 mL,摇匀后静置30 min,于上述相同波长下测定吸光度值A0;另移取样品溶液2 mL和6 mmol/L FeSO4溶液2 mL于25 mL比色管中,加入6 mmol/L H2O2溶液2 mL,摇匀后静置10 min,加入无水乙醇溶液2 mL,摇匀后静置30 min,于上述相同波长下测定吸光度值Aj。上述试验平行操作3次,取平均值,并计算羟自由基清除率,羟自由基清除率=[1-(Ai-Aj)/A0]×100%。根据文献[5]方法,对黄连花薹羟自由基清除率结果进行回归分析,預测IC50,结果见表5。
2.6 黄连花薹抑菌作用考察
2.6.1 供试品溶液的制备 精密称定黄连花薹粉末适量于锥形瓶内,加水50 mL,称定质量,超声30 min后冷却至室温,滤过;再加水50 mL于残渣中,超声30 min,过滤;合并2次滤液,冷冻12 h后,进行干燥,即得黄连花薹浸膏。临用时,取浸膏适量置于10 mL量瓶中,以水稀释至刻度,即得供试品溶液。
2.6.2 细菌培养 取大肠埃希菌菌种适量加入无菌水中摇匀,涂布于牛肉膏蛋白胨平板上,于37 ℃培养24 h后备用。
2.6.3 抑菌试验 精密称取黄连花薹粉末4.0 g,按“2.6.1”项下方法制备供试品溶液。取“2.6.2”项下大肠埃希菌以水调整成密度为1×108个/mL的菌悬液,涂布于牛肉膏蛋白胨平板上,采用牛津杯法[6]分别将黄连花薹浸膏供试品溶液、0.90 mg/mL阿莫西林溶液(阳性对照)、水(空白对照)各80 μL点样于同一平板,于37 ℃培养24 h后,测定抑菌圈横竖直径,计算抑菌圈面积大小及相对抑菌活性(相对抑菌活性=黄连花薹样品抑菌圈面积×0.9/阿莫西林抑菌圈面积×100%),结果见表6。
2.7 黄连花薹谱效关系分析
以14批黄连花薹药材样品的抗氧化活性指标(DPPH自由基清除率和羟自由基清除率,见表5)和相对抑菌活性(见表6)为因变量,HPLC指纹图谱共有峰峰面积为自变量,采用SPSS 21.0软件进行Pearson相关性分析。结果表明,黄连花薹样品HPLC指纹图谱中的7个共有峰与DPPH自由基清除率呈正相关;1、2、3、4、6、7号峰与羟自由基清除率呈正相关,5号峰与羟自由基清除率呈负相关;5号峰与相对抑菌活性呈正相关。这提示1、2、3、4、6、7号峰对应的化学成分是黄连花薹清除DPPH和羟自由基的主要物质基础,5号峰对应的盐酸小檗碱是黄连花薹抗菌作用的主要物质基础,详见表7、表8。
2.8 谱效关系模型的构建
参考文献[7]进行模型构建,采用SPSS 21.0软件中“Regression”下的“Linear”选项,以黄连花薹共有峰峰面积为X,分别以DPPH清除率、羟自由基清除率、相对抑菌活性为Y,采用多重线性回归建立谱效关系模型。结果,回归方程分别为YDPPH自由基清除率=-(6.568×2.72-7)X峰1+ (1.660×2.72-7)X峰2-(8.565×2.72-7)X峰3+(3.838×2.72-7)X峰4-(1.780×2.72-7)X峰5+(4.959×2.72- 8)X峰6+(2.211×2.72-7)X峰7+0.989;Y羟自由基清除率=-(5.781×2.72-7)X峰1-(5.246×2.72-8)X峰2+(8.075×2.72-7)X峰3-(2.474×2.72-7)X峰4+(1.454×2.72- 7)X峰5-(2.443×2.72-8)X峰6-(7.071×2.72-8)X峰7-0.025;Y相对抑菌活性=(4.820×2.72-7)X峰1+(3.184×2.72-8)X峰2-(6.107×2.72-7)X峰3+(5.287×2.72-7)X峰4-(9.272×2.72-8)X峰5-(1.751×2.72-8)X峰6-(5.162×2.72-8)X峰7+0.523。
2.9 黄连花薹谱效关系模型的验证
另取7批黄连花薹粉末(编号S1、S3、S4、S5、S9、S11、S14),分别测定各批次样品的共有峰峰面积、DPPH清除率、羟自由基清除率、相对抑菌活性后,将这7批样品的共有峰峰面积代入“2.8”项下回归方程中,即得Y的预测值,并将其与测量值进行比较。结果,黄连花薹样品DPPH自由基清除率、羟自由基清除率、相对抑菌活性的预测值与测量值的相对误差为0.92%~14.5%,表明所建立的谱效关系模型可用于黄连花薹抗氧化作用、抗菌作用的预测与评价,详见表9。
3 讨论
目前,中药质量控制方法多以化学成分的定性和定量分析为主,包括HPLC指纹图谱在内的多种分析方法已被广泛地应用于中药整体质量控制中,其中指纹图谱包括相似度、相对保留时间和相对峰面积以及共有峰和非共有峰的数量等,但是这些指标仅能间接地控制药材的质量,不能明确控制其与临床药效的相关性[8]。
本研究以不同产地的黄连花薹作为研究对象,采用HPLC法建立指纹图谱,并以抗氧化作用(DPPH自由基清除率和羟自由基清除率)及抑菌作用作为药效指标,将黄连花薹样品的指纹图谱数据和药效指标数据进行谱效关系分析。结果,共确定7个共有峰,并指认5号峰为盐酸小檗碱;经相关性分析后,发现1、2、3、4、6、7号峰与抗氧化活性具有相关性,盐酸小檗碱与抑菌活性具有相关性,且与文献报道一致[3]。经验证后发现,预测值和实测值的相对误差未超过15%,表明本研究建立的谱-效关系模型可较好地预测和评价黄连花薹的抗氧化、抑菌作用。
综上所述,本研究建立的谱-效相关性模型可用于预测和评价黄连花薹的抗氧化、抑菌作用,1、2、3、4、6、7号峰所代表化学成分是黄连花薹抗氧化作用的物质基础,盐酸小檗碱是其抑菌作用的物质基础。
参考文献
[ 1 ] 魏华波,董洋,谭兵,等.黄连花薹化学成分和药理作用的研究进展[J].现代生物医学进展,2014,14(27):5342- 5344.
[ 2 ] 屠大伟,张保顺,李学刚.黄连花茶加工工艺及其抗氧化作用研究[J].食品工业科技,2007(5):165-167.
[ 3 ] 尹良军,周振旗,绍元,等.盐酸小檗碱、人参皂苷Rb1、黄芩苷及绿原酸对大肠埃希菌和金黄色葡萄球菌的抑菌作用研究[J].医学综述,2016,22(24):4969-4972.
[ 4 ] 伍利华,杨慧,等.反相高效液相色谱法及紫外-可见分光光度法测定黄连花薹的含量[J].时珍国医国药,2019,30(6):1330-1332.
[ 5 ] 李琛,张婷,罗安伟,等. 8种猕猴桃抗氧化活性评价及基于HPLC与FT-IR指纹分析的品种区分[J].现代食品科技,2016,32(6):288-297.
[ 6 ] 李海华,郭蔚冰,陈志强,等. 45味中药对多重耐药大肠杆菌的抑菌效果[J].中國现代中药,2019,21(6):791- 796.
[ 7 ] 李鹏,李祥,陈建伟,等.桃红四物汤干预痛经模型小鼠有效部位的谱效关系研究[J].中国实验方剂学杂志,2010,16(9):144-149.
[ 8 ] 伍利华,张佳,邓燕君,等.基于酶活性的丹参茎叶活血活性谱-效模型[J].中国实验方剂学杂志,2019,25(23):133-138.
(收稿日期:2020-09-15 修回日期:2021-01-16)
(编辑:唐晓莲)
