异硫氰酸苯乙酯联合阿霉素诱导骨肉瘤细胞凋亡的作用研究
2021-04-07李文浩丘德赞黄孝英李浩曦何基琛
范 锲,李文浩,丘德赞,黄孝英,李浩曦,何基琛
骨肉瘤是一种罕见的肉瘤类型,但它也是最为常见骨组织来源的恶性肿瘤,常常因早期的肺转移而导致极差的预后[1~3]。骨肉瘤可发生在所有年龄段,但儿童发病更为常见,占全球所有儿科恶性肿瘤患者的2.4%[4]。阿霉素(adriamycin,ADM)属于化疗药物的一种,这种蒽环类抗生素能够减缓或阻滞癌细胞的生长[5,6],已被临床应用于治疗包括骨肉瘤在内的各种类型的癌症[7]。与其他化疗药物一样,虽然ADM对癌细胞有杀伤作用,但最终也会因癌细胞对ADM产生耐药性而失效[8,9]。此外,毒副作用降低了患者治疗的成功率。因此,有必要探讨增强ADM作用的新方法,以降低其临床用药量。异硫氰酸苯乙酯(phenethyl isothiocyanate,PEITC)是多种十字花科蔬菜中天然存在的异硫氰酸酯的化合物,是重要的异硫氰酸酯类家族成员之一[10,11]。PEITC可调节前列腺癌、白血病和骨髓瘤细胞的表观遗传过程,并抑制组蛋白去乙酰酶[12~14]。有研究[15]表明,PEITC可抑制不同类型肿瘤细胞的增殖,诱导细胞凋亡。另外,PEITC在临床中也已被证明可增强肿瘤细胞对化疗药物的敏感性,并协同增强化疗药物诱导的癌细胞凋亡[16]。本研究旨在通过细胞实验探讨PEITC与ADM对骨肉瘤细胞凋亡的协同作用及相关机制,为临床治疗提供科学依据,现报告如下。
1 材料与方法
1.1实验材料 骨肉瘤U2-OS细胞株购自中国科学院上海细胞库;ADM购自美国Sigma公司;PEITC购自TCI公司;细胞凋亡蛋白酶(Caspase)-3活性检测试剂盒购自中国海门市碧云天生物技术研究所;Caspase-3抗体、Caspase-9抗体、细胞表面死亡受体Fas抗体、细胞表面死亡受体配体FasL抗体购自美国genetech公司;二抗购自中国南京金斯瑞生物科技有限公司;甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)试剂盒购自中国Solarbio公司。
1.2细胞培养 采用含10%浓度胎牛血清的RPMI1640培养基培养U2-OS细胞,细胞培养箱条件设置为5% CO2、37 ℃。根据细胞生长状况进行细胞传代,取处于对数生长期的U2-OS细胞进行后续相关实验。
1.3MTT法检测细胞增殖能力 选取呈现对数生长的U2-OS细胞,稀释至5×104cells/ml,以100 μl/孔种植到96孔无菌培养板中,以37 ℃、5% CO2条件培养6~12 h,待细胞贴壁。ADM组分别按照1 μg/ml、2.5 μg/ml、5 μg/ml、10 μg/ml和25 μg/ml的ADM药物终浓度对细胞进行干预处理,PEITC组分别按照2 μM/ml、4 μM/ml、8 μM/ml、16 μM/ml、32 μM/ml和64 μM/ml的PEITC药物终浓度对细胞进行干预处理。绘制细胞增殖曲线并分别计算ADM和PEITC的半抑制浓度(IC50)。另外,应用MTT法检测ADM联合PEITC对细胞增殖的影响,选取呈现对数生长的U2-OS细胞,调整细胞浓度为2×104cells/ml,每孔加入100 μl。分组及干预方法如下:ADM 1组(2 μg/ml ADM)、ADM 2组(3 μg/ml ADM)、ADM 3组(10 μg/ml ADM);PEITC 1组(1 μM/ml PEITC)、PEITC 2组(2 μM/ml PEITC)、PEITC 3组(5 μM/ml PEITC);A+P 1组(2 μg/ml ADM+1 μM/ml PEITC)、A+P 2组(3 μg/ml ADM+2 μM/ml PEITC)、A+P 3组(10 μg/ml ADM+5 μM/ml PEITC)、空白对照组(未添加药)。每孔终体积100 μl,每个浓度设3个重复孔,继续培养24 h后每孔加入20 μl MTT溶液,使用ST360酶标仪(上海科华公司)进行检测,在570 nm波长下检测并记录其OD值。抑制率=(实验孔OD值-空白孔OD值)/空白孔OD值×100%。Q值的计算公式如下:Q=Ea+b/(Ea+Eb-Ea×Eb)。Ea和Eb分别表示单独使用ADM和PEITC的抑制率;Ea+b为ADM与PEITC联合抑制率。Q值>1.15表示协同效应;0.85≤Q值≤1.15为相加效应,Q值<0.85为拮抗效应。
1.4TUNEL法测定U2-OS细胞凋亡 使用荧光素碎片DNA片段检测试剂盒(DeadEnd,美国)进行TUNEL检测。经磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗去U2-OS细胞培养液,4 ℃条件下使用4%甲醛溶液固定25 min,PBS液洗涤5 min×2次。加入0.2% TritonX-100室温孵育5 min,PBS液洗涤5 min×2次。加入100 μl平衡缓冲液室温平衡10 min。加入50 μl末端脱氧核苷酰转移酶工作液,37 ℃湿盒内避光孵育60 min。加入预先配置好的SSC溶液洗涤15 min。再次加PBS溶液室温洗涤5 min×3次。在4,6-联脒-2-苯基吲哚染液室温湿盒避光孵育10 min。然后加去离子水室温洗涤5 min×3次。荧光抗淬灭剂封片,使用荧光显微镜(U-REL-T,OLYMPUS)镜检。细胞凋亡率=阳性染色细胞(即凋亡细胞)/总细胞×100%。
1.5Caspase-3活性检测 按试剂盒提供的对硝基苯胺(p-nitroaniline,pNA;10 mmol/L)用标准品稀释液稀释,测定其405 nm处吸光度(A405值),并作出pNA浓度相当于A405值的pNA标准曲线,依据pNA标准曲线定量检测Caspase-3。取药物处理好的细胞加入裂解液,重悬后冰浴裂解15 min,使用聚氰基丙烯酸正丁酯蛋白检测试剂盒检测蛋白浓度。按照检测缓冲液50 μl+待测样本40 μl+10 μl Caspase-3显色底物(2 mmol/L)配置反应体系,37 ℃孵育120 min后应用酶标仪(DNM-9602A)测定其A405值。样品中Caspase-3催化产生的pNA产生的吸光度值=样品孔A405值-空白对照孔A405值。
1.6Western blot检测Caspase-3、Fas、FasL蛋白表达 使用含有60 g/ml苯甲基磺酰氟的裂解缓冲液提取U2-OS细胞的总蛋白。使用BCA蛋白检测试剂盒检测蛋白浓度。蛋白样品经100 ℃水浴变性5 min,然后进行聚丙烯酰胺凝胶电泳,电泳完毕后将蛋白从胶转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。将膜浸在封闭液中4 ℃封闭过夜。将膜取出放入一抗液中,4 ℃封闭过夜。PBST洗膜,5 min×4次。将膜转入二抗液中,37 ℃孵育1 h,用洗脱液洗涤3次,前两次5 min,第三次10 min,然后用镊子轻轻地将PVDF膜放置于曝光盒里,于暗室内压片并冲印成像。应用胶片用凝胶成像系统(ChemiDoc MP Imaging System,美国BIO-RAD公司)进行扫描及数据采集。
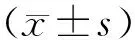
2 结果
2.1PEITC和ADM对U2-OS细胞增殖能力的影响
MTT检测结果显示,PEITC和ADM浓度对U2-OS细胞的IC50分别为4.37 μM/ml和6.61 μg/ml。见图1。与单独使用PEITC或ADM处理相比,联合使用两种药物对U2-OS细胞的增殖抑制率更高(P<0.05)。低剂量的PEITC联合ADM产生协同效应,而高剂量的两种药物联合产生相加效应,见表1。
2.2不同处理组U2-OS细胞的凋亡情况比较 荧光显微镜观察见较高浓度PEITC、ADM处理组的U2-OS细胞凋亡数多于较低浓度组,且低浓度PEITC联合ADM处理组的U2-OS细胞凋亡数比单独使用PEITC或ADM的高浓度处理组更多。见图2。除ADM(6.61 μg/ml)组与PEITC(4.37 μM/ml)组的U2-OS细胞凋亡率比较差异无统计学意义(P>0.05)外,其余不同处理组间U2-OS细胞的凋亡率比较差异均有统计学意义(P<0.05)。见表2。

ⓐADM干预处理;ⓑPEITC干预处理

表1 不同处理组U2-OS细胞增殖抑制率及Q值比较
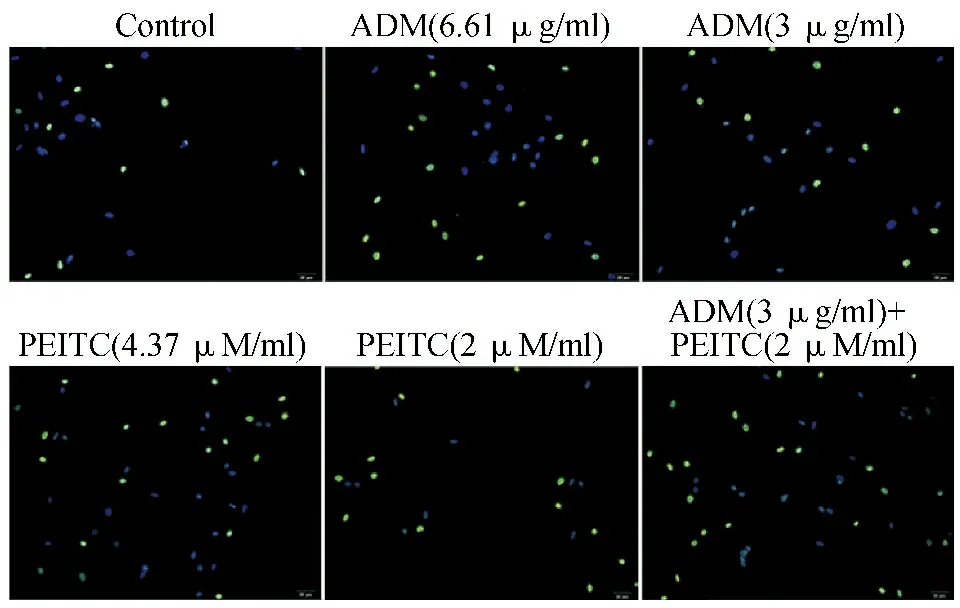
蓝色荧光表示正常U2-OS细胞,绿色荧光表示凋亡细胞

表2 不同处理组U2-OS细胞的凋亡率比较
2.3不同处理组Caspase-3活性比较 单因素方差分析结果显示,ADM(6.61 μg/ml)组和PEITC(4.37 μM/ml)组的U2-OS细胞Caspase-3活性显著高于空白对照组,ADM(6.61 μg/ml)联合PEITC(4.37 μM/ml)处理后,U2-OS细胞Caspase-3活性较单药处理组上升。见表3。

表3 不同处理组Caspase-3活性比较
2.4不同处理组Caspase-3、Fas、FasL蛋白表达水平比较 Western blot检测结果显示,ADM(6.61 μg/ml)+PEITC(4.37 μM/ml)组的Caspase-3蛋白表达水平显著高于ADM(6.61 μg/ml)组和PEITC(4.37 μM/ml)处理组,差异均有统计学意义(P<0.05)。另外,ADM(6.61 μg/ml)+PEITC(4.37 μM/ml)组的Fas蛋白表达水平显著低于PEITC(4.37 μM/ml)处理组(P<0.05),FasL蛋白表达水平显著高于ADM(6.61 μg/ml)组(P<0.05)。见图3,表4。

图3 Western blot检测结果图

表4 不同处理组Caspase-3、Fas、FasL蛋白表达水平比较灰度值]
3 讨论
3.1骨肉瘤是一种好发于10~20岁的青少年的原发性恶性骨肿瘤,常发生于长骨干骺端。目前对于骨肉瘤的疗法主要是采用手术切除肿瘤联合化疗的方式进行治疗。然而,骨肉瘤的早期肺转移以及较高的复发率也导致了骨肉瘤患者的高病死率和致残率。根据《骨肉瘤临床循证诊疗指南》[17]的建议,ADM被推荐作为一线化疗药物,尽管其大大地提高了患者的5年生存率及保肢率,但是ADM的耐药问题依然严峻,给临床治疗增加了一定的难度。PEITC是常用的人工合成的抗肿瘤单体,具有良好的抗肿瘤作用。目前,PEITC在肝癌、乳腺癌及骨髓瘤等恶性肿瘤的体外试验中显示出显著的抗肿瘤效果,诱导细胞凋亡作用明显[18]。高剂量的ADM可能会导致肿瘤耐药或是对机体产生较大的毒副作用,并最终导致治疗失败。本研究结果显示,当ADM联合PEITC作用于骨肉瘤细胞系时,ADM能够在一个相对较低的浓度获得一个令人满意的癌细胞增殖的抑制效果,这对指导临床研究的开展有实际意义。
3.2在本研究中,经MTT实验确定了PEITC和ADM处理U2-OS细胞系时的IC50分别为4.37 μM/ml和6.61 μg/ml。并且在药物浓度较低时,两种药物联合表现出显著的协同作用,而当药物浓度上升,协同作用变弱,则表现出相加作用。但无论如何,PEITC都能增强ADM对U2-OS细胞增殖的抑制作用。ADM可诱导多种类型癌细胞凋亡[19],PEITC也对肿瘤细胞具有相似的功能效果[20]。本研究结果显示,PEITC联合ADM处理U2-OS细胞可获得比单药处理更高的凋亡率,考虑可能为PEITC提高了U2-OS细胞对ADM凋亡作用的敏感性。
3.3ADM诱导癌细胞凋亡可能是多个信号通路共同作用的结果[21]。例如,ADM通过Fas介导的凋亡通路而诱导甲状腺癌细胞凋亡[22]。然而也有研究[23,24]认为,ADM诱导的细胞凋亡主要依赖肿瘤坏死因子相关的凋亡诱导配体-TRAIL受体信号,而并不是通过FasL、穿孔素、自然杀伤细胞受体D或血小板和T细胞活化抗原1进行。经PEITC和ADM处理的U2-OS细胞没有观察到FasL表达增加,且PEITC和ADM联合处理的U2-OS细胞观察到Fas表达下降,提示Fas/FasL信号通路未参与其凋亡过程。Caspase-3蛋白被称为死亡蛋白酶,是Caspases家族中最重要的细胞凋亡执行者之一。在蛋白酶级联切割过程中,Caspase-3蛋白发挥着重要的作用,一旦Caspase-3蛋白被激活就会导致细胞死亡[25]。本研究结果显示,经PEITC和ADM处理后,U2-OS细胞的Caspase-3蛋白活性和表达水平显著增强。活化的Caspase-3蛋白可引起与细胞结构、细胞周期及DNA修复相关基因或蛋白失活,诱发肿瘤细胞凋亡而抑制癌症的发生[26]。PEITC和ADM的协同作用(或是相加作用)可在较低药物浓度条件下达到上调Caspase-3蛋白表达的效果,并导致肿瘤细胞凋亡,实验结果对PEITC的临床应用提供了一定依据。
综上所述,PEITC联合ADM可在较低药物浓度条件下有效抑制U2-OS细胞增殖,提高细胞凋亡率,其作用可能与Caspase-3蛋白活性升高和表达量上调有关,这为PEITC联合ADM的临床应用提供了参考依据。
