白藜芦醇对链脲佐菌素诱导糖尿病小鼠肾脏损伤的保护作用
2021-04-07于中飞刘鲁英
于中飞刘鲁英
1.滨州医学院基础学院病理学教研室,山东烟台 264003;2. 高青县人民医院心血管内科,山东淄博 256300
糖尿病肾病(diabetic nephropathy, DN)是糖尿病最严重的微血管并发症。 我国是全球糖尿病人数最多的国家。 近10 年来,糖尿病肾病患者快速增长,已成为危害人类健康的公共卫生疾病。 目前在欧美等发达国家,DN 约占终末期肾病(ESRD)的50%,已成为尿毒症的首位原发病;在我国约占25%~40%,是患者血液透析的重要原因[1]。
糖尿病肾病的发病机制主要包括: 晚期糖基化终产物(AGEs)的积累、炎性作用、氧化应激、细胞因子激活、血流动力学异常及遗传易感性等[1]。 DN 发病隐匿且发病机制复杂,病情进展迅速且肾脏损伤难以逆转,复发率与致死率高,严重威胁国民健康。 及时发现与防治DN,对于延缓病情进展、提高患者生活质量意义重大。该文前期研究发现, 白藜芦醇可显著降低糖尿病小鼠肾脏内质网应激水平(CHOP 与GRP78),具有潜在治疗糖尿病肾病的作用。 因此,2018 年6 月—2019 年11 月期间选取正常与糖尿病小鼠共60 只,对白藜芦醇在糖尿病小鼠肾脏病变中的作用进行进一步研究, 旨在探索白藜芦醇对糖尿病肾脏损伤的保护作用及作用机制。 现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 选取6~8 周龄C57BL/6 雄性小鼠(购于济南鹏悦动物有限公司)60 只,分为3 组:正常对照组(20 只)、糖尿病组(20 只)与糖尿病白藜芦醇治疗组(20 只,于糖尿病小鼠建模成功后1 月起隔日给予白藜芦醇灌胃200 mg/kg)。
1.1.2 研究材料 链脲霉素、柠檬酸钠,白藜芦醇,快速血糖检测仪(罗氏生物科技有限公司,美国),RT-PCR检测及逆转录试剂盒(Takara-宝生物工程(大连)有限公司),TUNEL 细胞凋亡检测试剂盒(罗氏生物技术有限公司, 美国), 总SOD 活性检测试剂盒及脂质氧化(MDA)检测试剂盒(碧云天生物科技有限公司),兔抗小鼠VEGF 抗体及兔抗小鼠NF-κB 抗体(北京博奥森生物技术有限公司), 兔抗小鼠GAPDH 抗体及Cy3 标记羊抗兔IgG (武汉博士德生物技术有限公司),DAPI染色液(碧云天生物科技有限公司),基因合成引物(上海生工生物科技有限公司)。
1.2 方法
①小鼠肾脏肥大指数及肾功能检测: 小鼠给药后第5 个月时,将小鼠称重,腹腔注射足量麻醉药物(水合氯醛)处死。 迅速开腹,取出一侧肾脏,生理盐水冲洗后,滤纸片吸干水分,称重。
肾脏肥大指数=1 000×肾脏重量(mg)/体重(g)
小鼠肝肾功能检测采用自动生化分析仪完成。 检测前需要先将小鼠禁食8~12 h,给予适量麻醉后,去眼球收集新鲜血液。4℃离心机离心后,收集上层淡黄色血清进行检测(BUN 和Scr)。将各组小鼠置于洁净的代谢物收集笼内,收集24 h 小鼠尿液,2 000 r/min 离心除去沉渣后取上清液,采用双缩脲法进行尿蛋白定量。
②小鼠肾脏皮质超氧化物歧化酶(SOD)活性与脂质过氧化代谢产物丙二醛(MDA)含量检测:使用适量水合氯醛腹腔麻醉小鼠, 用含有0.16 mg/mL 肝素钠的氯化钠溶液(0.9%NaCl)进行灌注处理。 待小鼠血液完全排空后迅速取下肾脏切取适量肾脏皮质组。 按照SOD 活性和MDA 含量检测试剂盒内说明书进行样品处理与上述指标的检测,并对数据进行换算。
③免疫荧光组织化学染色: 将肾脏组织冰冻切片室温复温后使用4%多聚甲醛固定、Triton 透化、1%BSA封闭后, 使用兔抗小鼠VEGF 抗体或兔抗小鼠NF-κB抗体(1:100,体积分数1%BSA+抗体)在4℃冰箱中过夜孵育, 次日复温后使用PBS 清洗后在荧光标记的二抗中常温孵育1 h,PBS 清洗后使用DAPI 行细胞核染色,暗室中使用抗荧光猝灭封片液封片及荧光显微镜下照相拍照。
④TUNEL 检测: 将肾脏组织冰冻切片室温复温后滴加蛋白酶K 工作液(约15 μg/mL),室温环境下孵育30 min 后用PBS 洗涤3 次,4 min/次。 将提前配制好的TUNEL 混合液(50 μL 酶溶液与450 μL 荧光素标记溶液混匀)滴于样本上,室温环境下避光孵育1 h。 然后用PBS 洗涤3 次, 滴加DAPI 染色液进行细胞核染色,避光条件下孵育2 min。 PBS 洗涤3 次后用封片液(含防淬灭剂)封片,在荧光显微镜下观察照相。
⑤RT-PCR mRNA 检测VEGF 及NF-κB 的基因表达水平:各组小鼠过量麻醉处死后,迅速取新鲜肾脏膜组织。 总RNA 提取以及逆转录均按照提取试剂盒和逆转录试剂盒说明步骤进行操作。 基因表达水平相对定量采用2-ΔΔCT法分析。
⑥Western blot 蛋白检测: 取新鲜肾脏组织后用胰酶消化、裂解、提取各组蛋白,BCA 法测量蛋白浓度,按50 μg/孔加样,按照相对分子质量的不同,选择相应浓度的分离胶进行电泳, 然后电转至聚偏氟乙烯(PVDF)膜上,5%牛血清白蛋白(BSA)室温封闭l h,分别稀释相应一抗,4℃孵育过夜,TBST 洗膜,荧光二抗室温避光孵育1 h,TBST 洗膜,胶片曝光显影和定影。 将获得的显影胶片彻底清洗,通风处晾干。 最后进行照相采集与结果分析,使用Image J 软件分析胶片灰度值。 最后以目的蛋白/GAPDH 作为蛋白相对表达值。
1.3 统计方法
该研究中实验数据采用SPSS 15.0 统计学软件分析数据,计量资料用(±s)表示,组间差异比较用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组小鼠肾脏指数
小鼠给予各自药物灌胃处理5 个月后, 对小鼠进行肾脏指数(肾质量/体质量)检测。结果提示,糖尿病组小鼠和白芦藜醇治疗组相比正常对照组小鼠肾脏指数均明显增高,差异有统计学意义(P<0.05),而白藜芦醇显著降低糖尿病小鼠肾脏指数, 对比糖尿病组小鼠和白芦藜醇治疗组小鼠, 白芦藜醇治疗组肾脏指数明显小于糖尿病组,差异有统计学意义(P<0.05),见表1。
表1 3 组小鼠肾脏指数比较[(±s),g/kg]

表1 3 组小鼠肾脏指数比较[(±s),g/kg]
注:*#P<0.01;*&P<0.01;&#P<0.01
组别肾脏指数正常组糖尿病组白藜芦醇治疗组(13.9±1.4)*(19.5±3.2)&(16.4±2.1)#
2.2 3 组小鼠尿量尿蛋白含量
小鼠给予各自药物灌胃处理5 个月后, 对小鼠进行24 h 尿量和尿蛋白检测。结果提示,糖尿病小鼠和白芦藜醇治疗组相比正常对照组小鼠24 h 尿量和尿蛋白均明显增高,差异有统计学意义(P<0.05),而对比糖尿病组小鼠和白芦藜醇治疗组小鼠, 则发现白芦藜醇治疗组24 h 尿量和尿蛋白明显小于糖尿病组, 白藜芦醇显著降低糖尿病小鼠尿蛋白含量, 差异有统计学意义(P<0.05),见表2。
表2 3 组小鼠24 h 尿量、尿蛋白含量对比(±s)

表2 3 组小鼠24 h 尿量、尿蛋白含量对比(±s)
注:*#P<0.05;*&P<0.05;★&P<0.05;★※P<0.05;&#P<0.05;☆※P<0.05
组别尿量(mL) 尿蛋白(mg)正常组糖尿病组白芦藜醇治疗组(1.32±0.40)*(3.84±1.07)&(2.98±0.85)#(2.17±0.30)★(8.37±1.06)☆(6.25±0.74)※
2.3 3 组小鼠血肌酐(Scr)和尿素氮(BUN)检测含量
小鼠给予各自药物灌胃处理5 个月后, 对小鼠进行取血于自动生化分析仪上进行肾功能检测。结果提示, 糖尿病小鼠和白芦藜醇治疗组相比正常对照组小鼠血肌酐(Scr)和尿素氮(BUN)水平均明显增高,差异有统计学意义(P<0.05),而对比糖尿病组小鼠和白芦藜醇治疗组小鼠,则发现白芦藜醇治疗组血肌酐(Scr)和尿素氮(BUN)明显小于糖尿病组,白藜芦醇显著降低糖尿病小鼠血肌酐(Scr)和尿素氮(BUN)含量,差异有统计学意义(P<0.05),见表3。
表3 3 组小鼠血肌酐(Scr)和尿素氮(BUN)检测含量对比[(±s),mmol/L]

表3 3 组小鼠血肌酐(Scr)和尿素氮(BUN)检测含量对比[(±s),mmol/L]
注:*#P<0.05;*&P<0.05;★&P<0.05;★※P<0.05;&#P<0.05;☆※P<0.05
组别血肌酐(Scr) 血尿素氮(BUN)正常组糖尿病组白芦藜醇治疗组(28.2±0.7)*(52.4±2.3)&(37.5±4.1)#(5.3±0.4)★(13.8±0.6)☆(9.8±1.1)※
2.4 3 组小鼠肾脏皮质超氧化物歧化酶(SOD)活性和脂质过氧化代谢产物丙二醛(MDA)含量
小鼠给予各自药物灌胃处理5 个月后, 对各组小鼠肾脏皮质进行超氧化物歧化酶(SOD)活性和脂质过氧化代谢产物丙二醛(MDA)含量检测。结果提示,糖尿病小鼠和白芦藜醇治疗组相比正常对照组小鼠肾脏皮质超氧化物歧化酶(SOD)活性水平均明显降低,脂质过氧化代谢产物丙二醛(MDA)含量则明显增高,差异有统计学意义(P<0.05);而对比糖尿病组小鼠和白芦藜醇治疗组小鼠, 则发现白芦藜醇治疗组小鼠肾脏皮质超氧化物歧化酶(SOD)活性水平明显大于糖尿病组,脂质过氧化代谢产物丙二醛(MDA)含量则明显少于糖尿病组小鼠,差异有统计学意义(P<0.05)。白藜芦醇能够明显增加糖尿病小鼠肾脏皮质超氧化物歧化酶(SOD)活性,并减少脂质过氧化代谢产物丙二醛(MDA)含量。见表4。
表4 3 组小鼠肾脏皮质超氧化物歧化酶(SOD)活性和脂质过氧化代谢产物含量对比(±s)

表4 3 组小鼠肾脏皮质超氧化物歧化酶(SOD)活性和脂质过氧化代谢产物含量对比(±s)
注:*#P<0.05;*&P<0.05;★&P<0.05;★※P<0.05;&#P<0.05;☆※P<0.05
组别SOD (NU/mL) MDA(mmol/mL)正常组(n=8)糖尿病组(n=8)白芦藜醇治疗组(n=8)(49.50±4.37)*(40.29±3.10)&(44.51±2.06)#(13.46±2.67)★(25.82±1.96)☆(19.28±2.33)※
2.5 糖尿病小鼠肾脏病理损害情况
对3 组小鼠肾脏行病理检测 (HE 染色和PAS 染色)。 可见正常组小鼠肾脏皮质内肾小球形态无明显异常,结构正常,分界清晰,系膜基质无增生。 而糖尿病组小鼠肾小球明显弥漫肥大,系膜增厚,肾小管管腔异常变窄,肾间质部分水肿,局灶性毛细血管鼻塞,炎症细胞浸润;白藜芦醇治疗组与糖尿病组相比,肾小球肥大明显减轻,系膜及基质增生明显减少,肾小管部分变窄减轻,肾间质水肿减轻,炎症细胞浸润减少,白芦藜醇能显著减轻糖尿病小鼠肾脏病理损害,见图1。
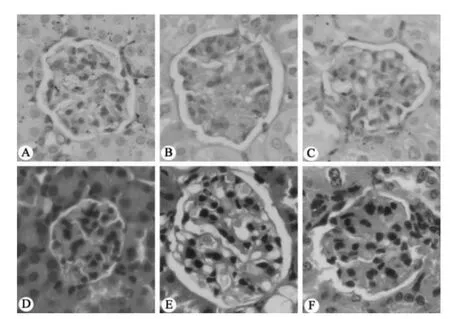
图1 各组小鼠肾脏病理切片染色。 小鼠肾脏PAS 病理染色:A:正常组;B:糖尿病组;C:白芦藜醇治疗组;小鼠肾脏HE 病理染色:D: 正常组;E:糖尿病组;F:白芦藜醇治疗组。
2.6 小鼠肾脏TUNEL 凋亡染色情况
对3 组小鼠肾脏行TUNL 凋亡检测。结果显示,正常小鼠肾脏凋亡细胞较少,有部分阳性染色;糖尿病小鼠则兼大量凋亡细胞阳性染色; 白芦藜醇治疗组小鼠肾脏见部分细胞凋亡阳性染色, 相比糖尿病小鼠明显减少, 白芦藜醇能够明显减轻糖尿病小鼠肾脏细胞凋亡水平,见图2。
2.7 VEGF 与NF-κB 在糖尿病小鼠肾脏表达情况
取各组小鼠肾脏皮质进行RT-PCR 与Westernblot 检测。结果显示,白藜芦醇治疗组相比糖尿病组小鼠肾脏皮质VEGF 与NF-κB 的mRNA 表达水平及蛋白表达水平均较低,差异有统计学意义(P<0.05)。 取各组小鼠肾脏冰冻切片后行免疫荧光染色检测观察蛋白表达强度。
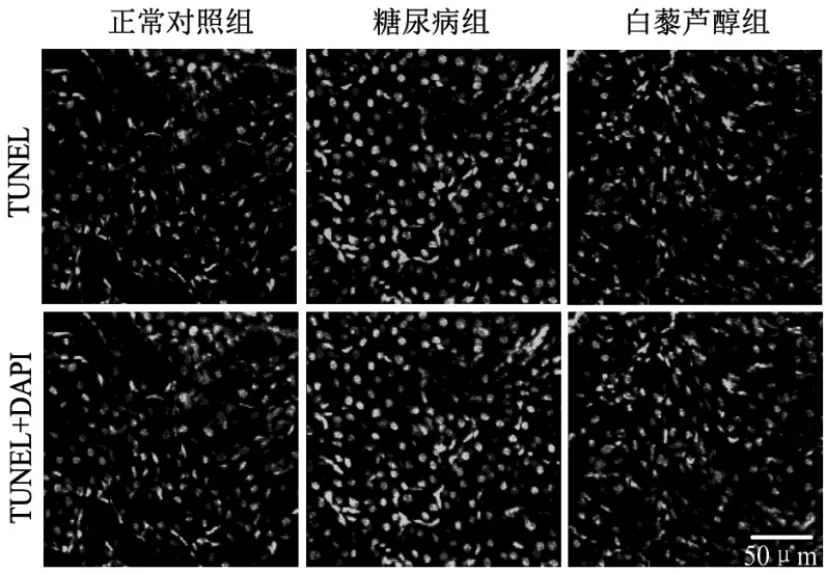
图2 3 组小鼠肾脏TUNEL 凋亡染色。 TUNEL 阳性染色表示细胞凋亡程度;DAPI 染色代表细胞核(放大倍数为200X)
正常组小鼠VEGF 蛋白荧光强度较低; 糖尿病组小鼠VEGF 蛋白荧光呈现高强度; 白芦藜醇治疗组小鼠VEGF 蛋白荧光相比正常组较强, 而相比糖尿病组小鼠强度明显降低, 白藜芦醇显著降低糖尿病小鼠肾脏VEGF 与NF-κB 的表达,见图3。
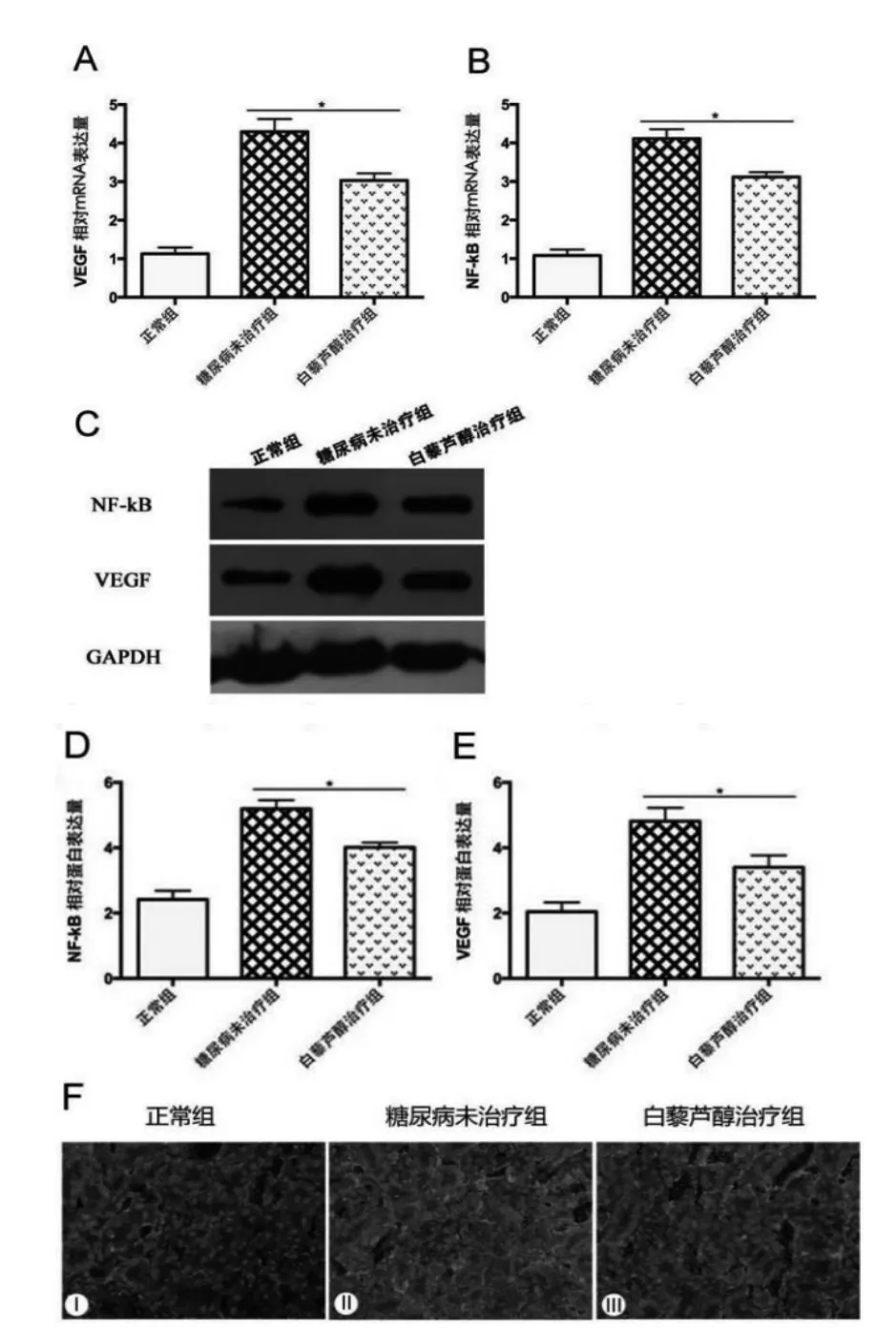
图3 白藜芦醇对VEGF 与NF-κB 在糖尿病小鼠肾脏表达的影响。 F,灰色原点为细胞核DAPI 染色。 (放大倍数为200X)
取各组小鼠肾脏皮质进行RT-PCR 检测, 结果显示: 与正常小鼠相比,糖尿病小鼠肾脏皮质内VEGF 与NF-κB 基因水平表达增加, 差异有统计学意义 (P<0.05);与糖尿病小鼠相比,白藜芦醇治疗组小鼠肾脏皮质内VEGF 与NF-κB 基因水平表达下降, 差异有统计学意义 (P<0.05)(A、B)。 取各组小鼠肾脏皮质进行Western-blot 检测,结果显示: 与正常小鼠相比,糖尿病小鼠肾脏皮质内VEGF 与NF-κB 蛋白水平表达量增加,差异有统计学意义(P<0.05);与糖尿病小鼠相比,白藜芦醇治疗组小鼠肾脏皮质内VEGF 与NF-κB 蛋白水平表达量下降,差异有统计学意义(P<0.05)(C、D、E)。取各组小鼠肾脏皮质冰冻切片进行免疫荧光组织化学染色,结果显示:与正常小鼠相比,糖尿病组小鼠肾脏皮质VEGF 荧光表达强度增加;与糖尿病小鼠相比,白藜芦醇组小鼠肾脏皮质VEGF 荧光表达强度降低。
3 讨论
糖尿病肾病是糖尿病最主要的并发症之一, 越来越受到人们的重视。 糖尿病肾病的发病机制复杂,其发病的关键在于细胞内环境的稳态遭到破坏[2-3]。 内质网是一种广泛存在于细胞中的细胞器, 对蛋白质的合成加工起到十分重要的作用。 内质网本身正常功能的维持具有极强的内在体系, 当遭到其他有害因素刺激时则会发生内质网应激反应(endoplasmic reticulum stress,ERS)。 ERS 在生理病理条件下的作用有明显差异,一定程度的ERS 可能对细胞起保护作用, 但是过度的ERS则会加剧细胞损伤[4]。
研究[4-6]表明,在糖尿病肾病的发病进展过程中,ERS、VEGF 与炎症因子的表达均起重要作用, 且ERS与VEGF 及炎症因子表达之间存在着紧密联系, 过度的ERS 能够上调VEGF 表达、激活炎症信号通路,导致血管损害与过度炎症反应,同时,内质网应激可以激活凋亡通路,引起足细胞凋亡。 当细胞内无功能蛋白处理受阻, 则聚集在内质网导致内环境紊乱发生内质网应激,激活NF-κB 等炎症因子以及VEGF 的表达,最终导致细胞凋亡[5]。
人类机体在糖尿病状态下的高血糖、炎症反应、氧化应激反应及细胞内外电解质紊乱等之间相互作用,均可加剧ERS。 既往研究[7]已证实,糖尿病肾病与内质网应激之间存在紧密关系,ERS 与糖尿病发病的关键因素胰岛β 细胞功能缺陷密切相关, 且ERS 的发生反映了肾脏损伤的程度[7]。
在糖尿病肾病发病进程中, 肾脏组织VEGF 表达增高,导致肾脏血管内皮细胞增生与迁移,诱发新生血管[8-11],异常新生的血管往往都存在一定的功能障碍,其细胞间连接稀疏,通透性过高,这使得血浆中蛋白渗出增加,从而导致蛋白尿产生[8]。VEGF 系统在糖尿病肾病发生发展过程中发挥了关键的作用, 其诱导了糖尿病肾病由初期进展到末期的整个过程[8-9]。 有研究[10-12]证实,在糖尿病肾病患者中,其肾脏组织表达VEGF 的水平与是否产生蛋白尿有关。 体内与体外实验均表明糖尿病环境导致肾脏细胞VEGF 表达量显著升高, 干预抑制VEGF 信号系统可以明显减轻糖尿病鼠的蛋白尿水平,同时改善肾小球肥大等病理损害[13]。
糖尿病肾病另一个关键因素是炎症反应, 过度的炎症反应会对肾脏细胞造成一系列严重损害。 NF-κB是TNF-α 介导的一种关键的转录因子, 在炎症反应信号通路、免疫反应、细胞增殖和凋亡过程中具有重要作用,也参与了糖尿病肾病的病理进程[14]。 在糖尿病患者和动物模型中都发现NF-κB 因子的激活[15]。 有动物实验研究发现, 抑制NF-κB 可以减少糖尿病肾脏血管损害和足细胞死亡,说明NF-κB 在DKD 发展中的起到重要作用[16]。
由此可见寻求一种对以上3 种DKD 主要治病因素的干预药物将具有广阔的临床应用前景。 白芦藜醇作为一种多酚化合物,具有抗氧化,清除自由基和抗内质网应激等多种药理活性作用, 对人体多个器官起到保护作用[17-18]。 但白藜芦醇对糖尿病肾病的保护机制中,扮演的阻断或减轻内质网应激尚无较深入的研究。在该研究中,采用了STZ 诱导的I 型糖尿病小鼠作为研究对象,对糖尿病小鼠进行长期白藜芦醇干预,从而验证了白芦藜醇对糖尿病肾病的保护作用。 与此同时,为了进一步探索白藜芦醇对糖尿病肾病的作用途径,该文重点检测了与内质网应激密切相关的VEGF 和相应炎症因子的表达水平。 通过该研究发现,给予糖尿病小鼠白藜芦醇干预治疗, 能够明显减轻减少尿蛋白和BUN、Scr 等含量。 有研究显示,白芦藜醇可能还通过增加胰岛素敏感性产生降低血糖的效果, 但在该研究采用的STZ 诱导的I 型糖尿病小鼠模型中未发现其改善血糖功效。 在肾脏病理切片观察发现,给予白芦藜醇治疗的小鼠肾脏病理损害明显较轻。 在TUNEL 肾脏切片染色中, 白藜芦醇治疗组小鼠肾脏凋亡水平明显低于糖尿病未治疗组, 说明白藜芦醇可以很好地抵抗糖尿病肾病过程中肾脏细胞的过度凋亡,减少肾脏损害。 在各相关主要因子的检测中,VEGF 与NF-κB 的表达水平也有明显差异, 结果明确了白藜芦醇对内质网应激和VEGF 以及炎症反应具有良好的抑制作用。
综上所述,由实验结果可知,白芦藜醇对于糖尿病肾病具有良好的保护作用。 同时,白藜芦醇可以明显减低糖尿病肾病病情发展过程中与内质网应激密切相关的VEGF 表达和炎症反应水平, 这些作用途径可能是白藜芦醇对糖尿病肾病的主要作用机制。 该研究仅初步探索了白芦藜醇降低内质网应激、VEGF 和炎症反应的药理作用,其关键深入机制还未阐明。 后续将对白芦藜醇的相关机制原理做进一步探索。
