高温胁迫对哲罗鱼血液指标和热休克蛋白基因的影响
2021-04-07佟广香唐国盘张庆渔张永泉匡友谊
佟广香,唐国盘,董 乐,张庆渔,张永泉,匡友谊
(1.中国水产科学研究院黑龙江水产研究所,黑龙江省冷水性鱼类种质资源及增养殖重点开放实验室,哈尔滨 150070;2.河南牧业经济学院动物科技学院,郑州 450046;3.上海海洋大学水产与生命学院,上海 201306)
哲罗鱼(Huchotaimen)属鲑形目鲑科哲罗鱼属,是鲑科鱼类中生长最快的冷水性鱼类,其肉质细嫩,味道鲜美,营养丰富[1]。目前哲罗鱼的野生资源十分匮乏,已被IUCN列为濒危物种红色名录,处于易危状态[2,3]。鱼类生长与水温密切相关,低于或高于鱼类的适宜生长水温时,就会妨碍鱼类的正常生长发育[4]。超出适宜生长温度可使鱼类的摄食量[5]、饲料报酬[6]、抗病力[7]和繁殖率[8]等生产指标显著降低,甚至导致鱼类大量死亡。哲罗鱼是典型的冷水性鱼类,对温度变化敏感,最适生长水温为15.0~18.0 ℃,当水温在12.0~18.0 ℃时,哲罗鱼生长速度随水温的升高而加快,18.0 ℃时达到顶峰[9];水温超过18.0 ℃时,哲罗鱼生长速度随水温的升高而降低,甚至死亡。由于水温的限制,在集约化网箱养殖过程中,夏季高温极易引起哲罗鱼应激反应,造成减产,甚至全部死亡[10];水温限制也使哲罗鱼的养殖区域仅分布在我国东北和西北地区[11],而我国北方水资源并不丰富,且冰封期较长、生长期短等因素导致哲罗鱼的养殖周期较长,生长优势不明显。选择高温耐受的哲罗鱼新品种能够在南方推广养殖,延长生长期,缩短养殖周期,已成为哲罗鱼养殖面临的一个难题。目前哲罗鱼的驯化养殖及人工繁育已经取得成功[12,13],温度对哲罗鱼幼鱼生长及摄食效率的影响也有报道[14],但未有高温胁迫的相关研究。本实验模拟自然状态下哲罗鱼的生存环境,采取缓慢升温的方式将水温升至26.0 ℃并保持96 h,探讨哲罗鱼在26.0 ℃时血细胞组成、血清生化指标及相关热应激蛋白基因的变化规律,弄清哲罗鱼处于高温时的生理变化,以期为哲罗鱼高温耐受相关研究提供理论参考依据。
1 材料与方法
1.1 材料
供试哲罗鱼由中国水产科学研究院黑龙江水产研究所渤海冷水性鱼试验站提供,随机选取健康的2龄哲罗鱼50尾,平均体重(128.0±12.0) g。将试验鱼移入控温鱼缸,每天投喂2次,水温(18.0±0.2) ℃,暂养20 d,待试验鱼适应环境后开始升温,每24 h升高1.0 ℃,升至(26.0±0.2) ℃维持96 h。分别于18.0 ℃和26.0 ℃的 0、24、48、96 h采样。取样前将试验鱼麻醉,每组取10尾,抽取2 mL血液,用于血细胞组成分析和血清分离;采集肝脏、心脏和血液RNA样本储存-80 ℃备用。
1.2 血细胞组成及血清生化指标的测定
用动物血液细胞分析仪(迈瑞BC-2800Vet)测定白细胞总数、红细胞数、淋巴细胞数、中性粒细胞数、单核细胞数、血红蛋白含量和血小板数。用全自动血液生化指标分析仪(迈瑞BS200)测定肝功能相关指标:总胆红素(T-bil-V)、白蛋白(ALB)、天门冬氨酸氨基转移酶(又称谷草转氨酶,AST)、碱性磷酸酶(ALP)和总蛋白(TP);血脂类:总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C);肾功能相关指标:肌酐(CREA-S)和二氧化碳(CO2);心脏功能:肌酸激酶(CK)。
1.3 RNA提取及qPCR扩增
Trizol法提取总RNA,并用反转录试剂盒合成第一链cDNA。本实验室对目前常用的10个内参基因(28SrRNA、gapdh、arbpr、18SrRNA、rps29、rpl13、rpl19、sdha、α-tublin和β-actin) 稳定性分析发现,在哲罗鱼的血液、心、脑和肝组织内,rpl13、rpl19和rps29均表现很好的稳定性,可以做RT-qPCR的内参基因(未发表),本实验选择rpl19基因作为内参基因。利用primer 5.0设计hsp60、hsp70、hsp90和rpl19基因特异性扩增引物(表1)。反应体系为10 μL,包括SYBR Green Mix 5 μL,c DNA 1 μL,10 pmol/μL的上下游引物各1 μL,ddH2O 2 μL。扩增程序为 95 ℃预变性30 s,95 ℃ 15 s,60.5 ℃ 20 s,40个循环;95 ℃ 15 s,60.5 ℃ 1 min,95 ℃ 1 min。
1.4 数据统计与分析

2 结果与分析
2.1 血细胞组成
血细胞数量的变化见表2,由表2可知白细胞和血小板的数量未发生显著性变化;红细胞数均显著高于对照组,并随着时间的增加而增加,96 h达极显著水平;淋巴细胞数在0、24和48 h时显著高于对照组,96 h极显著高于对照组;中性粒细胞数均显著低于对照组;单核细胞表现出下降趋势,在96 h显著低于对照组;血红蛋白在24 h的含量极显著高于对照组,在48 h与96 h显著高于对照组。此外值得注意的是在温度升至26.0 ℃后,随着时间的增加,淋巴细胞、中性粒细胞和血红蛋白在26.0 ℃不同时间点无显著性差异。

表2 高温胁迫下哲罗鱼血细胞数目Tab.2 Blood cell count of H.taimen under high temperature stress
2.2 血清生化指标变化
血清生化指标变化见表3,肝功能相关指标:总胆红素(T-bil-V)和白蛋白(ALB)与对照组无显著性差异;总蛋白(TP)呈现上升趋势,96 h显著高于对照组;谷草转氨酶(AST)先下降后上升,0 h极显著低于对照组,其余组别与对照组无显著差异;碱性磷酸酶(ALP)先上升后下降,0~48 h显著高于对照组,96 h下降至与对照组无显著差异。血脂类:低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)与对照组无显著性差异;总胆固醇(TC)呈现上升趋势,96 h显著高于对照组。肾功相关指标:肌酐(CREA-S)先下降、后上升、再下降,0 h显著低于对照组,24 h与对照组无显著差异,48 h时显著高于对照组;二氧化碳(CO2)呈现下降趋势,96 h时显著低于对照组。心脏功能:肌酸激酶(CK)先下降、后上升,均显著低于对照组。
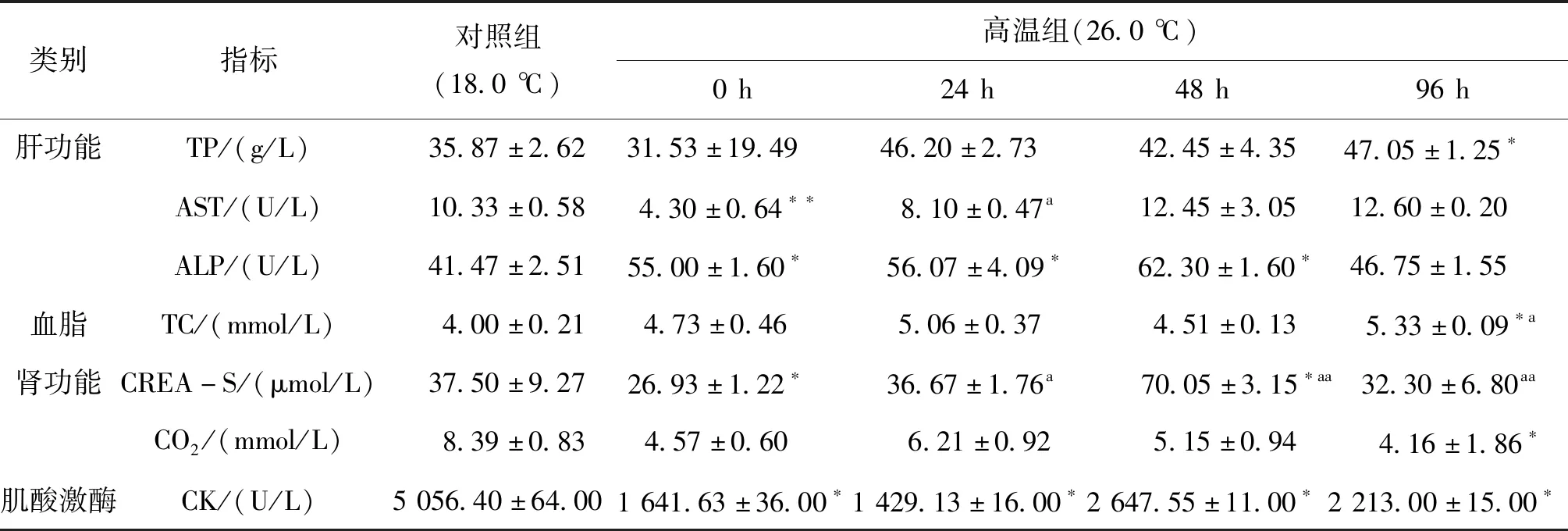
表3 高温胁迫下哲罗鱼血清生化指标Tab.3 Serum biochemical indexes of H.taimen under high temperature stress
2.3 相关基因的表达
血液中hsp70和hsp90基因表达量与对照组无显著差异,hsp60基因呈现上升趋势,24~96显著高于对照组。心脏和脑组织中hsp70与对照组无显著差异,hsp60和hsp90基因表现出先上升后下降的趋势,24 h和96 h极显著高于对照组。肝脏中hsp60基因表达与对照组无显著差异,hsp70和hsp90基因低于对照组,部分时间点达到显著水平,hsp90基因在肝脏中最先表现出极显著差异具体见图1。
3 讨论
红细胞和血红蛋白与鱼体内氧的供应直接相关[15],哲罗鱼在水温升至26.0 ℃时,红细胞即发生显著性增加,且随时间的延长红细胞数目持续显著增加,这是由于温度升高时,水中溶解氧含量降低,哲罗鱼活动性增强,鱼体耗氧量增加,需要改变呼吸频率来增加氧摄入,同时增加红细胞的数量和血红蛋白的含量,相应提升结合氧能力[16],来维持机体的耗氧。哲罗鱼用增加红细胞数目和血红蛋白含量来维持高温下鱼体耗氧,这与罗非鱼(Oreochromsmossambcus)、丁(Tincatinca)的研究结果一致[17]。除了红细胞和血红蛋白发生变化外,淋巴细胞、中性粒细胞和单核细胞也发生了变化。淋巴细胞、中性粒细胞和单核细胞均是与鱼体的免疫相关的细胞,鱼类处于系统发育较低阶段,淋巴细胞主要具有吞噬细菌、病毒的作用;中性粒细胞和单核细胞属于非特异免疫系统,中性粒细胞具趋化作用、吞噬作用和杀菌作用;单核细胞能吞噬、清除受伤、衰老的细胞及其碎片,非特异性免疫系统在抵抗病原生物入侵时发挥着重要作用。有研究表明,应激对鱼类吞噬细胞的数量有显著影响,各种功能受到抑制[18]。本试验高温胁迫过程中,淋巴细胞含量均显著高于对照组,中性粒细胞和单核细胞低于对照组与文献报道一致[18],说明以淋巴细胞为主的免疫系统正在积极的发挥作用,而非特异免疫功能受到抑制,这些免疫相关的细胞发生变化,说明26.0 ℃水温超出鱼体适应范围,鱼体极其不适应,鱼体处于感染状态。

图1 哲罗鱼热应激蛋白相关基因的表达Fig.1 Expression of heat shock protein genes of H.taimen
T-bil-V反映肝脏的分泌和排泄功能,TP和ALB反应肝脏合成储存功能,肝脏也是合成和存储总胆固醇(TC)的主要器官,本实验中T-bil-V和ALB与对照无显著差异,TP和TC呈现上升趋势,说明肝脏的合成和储存功能未受到影响。肝脏AST和ALP能够反映肝细胞损伤,当肝脏受到损伤时引起AST和ALP升高,已有研究报道松浦镜鲤(songpumirrorcarp)体内ALP的含量也随温度的升高而增加[19]。本试验中48 h和96 h AST高于对照组,而ALP均显著高于对照组,说明温度升高造成哲罗鱼肝损伤,影响部分肝功能。CREA-S是多数鱼类嘌呤代谢的终产物,常被用来评估鱼类鳃和肾脏的功能[20]。血清CREA-S的浓度变化主要由肾小球的滤过能力(肾小球滤过率)来决定,可在一定程度上准确反映肾小球滤过功能的损害程度,肾功能正常时,CREA-S排出率恒定,当肾实质受到损害时,肾小球的滤过率就会降低,CREA-S浓度升高。本试验中CREA-S含量表现先下降后上升的趋势,0 h显著低于对照组,24 h与对照组无显著差异,48 h时显著高于对照组,说明高温胁迫对哲罗鱼肾脏造成了损伤。同时鱼体内代谢产物CO2在血浆中富集会导致血浆酸化,降低血液的携氧能力和血红蛋白对氧气的亲和力[21,22],因此实验过程中CO2呈现下降趋势,以增加血液的携氧能力和血红蛋白对氧气的亲和力,保证鱼体供氧。CK和AST是心脏功能的重要检测指标,CK主要存在于细胞质和线粒体中,是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶[23]。CK下降说明甲状腺功能亢进,是由于甲状腺合成释放过多的甲状腺激素,造成机体代谢亢进和交感神经兴奋。AST主要分布在心肌,其次是肝脏、骨骼肌和肾脏等组织中[24]。正常状态下血清中的AST含量较低,但相应细胞受损时,细胞膜通透性增加,胞浆内的AST释放后进入血液,导致血清浓度升高。大黄鱼的CK和AST在32.0 ℃高温下持续7 d后的含量显著高于适温组,显示高温造成大黄鱼心功能障碍[25]。本试验中,当温度升至26.0 ℃时,CK和AST均显著性降低,CK先下降、后上升,均显著低于对照组,持续热刺激48 h开始回升,但不回升到正常水平;AST在48 h回升至正常水平,表明温度升至26.0 ℃对哲罗鱼心脏造成损伤,但随着时间增加损伤程度没有加剧且逐渐恢复,可见哲罗鱼在26.0 ℃高温胁迫过程中心脏具有一定的适应能力。
热休克蛋白(heat shock proteins,HSPs)是由机体受伤、紫外线暴露、受寒、组织修复等各种应激诱导表达的蛋白[26],是动物体处于应激状态时所诱导产生的蛋白质分子伴侣,具有阻止蛋白质发生错误折叠和聚集,稳定胞内蛋白构象,介导蛋白质到达目标细胞器的功能[26]。有研究报道生物体在受到外界寒冷和高温等刺激时,各组织细胞的热休克蛋白的表达都有不同程度的增加[27],大量表达的hsp60、hsp70和hsp90可增强细胞对热应激的耐受性,提高细胞的存活率,保护机体不受或少受损害[28]。因此在受到高温胁迫时理论上哲罗鱼各组织hsp60、hsp70和hsp90的表达量均应上升,但综合各组织表达结果发现,高温胁迫时在哲罗鱼的血液、心脏和脑中hsp60和hsp90基因较hsp70基因变化明显,二者均有部分时间点表达量显著高于对照组;而在肝脏中hsp60未有显著变化,hsp70和hsp90却显著低于对照组,推测高温胁迫肝脏先受到损伤,26 ℃已经超出了哲罗鱼的耐受能力,解剖发现肝脏发白,血清中ALP升高,说明高温使哲罗鱼肝脏受到严重损伤,失去了相应的调节功能,这与肝功能指标结果一致;此时血液、心脏和脑hsp60和hsp90表达量增加,做出相应的调节,以缓解鱼体对温度的不适。
本研究发现哲罗鱼在26.0 ℃维持不同时间血液生理生化指标变化过程及相关热应激蛋白基因在血液、心、脑和肝脏组织中的表达情况。高温时哲罗鱼体内供氧相关的红细胞和血红蛋白增加,维持鱼体耗氧;淋巴细胞上升,鱼体处于免疫状态,但非特异免疫的中性粒细胞和单核细胞功能受到抑制。肝功能指标显示ALP增高,肾功相关CREA-S含量表现先下降后上升的趋势,心脏功能的CK先下降、后上升,说明肝功能和肾功能在一定程度上受到一定损伤,心功能在26.0 ℃持续一段时间后得到恢复。由于肝受到损伤,已经失去了热休克蛋白调节功能,血液、心脏和脑中部分热应激蛋白表达量增加以缓解鱼体不适。本研究为哲罗鱼热应激机制相关研究及耐高温新品种培育提供理论依据。
