QbD理念在微球制剂开发中的应用
2021-04-06安广峰吕丕平
安广峰 吕丕平


摘 要 质量源于设计(QbD)是以合理的科学和质量风险管理为依据的,起始于预定的质量目标,注重对产品和工艺的理解以及对生产工艺过程控制的系统研发方法。作为一种特殊注射剂型,微球制剂具有给药方便,超长效缓释作用明显,毒副作用低,生物利用度高和患者依从性好等明显的临床优势,日益成为各大药企的新宠。但由于微球制备工艺复杂、中试放大困难等技术壁垒原因,仅有少数企业的产品落地。本文介绍了常用的微球制备方法,阐述了运用QbD理念进行微球研发的具体过程,为今后微球制剂的研发提供参考。
关键词 微球 质量源于设计 关键质量属性 关键工艺参数
中图分类号:R944.11; F406.3 文献标志码:A 文章编号:1006-1533(2021)05-0077-05
Application of quality by design in development of microsphere
AN Guangfeng*,LYU Piping
(Shanghai Jiyu Pharmaceutical Technology Co., Ltd., Shanghai 201203, China)
ABSTRACT Quality by design (QbD) is based on reasonable science and quality risk management, starting from a predetermined quality goal, focusing on the understanding of products and processes and the systematic research and development methods of production process control. As a complex drug delivery system, the microsphere formulation is becoming a new favorite of major pharmaceutical companies due to some obvious clinical advantages, such as more convenient administration, super long-term sustained release, lower toxic and adverse reactions, higher bioavailability and better patient compliance. However, only a few businesses drive related product landing because of some technical barriers, including but not limited to complicated preparation process and more difficulties in pilot scale-up. In this article, we introduce traditional preparation methods, explain the specific process using the QbD concept to develop microspheres, and provide guidance for the development of microsphere drug products in the future.
KEY WORDS microsphere; quality by design (QbD); critical quality attributes (CQAs); critical process parameters (CPPs)
微球(microsphere)是指将药物溶解或分散在天然或合成高分子材料中所形成的微小球状聚合物[1],粒径一般在1~250 mm[2],通过皮下或肌肉注射给药,通过载体表面释放、药物扩散、聚合物的溶蚀、降解等方式,实现药物的缓慢释放。
质量源于设计(QbD)是一个系统的药物开发方法,从预先确定的目标出发,基于科学和质量风险管理,把研究重点放在对产品和生产工艺的理解及控制策略上[3]。
本文以微球制剂为例,综述运用QbD理念进行微球制剂研发的具体过程。
1 微球制剂处方
微球药物主要由两部分组成:主药和生物可降解聚合物。生物可降解聚合物是指在水和酶作用下降解的高分子材料,已在長效注射剂领域得到广泛成功的应用。目前最常用的是聚乳酸(ploy lactic acid,PLA)、聚乳酸-羟基乙酸(poly lactic-co-glycolic acid,PLGA)等。该材料具有无毒、可生物降解、生物相容性较好等优点[4]。
2 微球制备工艺
目前,制备微球的方法有多种,根据所包裹药物的不同性质而采用不同的制备方法。已经可以工业化生产的方法包括热熔挤出法、乳化-溶剂挥发法、相分离法、喷雾干燥法等。
2.1 热熔挤出法
热熔挤出(hot melt extrusion,HME)技术是利用挤出机将API均匀分散于聚合物载体中的连续工艺[5],该工艺可用于微球制剂工艺[6],Watson Labs公司2000年使用该法上市了双羟萘酸曲普瑞林微球。尽管该技术工艺步骤少,可不使用溶剂,是一种可重复性的容易放大的连续制备工艺,但难以生产少量样品,对于价格昂贵的原辅料来说,前期研发投入很大。更重要的是,各物料加入顺序、时间、物料混合等容易导致批间一致性差,热熔使得热敏性药物稳定性差[7]。
2.2 乳化-溶剂挥发法
乳化-溶剂挥发法包括单乳法和复乳法。当包封疏水性药物时,采用水包油体系(O/W)进行单乳法制备,Johnson & Johnson公司在2003年使用单乳法上市了利培酮微球。当包封亲水性药物时,采用水包油包水体系(W1/O/W2)进行复乳法制备,而Takeda公司早在1989年使用复乳法上市了醋酸亮丙瑞林微球。该法可在较低的温度下进行,对药物活性保持较好,是近年来较为常用的微球制备方法。在乳液制备过程中,乳液粒径的控制非常重要,包括粒径的大小和均一性,膜乳化法[8]是业内较受欢迎的方法之一。
2.3 相分离法
相分离法又称溶剂-非溶剂法或凝聚法。在药物和高分子聚合物形成的有机溶液中,加入与聚合物不相容的溶剂或非溶剂,高分子聚合物由于溶解度降低发生相分离,将有机溶剂挥发出去,固化形成载药微球[9]。Novartis公司在1998年使用该法上市了醋酸奥曲肽微球。该方法操作简单,可实现连续化生产。但产品后处理困难,突释率较高,有机溶剂用量很大。
2.4 喷雾干燥法
包埋油溶性药物比较简单,将药物和高分子聚合物溶解在有机溶剂中,喷入惰性气流,使低沸点的有机溶剂迅速蒸发而成球。当包埋亲水性药物时,先将药物水溶液用超声或高速乳化器制备成W/O型乳液,再喷入惰性气流中制备微球[10]。Flexion公司在2017年使用该法上市了曲安奈德微球。该技术既适合热敏性药物又适合耐热性药物,可实现连续化生产。但获得的产品之间容易粘连,存在溶剂残留和水分较高,粒径不可控,均一性差[11]等问题。
3 QbD的基本要素
3.1 确定QTPP
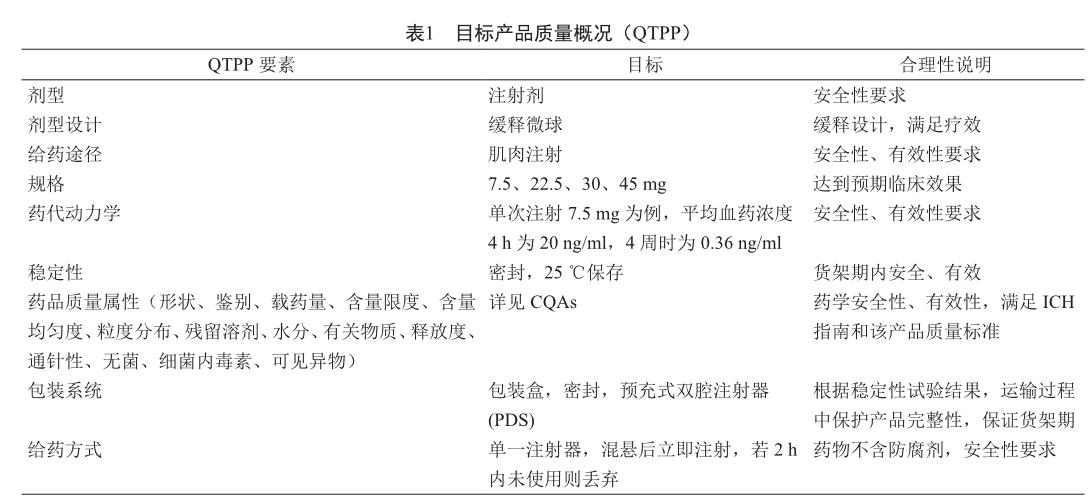
通过查阅部分文献[12-13],分析曲安奈德微球[14-15]、醋酸亮丙瑞林微球[16-17]、醋酸奥曲肽微球[18-19]的Label和Chemistry Review(s),以及中国药典2015版四部微粒制剂指导原则[2],运用“以终为始”的反向思维方式,对微球制剂的CQAs从理论上进行前瞻性的总结,定义了该类产品的QTPP,以醋酸亮丙瑞林微球为例,运用QbD的理念确定QTPP(表1)。
3.2 确定产品的CQAs
关键质量属性(critical quality attribute,CQA):指产品的物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布之内,以确保预期的产品质量[3]。参照国家食品药品监督管理总局注射用醋酸曲普瑞林进口药品注册标准(JX20160400),结合前文文献初步分析出微球制剂的CQAs(表2)。
3.3 风险评估:关键物料属性、工艺参数与产品CQAs
风险评估是质量管理风险中一个重要的、以科学为依据的过程,有助于确定哪些物料特性和工艺参数对产品的CQAs有影响。
在实施过程中,通常会借助试验设计等工具找出对CQAs有显著影响的物料属性和工艺参数,加深工艺理解,建立设计空间[20]。图1是参数关键性命名的决策树。
例如,鲍菲等[22]采用QbD理念对伊潘立酮微球的冻干工艺进行了优化,风险分析中明确了水分的残留会影响药物释放,二氯甲烷残留和有关物质影响药物安全性,需要进行严格控制。同时,指明了影响水分、二氯甲烷残留和有关物质的主要因素为一期和二期干燥温度,通过试验、借助软件分析,确定了冻干工艺参数。
3.4 确定设计空间
设计空间(design space)是指建立合理的工艺参数、质量和标准参数,在应用工艺参数及物料属性时,在设计空间内运行通常不被认为是变更,超出了设计空间就会被看作是变更。
首先,查阅文献资料,结合已有的知识、经验设计出一个知识空间。再通过风险分析、试验设计(DoE),找出变量对CQAs的影响,从而得到一个可靠的设计空间。然后进行与规模和设备无关的物料属性和工艺参数的调整[23-24]。工业界通常会进一步工艺研究,制定控制策略,确定出一个符合质量标准的控制空间。
例如,高飞等[25]应用QbD理念,对醋酸奥曲肽PLGA微球的冻干工艺进行了研究,使用JMP 10.0.0软件进行试验设计(DoE)和统计分析,找出了工艺参数和CQAs之间的关系,得到了该产品冻干工艺参数的设计空间。
3.5 定义控制策略
控制策略(control strategy):根据当前对产品和工艺的了解,为确保工艺性能和产品质量而计划进行的一系列控制。这些控制可包括与原料药以及制剂的材料和组分相关的参数和属性、设施和设备运行条件、过程控制、成品质量标准以及相关的监测和控制方法与频率[26]。
高飞等[25]在對醋酸奥曲肽PLGA微球的冻干工艺研究中,通过对冻干机板温、冻干时间、真空度的控制,来确保微球的有关物质、水分、溶剂残留达到目标要求。
3.6 产品生命周期管理与持续改进
生命周期(lifecycle):一个产品从开始研发到上市,直至产品终止的所有阶段[3]。在产品生命周期内,随着知识和经验的增加,对工艺和产品的认识不断加深,产品的质量也必将得到不断改进。
4 总结与展望
微球制剂长效缓释,可以大大提升患者用药的方便性、依从性,在临床上优势明显,是一种极具潜力的剂型。遗憾的是,由于注射用微球生产工艺复杂、释药行为难以控制、中试放大困难等技术壁垒原因,伴随研发成本高、开发周期长等特点,国内成功上市的的产品较少。QbD是基于科学的风险评估和试验设计来识别关键物料属性和关键质量属性,将QbD理念应用到微球制剂的研发过程中,将有助于加快该领域的产品落地,会起到很好的指导作用。目前QbD在微球制剂研发中的应用尚不全面,例如各国药典中均缺乏相关指导原则,由于微球制剂的释药周期长,体外加速释放与长期释放的相关性,以及体内外相关性的研究仍是质控的难点,有待我们进一步研究。随着科学技术的进步,新方法、新技术不断被应用到微球领域,这些问题都将得到解决,也必会有更多的微球药物在临床上得到应用。
参考文献
[1] Wang YJ, Sun XZ, Xu L, et al. Research progress and prospect of microsphere product[J]. Biol Chem Eng, 2017, 3(2): 80-83.
[2] 国家药典委员会. 中华人民共和国药典2015年版四部[M]. 北京: 中国医药科技出版社, 2015: 370-371.
[3] ICH. Pharmaceutical Development Q8(R2) [EB/OL]. [2020-04-12]. https: //database.ich.org/sites/default/files/Q8_R2_ Guideline.pdf.
[4] 顾书英, 詹辉, 任杰. 聚乳酸/PBAT共混物的制备及其性能研究[J]. 中国塑料, 2006, 20(10): 39-42.
[5] 杨高品. 热熔挤出技术在制药领域的应用[J]. 流程工业, 2017(24): 55-60.
[6] 赵转霞, 符雯, 刘哲鹏, 等. 热熔法制备曲普瑞林长效生物可降解微粒处方工艺的研究[J]. 中国现代应用药学, 2016, 33(12): 1533-1538.
[7] 杨硕, 王立, 张文君, 等. 热熔挤出技术在药物制剂中的应用进展[J]. 药学研究, 2017, 36(11): 664-666.
[8] Li X, Wei Y, Lv P, et al. Preparation of ropivacaine loaded PLGA microspheres as controlled-release system with narrow size distribution and high loading efficiency[J]. Colloids and Surfaces A: Physicochem Eng Aspects, 2019: 237-246.
[9] Awwad S, Day RM, Khaw PT, et al. Sustained release ophthalmic dexamethasone: in vitro in vivo correlations derived from the PK-Eye[J]. Int J Pharm, 2017, 522(1): 119-127.
[10] Wan F, Yang MS. Design of PLGA-based depot delivery systems for biopharmaceuticals prepared by spray drying[J]. Int J Pharm, 2016, 498(1/2): 82-95.
[11] 吕丕平, 王玉霞, 崔一民, 等. 蛋白类药物缓释微球制剂的研究进展[J]. 临床药物治疗杂志, 2015, 13(3): 5-9.
[12] 刘承. D008缓释微球的研究[D]. 武汉: 武汉工业大学, 2017.
[13] 李瑶瑶, 余飞, 薛英, 等. LC-MS/MS法测定曲普瑞林微球的酰化杂质[J]. 烟台大学学报(自然科学与工程版), 2018, 31(4): 304-310.
[14] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 208845 [EB/OL]. [2020-04-12]. https:// www.accessdata.fda.gov/drugsatfda_docs/label/2017/ 208845s000lbl.pdf.
[15] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 208845 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/2017/208845Orig1s0 00ChemRedt.pdf.
[16] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/label/2019/020517s042, 019732s044lbl.pdf.
[17] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/2005/019732_S029_ Lupron%20Depot_APPROVAL%20PACKAGE.pdf.
[18] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 021008[EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/label/1998/21008lbl.pdf.
[19] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 021008[EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/98/021008a_chemr. pdf.
[20] Zhang L, Mao S. Application of quality by design in the current drug development[J]. Asian J Pharm Sci, 2017, 12(1): 1-8.
[21] PDA. PDA technical report No. 60 (TR60). Process validation: a lifecycle approach [EB/OL]. [2020-04-12]. https://www.pda.org/bookstore/product-detail/1931-tr-60-process-validation.
[22] 鲍菲, 孙翠香, 高飞, 等. 基于QbD理念优化伊潘立酮微球的冻干工艺[J]. 食品与药品, 2018, 20(2): 97-101.
[23] Li J, Qiao Y, Wu Z. Nanosystem trends in drug delivery using quality-by-design concept[J]. J Controlled Release, 2017, 256: 9-18.
[24] Van Heugten AJP, Vromans H. Scale up of semisolid dosage forms manufacturing based on process understanding: from lab to industrial scale[J]. AAPS Pharm Sci Tech, 2018, 19(5): 2330-2334.
[25] 高飞, 安广峰, 鲍菲, 等. 基于QbD理念研究醋酸奥曲肽PLGA微球的冻干工藝[J]. 食品与药品, 2017, 19(1): 7-12.
[26] ICH. Pharmaceutical Quality System Q10[EB/OL]. https:// database.ich.org/sites/default/files/Q10_Guideline.pdf.
