矮牵牛新种质的花色表型及花色素分析
2021-04-06李雅琪刘心怡过雪莹潘俊松唐东芹
李雅琪,刘心怡,过雪莹,潘俊松,唐东芹*
(1. 上海交通大学设计学院,上海 200240;2. 上海交通大学农业与生物学院,上海 200240)
矮牵牛(Petunia hybrida)是茄科碧冬茄属植物,由于观赏效果好、易栽培、适应性强且抗性佳,世界各地广泛种植[1]。矮牵牛是世界上使用最广、销售量最大的盆花和花坛植物之一,被誉为“世界花坛花卉之王”和“花坛皇后”[2],常用于花境、花坛、立体景观、花槽、盆栽、阳台、窗台和居室装饰。在中国,作为花坛后起之秀,矮牵牛的需求越来越大[3]。
花色是包括矮牵牛在内的众多观赏植物的重要性状。长期以来,观赏植物育种的重要目标之一是培育色彩缤纷的新品种,科学量化的花色描述对育种子代的筛选、新品种的鉴定和保护等均具有重要意义[4]。如在金银花[5]、菊花[6]、鸢尾[7]等观赏植物中,基于花色特性的研究可以为其品种的界定与分类提供良好参考和理论依据。花色表型的描述目前较为客观的测色方法有比色卡比色和仪器测色,在目测的基础上结合比色卡,对于常规的花色分类和描述已经足够。而要获得更为科学的定量数据,则需要在定性分析花色后,进一步结合使用仪器测色[8],从而使花色的表型描述更加可靠。更深入的研究表明,植物花色与花色素的种类和含量密切相关,且已经证实,植物花色素主要分为类黄酮、类胡萝卜素和生物碱三类,其中类黄酮和类胡萝卜素广泛分布于各种植物中,而生物碱类色素主要为甜菜碱,其只存在于石竹目植物中,不能与类黄酮化合物共存[9—11]。花色也是矮牵牛的重要观赏性状和育种目标,每年都有不同花色的新品种产生以适应市场需求。对花色进行科学描述,并分析影响花色呈现的色素种类及含量对矮牵牛的育种实践和推广应用有重要意义。目前对矮牵牛花色和花色素的定量研究并不多见,实践和现有文献描述矮牵牛花色时多采用最简单的目测法,如杨翅春等[12]在观察矮牵牛花色表型时用紫色、白色和浅紫色描述;也有研究对矮牵牛进行了初步的花色素类型鉴定和含量的测定,但仅测定了花色苷的含量[13—14],从花色素类型及含量上来看并不能全面反映影响矮牵牛花色丰富的呈色原因。
本研究以上海交通大学自育的 27个矮牵牛新种质为研究材料,用英国皇家园艺学会比色卡(Royal Horticultural Society Color Chart,RHSCC)和色差仪描述了矮牵牛花色表型,通过特征显色反应初步判断矮牵牛的花色素类型,进一步用标准曲线法和 pH示差法等方法测定典型矮牵牛品种中花色素的含量,对矮牵牛花色表型及花色素种类、含量进行较为系统的分析研究,为后续量化评价矮牵牛花色、新品种鉴定与分类以及基于花色的育种工作等提供科学依据。
1 材料与方法
1.1 材料
本研究所用的 27个矮牵牛材料是上海交通大学花卉课题组培育的品种或组合,均为杂交F1代,其组合编号和品种名见表1,其中浦江系列品种为上海市认定品种。

表1 矮牵牛的组合编号与品种名Table 1 Combination numbers and cultivar names of Petunia hybrida
1.2 方法
在晴天的上午,从上海交通大学七宝校区矮牵牛课题组基地采集材料。从各个矮牵牛种质的多个植株上随机采集盛花期花朵若干,立即带回室内拍摄花朵照片和测定花色表型,其余材料放入4 ℃冰箱保存,用于花色素定性和定量分析。
1.2.1 矮牵牛花色表型的测定
用比色卡比色和色差仪测色法分别描述各种质的花色表型。在无阳光直射处将每个种质的花瓣颜色与 RHSCC对比,记录最接近颜色的代码作为该种质花色 RHSCC编号。用每个种质的花瓣中间部分对准色差仪(SC-10手持式色差仪,深圳市三恩驰科技有限公司)的集光孔测量花色的亮度 L*值、红绿色度a*值和黄青色度b*值,重复测定10次,并计算花色的彩度C*值和色相角h值。
1.2.2 矮牵牛花色素类型的定性测试
将矮牵牛新鲜花朵去除花冠筒,称取0.10 g花冠放入研钵中,加入5 mL石油醚、10%盐酸和25~28%氨水,快速研成匀浆,过滤后观察液体颜色[15],每份材料重复3次,记录并拍照。根据特征显色反应显色情况判断花瓣中是否含有类胡萝卜素和类黄酮两类色素,比较不同色系矮牵牛所含花色素类型的异同。
1.2.3 矮牵牛花色素含量的测定
结合特征显色反应结果和矮牵牛的生长表现,选出后续测定花瓣中类胡萝卜素、类黄酮和花色苷三类色素含量的矮牵牛代表种质。测定花色素含量时设置3个生物学重复,取3次测量的平均值作为最终含量。
根据电泳的定量结果,使用QuantiFluor™-ST蓝色荧光定量系统对PCR产物进行检测定量,之后根据样本的测序量要求进行相应比例的混合。
花瓣类胡萝卜素的提取和含量测定参考任玉锋等和甘林鑫等的方法[16—17]。花瓣类黄酮和花色苷的提取参考段晶晶的方法[18]略有改动。采用标准曲线法测定矮牵牛花瓣中类黄酮含量[18]。采用 pH示差法测定矮牵牛花瓣中花色苷含量[19—20]。
1.2.4 数据统计分析
使用Microsoft Excel软件处理矮牵牛花色和花色素含量数据,使用IBM SPSS Statistics软件分析矮牵牛3类花色素含量的差异显著性,使用Origin 2021b软件进行线性拟合,并绘制Rutin标准曲线、矮牵牛花色分布及3类花色素含量图。
2 结果与分析
2.1 矮牵牛花色表型
根据目测法与RSHCC比色,将27个矮牵牛种质的花色分别归为5个色系:紫色系、紫红色系、红色系、黄色系和白色系(图1,表2)。统计后发现,所测矮牵牛种质中,花色以紫红色和红色为主,分别包含11和10个种质,而白色、紫色和黄色较少,分别只有3、2和1个种质。

图1 27个矮牵牛种质的花部表型Fig. 1 The flower phenotype of 27 petunia germplasms

表2 矮牵牛花色色系划分Table 2 Division of the petunia flower color
27个矮牵牛种质RHSCC比色和色差仪测色的统计结果见表3,表中每个种质的花色L*、a*、b*、C*和h值分别为10次测量结果的平均值。
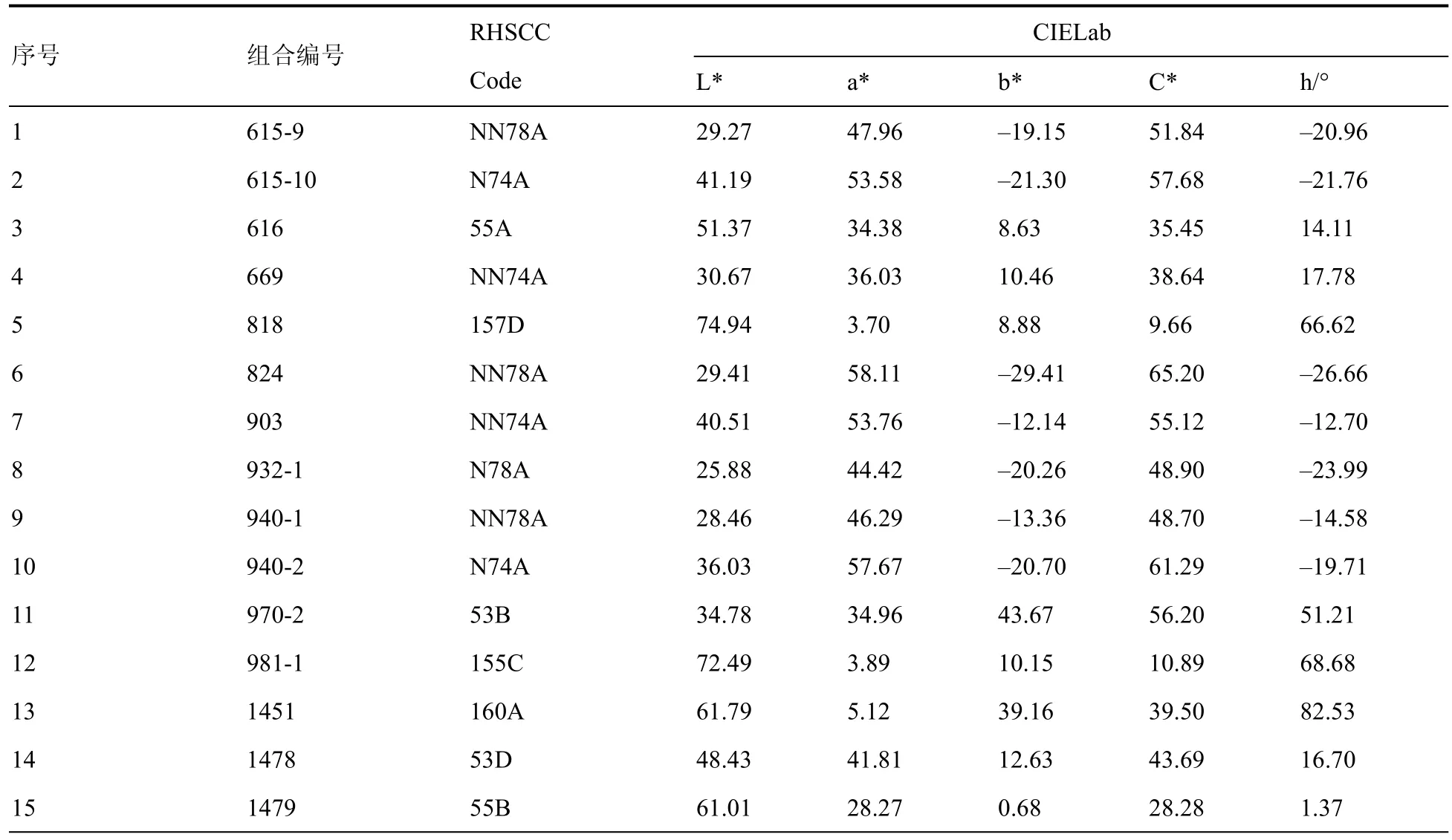
表3 27个矮牵牛种质的花色测定结果Table 3 Flower color determination of 27 petunia germplasms
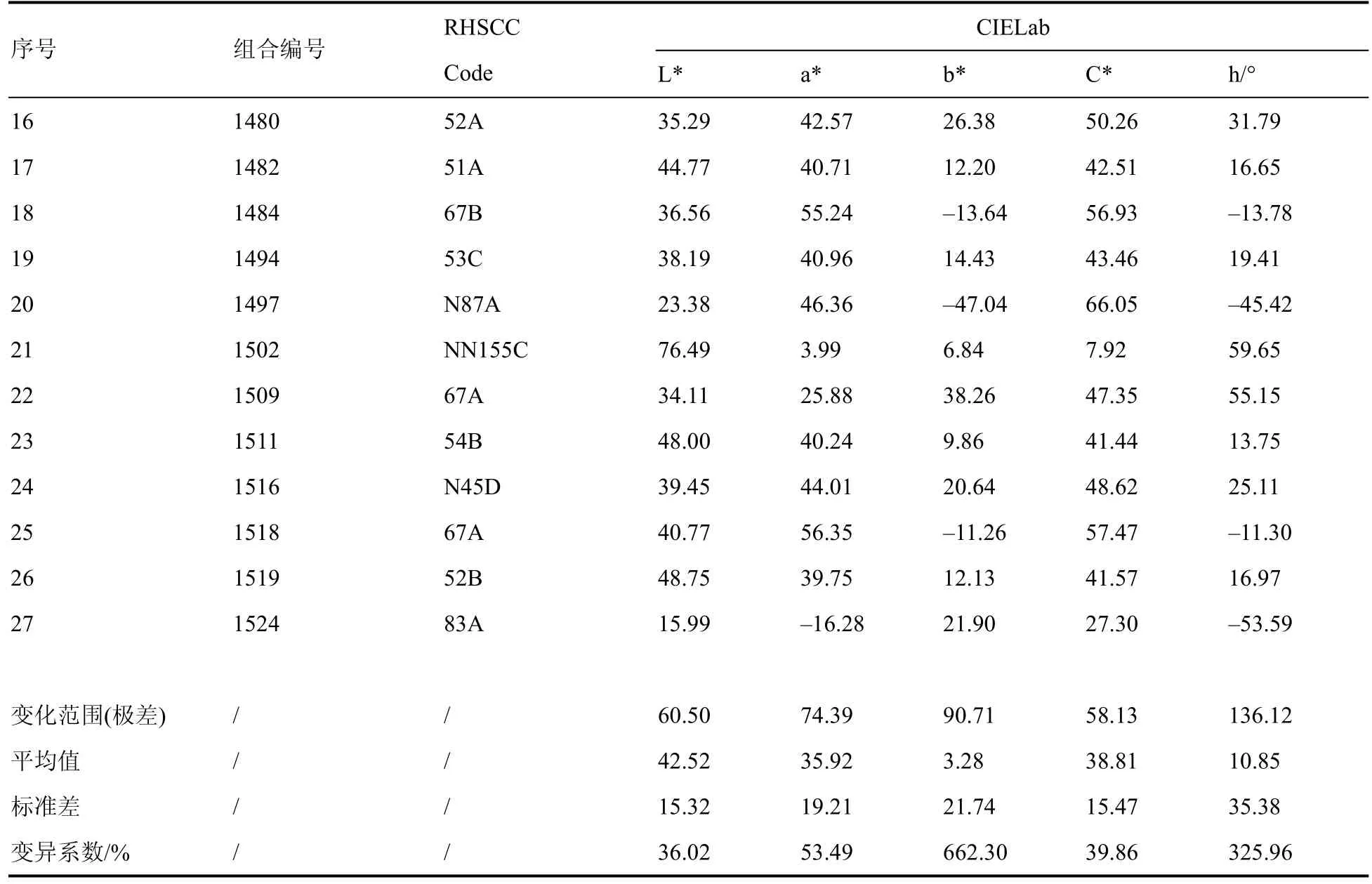
(续表)
由表3可知,矮牵牛的花色在CIELab表色系统中分布较广,5个色系的样本在花色参数上数值存在明显的规律。统计27个种质的花色L*、a*、b*、C*和 h值的变化范围(极差)、平均值、标准差和变异系数,(表3)。从变异系数上来看,b*和h值高达662.30%和325.96%,远远大于L*、a*和C*值的变异系数(<55%),可见矮牵牛花色在b*和h值的变化远比L*、a*和C*值丰富。
按色系绘制矮牵牛花色 L*、a*与 b*值的分布图,如图2所示。5个色系中,白色系花色亮度(L*)最高,其次为黄色系、红色系、紫红色系,亮度最低的是紫色系。花色红绿色度(a*)从高到低依次为紫红色系、红色系、紫色系、黄色系和白色系,说明按照该顺序这些色系花色中的红色减少、绿色增加,除紫色系外其余4个色系的花色均偏红,紫色系花色 a*值变化大。花色黄青色度(b*)最高是黄色系,然后依次为红色系、白色系、紫色系和紫红色系,说明这些色系花色中的黄色依次减少、而蓝色增加,因此黄色系、红色系和白色系的花色偏黄,紫红色系的花色偏蓝,但紫色系各种质间的花色b*值变化大,其中有2个种质与其他种质b*值差异较大,此外,红色系中也有1个种质与其他种质差异较大。
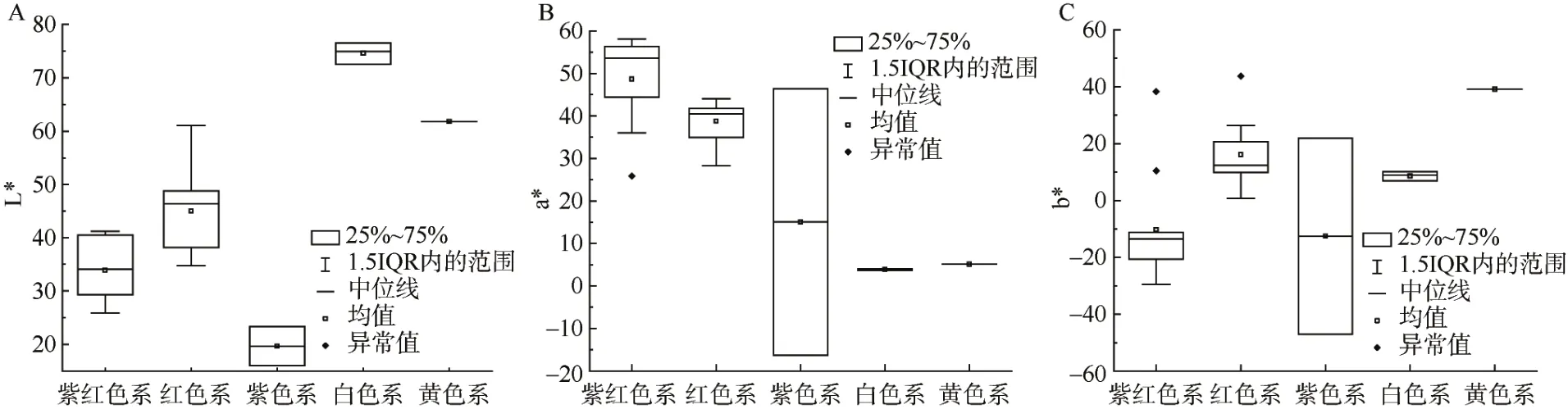
图2 5个矮牵牛色系的花色L*、a*和b*值分布图Fig. 2 Distribution of L*,a* and b* values of flower color in five series of Petunia hybrida
27个种质的花色 a*与 b*值的二维分布图见图3。矮牵牛花色分布比较广泛,在第一、二和四象限均有分布。5个色系的 a*、b*值区分比较明显,红色系和紫红色系之间相互有少量重叠部分。白色系分布最集中,红色系其次,紫红色系分布大多数比较集中,只有2个种质分散在红色系中,紫色系分布最分散。红色系和白色系只分布在第一象限,紫红色系分布在第一和四象限而且集中分布在第四象限,紫色系分布在第二和四象限。
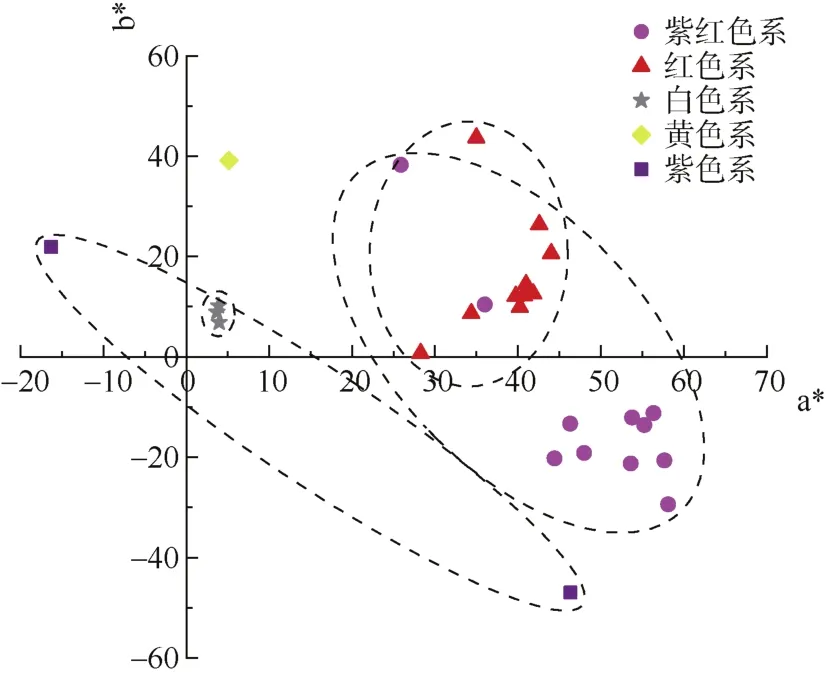
图3 27个矮牵牛种质的花色a*与b*值二维分布图Fig. 3 Two dimensional distribution of flower color a* and b* values of 27 petunia germplasms
27个矮牵牛种质的花色 L*、a*与 b*值的三维分布图见图4。可以直观地看出,矮牵牛花色分布较为分散,不同色系花色差异较大。坐标系中从L*轴顶部到底部依次为白色系、黄色系、红色系、紫红色系和紫色系,说明花色越浅亮度越高。
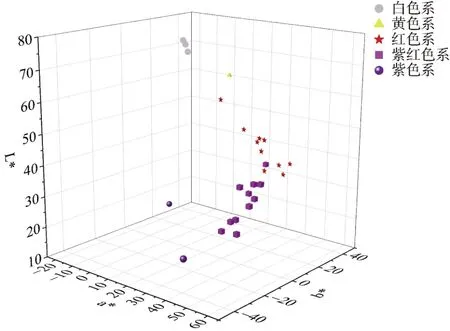
图4 27个矮牵牛种质的花色CIEL*a*b*分布图Fig. 4 CIEL*a*b* distribution of 27 petunia flower
2.2 矮牵牛花色素类型的鉴定
通过特征显色反应初步确定矮牵牛花瓣中所含的色素种类,结果如表4。
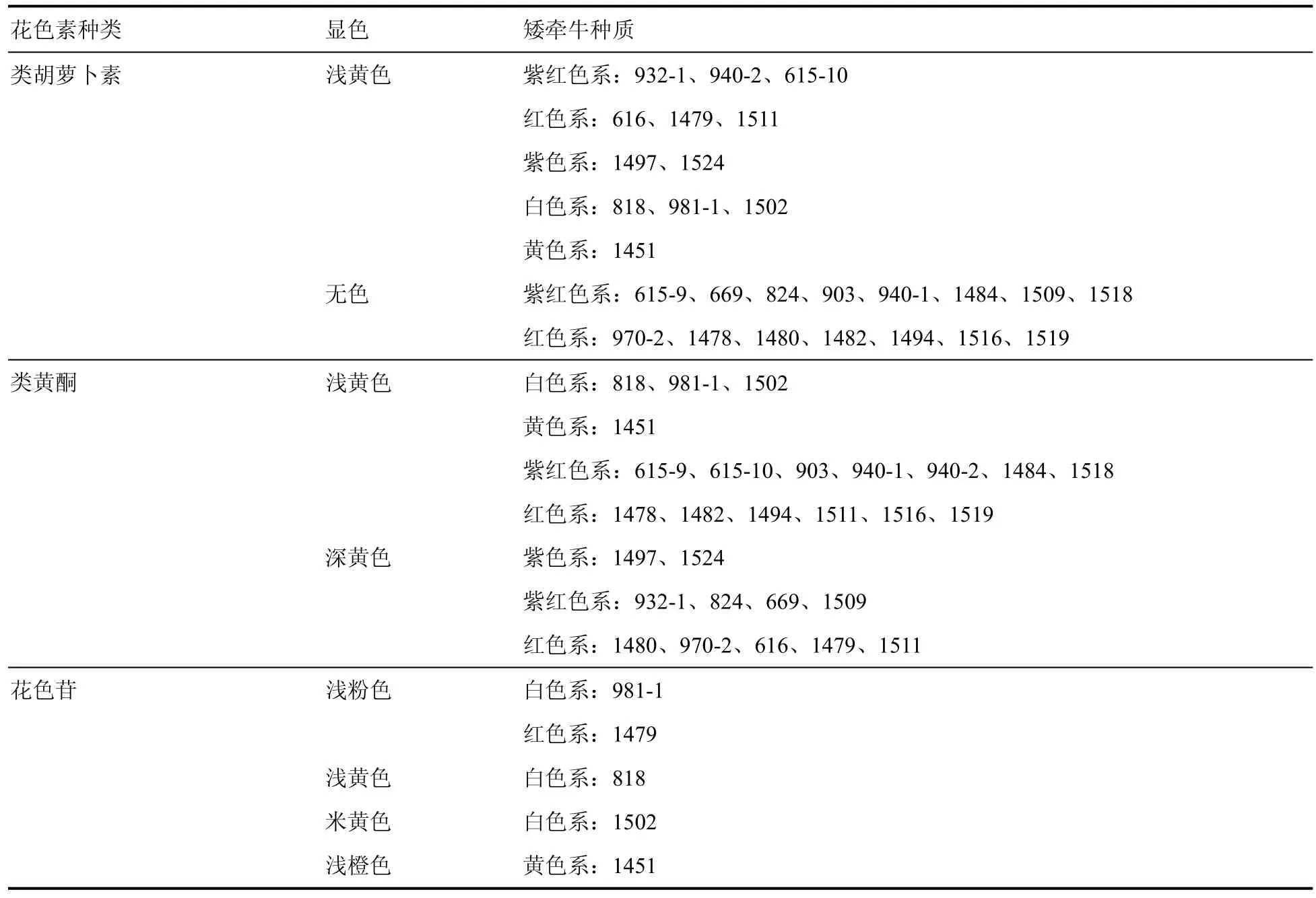
表4 27个矮牵牛种质的类胡萝卜素、类黄酮及花色苷显色反应Table 4 Carotenoids、flavonoids and anthocyanins color reaction of 27 Petunia hybrida germplasms
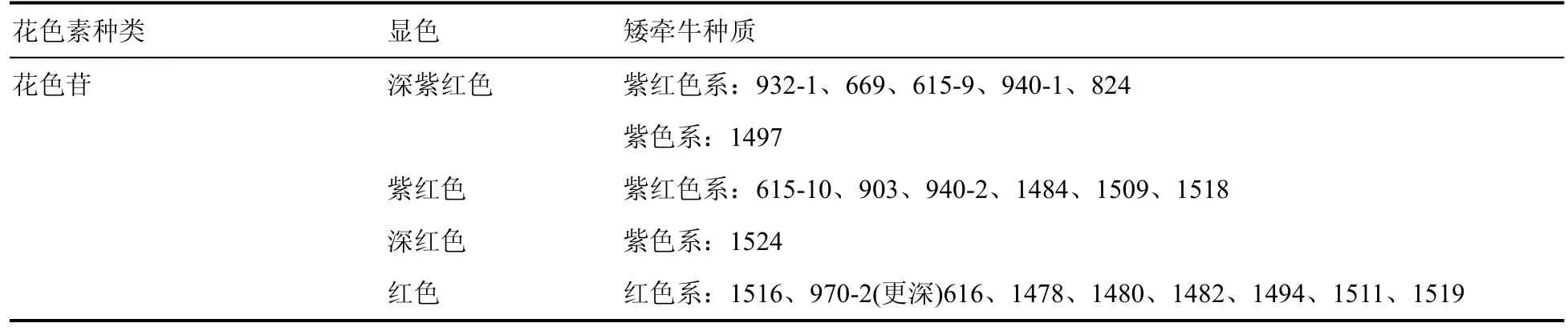
(续表)
在类胡萝卜素特征显色反应中,27个矮牵牛种质表现出无色或浅黄色。其中,紫色系、白色系和黄色系种质均表现为浅黄色,说明这3个色系花瓣可能含有少量类胡萝卜素;紫红色系和红色系15个呈无色,说明这些种质花瓣中不含或含极少胡萝卜素;还有6个种质显现浅黄色,可能含有少量类胡萝卜素(表4)。
从类黄酮特征显色反应结果可以发现,27个矮牵牛种质均表现为不同深浅的黄色,说明其花瓣中均都含有类黄酮成分。其中,白色系和黄色系种质均显浅黄色,紫色系种质均显深黄色,紫红色系和红色系中则深浅黄色均有(表4)。可见,不同种质花瓣所含类黄酮的种类或含量可能不同,从而影响其花色呈现。
花色苷特征显色反应表明,白色系和黄色系种质均呈浅色,说明它们含有极少量花色苷;紫红色系和紫色系种质均呈深色,说明其花瓣中应该都含有花色苷;红色系除了一个种质(1479)呈浅色之外其余均呈深色,可见红色系种质绝大多数含有花色苷(表4)。各个种质显现的颜色不同,意味着其花瓣所含花色苷的种类或含量可能不同。
综上,在5个矮牵牛色系中,白色系和黄色系花瓣中含有类黄酮、少量类胡萝卜素(浅黄色)和极少量花色苷(浅色);紫红色系和绝大多数红色系种质花瓣中含有类黄酮和花色苷,多数不含或含极少量(无色)类胡萝卜素;紫色系花瓣中含有类黄酮、花色苷和少量类胡萝卜素。
2.3 矮牵牛花瓣中花色素含量分析
2.3.1 类胡萝卜素
根据显色情况,从显色的各色系中选取生长表现较好的典型种质进行类胡萝卜素含量测定,分别包括紫色系、白色系和黄色系各1个,紫红色系和红色系中各2个,共7个种质,其组合编号及花瓣类胡萝卜素含量如图5所示。测定结果表明:7个种质的花瓣类胡萝卜素含量在 0.004~0.216 mg·g-1FW之间,多数在0.02 mg·g-1FW左右,整体看含量均在较低水平。比较不同矮牵牛种质的花瓣类胡萝卜素含量,发现种质之间的差异很大。7个被测种质中,最高值在红色系种质1511中检测到,相当于含量最低种质(1502,白色)的52.8倍,其余5个种质的含量均低于0.03 mg·g-1FW。
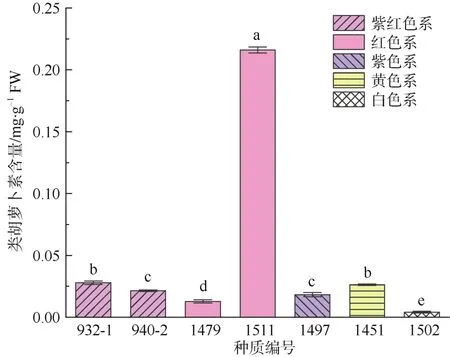
图5 7个矮牵牛种质的花瓣类胡萝卜素含量Fig. 5 Carotenoid content in petals of 7 Petunia hybrida germplasms
2.3.2 类黄酮
根据显色情况结合生长状况,选取了13个矮牵牛代表种质进行花瓣类黄酮含量的测定。以槲皮素3-O-芸香糖苷(Quercetin 3-O-rutinoside,简称Rutin)标准溶液浓度(C)为x轴、波长350 nm下吸光度值(A)为y轴绘制的标准曲线,其R2值达到统计学要求,因此,用于样品中类黄酮含量的计算。
矮牵牛花瓣类黄酮含量结果如图6所示,13个种质的花瓣中类黄酮含量在2.5~12.2 mg·g-1FW之间,绝对值均远远大于类胡萝卜素含量,可见这些种质花瓣中均含有较高的类黄酮。但比较发现,其含量高低与显色反应中颜色深浅程度并没有直接对应关系,这可能与花瓣中类黄酮种类如花色苷有关。类黄酮含量在不同种质间的差异明显,13个被测种质中,含量最高的种质(1451)是最低种质(1511)的近5倍。从色系来看,黄色系类黄酮含量最高,紫色系和白色系其次,除白色 1502外,含量均在10 mg·g-1FW 左右;紫红色系 2个种质在 4.2~5.1 mg·g-1FW 之间,而红色系最低,多数低于3 mg·g-1FW。
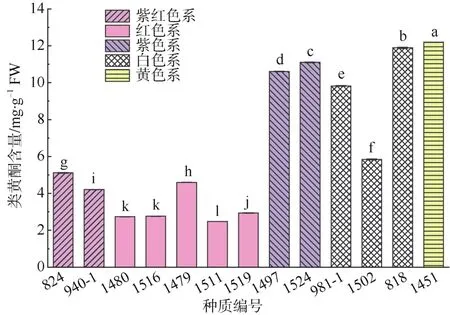
图6 13个矮牵牛种质的花瓣类黄酮含量Fig. 6 Flavonoid content in petals of 13 Petunia hybrida germplasms
2.3.3 花色苷
作为一类重要的类黄酮物质,花色苷对花色的呈现非常重要。因此,进一步对上述13个含有类黄酮的代表种质花瓣中的花色苷含量进行了测定分析(图7)。结果显示,13个种质的花瓣中均检测到花色苷,含量在0.08~3.88 mg·g-1FW之间,种质间差异非常显著。13个被测种质中,花瓣花色苷含量最高的是紫色系种质1524,最低的是红色系1511,两者相差达50多倍。比较5个色系的花瓣花色苷含量,发现紫色系2个种质和紫红色系2个种质的花色苷含量均在较高水平,高于1 mg·g-1FW,显著高于红色系、白色系和黄色系;其中,白色系和黄色系 4个种质色苷含量水平相当,均在0.2 mg·g-1FW左右;红色系种质之间差异较大,其含量范围为 0.08~0.67 mg·g-1FW。

图7 13个矮牵牛种质的花瓣花色苷含量Fig. 7 Anthocyanin content in petals of 13 Petunia hybrida germplasms
3 讨论
花色是很多园林植物(尤其是花卉)最为重要的观赏性状,传统上对花色的评价多用主观的目测法,包括前期关于矮牵牛的花色表型描述[12,14,21]。但是,由于颜色分类标准很多且人的视觉存在差异[4],该法对花色的判定受主观性影响较大而不尽准确。本研究采用 RHSCC比色和色差仪测色这两种较为客观的方法对矮牵牛花色表型进行系统描述,在定性描述花色的基础上,进一步用CIELab系统对其花色进行数量化描述,基于数据建立更为科学的花色表型描述。通过唯一的RHSCC编号结合CIELab数值,既能直观反映花色,又能将其科学量化,从而更为全面地描述矮牵牛的花色情况,为后续品种评价、鉴定以及新品种选育提供良好的科学依据。上述27个矮牵牛种质花色以紫红色和红色为主,紫色、白色和黄色较少,而且均为纯色、单瓣种质,这与目前国内外市场上的品种花色分布大致一样[2],今后可往稀少或暂未出现的花色、复色和重瓣方向培育更好的优良种质,为市场提供更多选择,营造更为优美的园林景观。
植物的花色主要受到类黄酮、类胡萝卜素、甜菜素等3种色素的影响,为了更好地了解矮牵牛花色形成的生理基础,有必要对其色素种类及含量进行系统分析。特征显色反应是一种常用的判断色素类型的快速定性方法,在小苍兰、蜡梅、月季和杜鹃等花色素种类定性分析时都用到这种方法[22—25]。分析表明,矮牵牛27个种质花瓣中的花色素主要是类黄酮和类胡萝卜素两大类,这与梁娴和罗充的研究一致[13]。而利用显色深浅推测花色素含量,即颜色越深说明花瓣花色苷含量越高[13],本文的色素含量定量分析显示这种简单的判断并不够科学。
初步确定花色素类型后,选择了部分典型种质分别测定了矮牵牛中3类花色素的含量。类胡萝卜素是一类在自然界中广泛分布的黄色、橙色和红色色素[26]。在7个含有类胡萝卜素的矮牵牛种质中,只在一个红色种质检测到较高含量,整体水平均很低,这与显色反应中显现的黄色很浅的现象是相符的。因此,定性测试和定量测定都证明了矮牵牛花瓣中类胡萝卜素含量较少,可见该色素对矮牵牛花瓣呈色的影响应该非常有限。比较13个矮牵牛种质花瓣中的类黄酮含量,发现这些种质花瓣中均含有较高的类黄酮,且绝对值均远远大于类胡萝卜素含量,推测矮牵牛花瓣呈色主要受到类黄酮的影响。类黄酮含量在不同种质间的差异明显,其中黄色系类黄酮含量最高,紫色系和白色系其次,而紫红色系和红色系相对来说最低。作为一类重要的类黄酮,花色苷类色素对花色的呈现作用非常重要,是大多数花色形成的重要组成色素,广泛存在于超过90%的被子植物中[27]。测定结果表明:13个种质的花瓣中均检测到含有花色苷,其中紫色系和紫红色系的花色苷含量显著高于白色系和黄色系,红色系则变化较大,可见紫色和紫红色矮牵牛花瓣的呈色与花色苷密切相关,其花色苷含量占类黄酮总含量的16.7%~54.7%,尤其是紫红色种质940-1,其花色苷占比达一半以上;而白色系和黄色系类黄酮含量普遍较高,但花色苷占比则不到4%,说明主要是其它类别的类黄酮物质在起作用。类似的结果在香雪兰[28]和风信子[29]中也有报道,黄色和白色品种里没有检测到花色苷,而在紫红色品种中则有高含量的花色苷存在于花瓣中,对其呈色起到重要作用。
矮牵牛花色的呈现受到不同色素的影响,紫色系和紫红色系主要受到类黄酮尤其是花色苷的影响,红色系花色呈现由类黄酮和类胡萝卜素共同作用,而白色系和黄色系的花色呈现则主要受花色苷以外的类黄酮物质影响。以上结果为后续从生理和分子角度揭示矮牵牛花色形成机理和指导育种实践奠定了良好基础。
