常量法和微量法测定蛋白质含量综合性实验设计
2021-04-06赵玉荣陈翠霞张黎民李幸凡王文鑫
赵玉荣,陈翠霞,张黎民,李幸凡,王文鑫
(中国石油大学(华东) 化学工程学院,山东 青岛 266580)
实验教学在化学和生物学科教学中承担着不可替代的作用,是学生从事科研工作的基础。综合性设计实验有利于将传统的实验教学“以教师为中心”的模式转变为“以学生为中心”的模式。综合实验的开展有助于提高学生查阅文献和归纳总结的能力,是提高学生创新能力的重要途径之一[1-2]。蛋白质是组成人体细胞的基本成分,机体的重要生命活动都需要蛋白质的参与,它是生命活动的主要承担者[3-4]。蛋白质测定是指通过物理或化学方法对蛋白质含量进行测定,是生物化学和分子生物学研究中最常用的基本分析方法之一。测定蛋白质含量的方法包括凯氏定氮法、双缩脲法、酚试剂法、紫外吸收法和考马斯亮蓝法(Bradford 法)等。其中,Bradford 法因具有灵敏度高、测定快速简便和干扰物少等优点备受关注[5-11]。基于Bradford 法测定蛋白质含量的实验是生物化学本科教学实验的重要组成部分,但实验一般基于一种方法进行,往往导致两方面问题:一方面,学生不能很好地掌握常量法和微量法的区别;另一方面,单一仪器的应用很难解决多分组实验拥挤等资源紧张的问题。基于此,本文设计了利用紫外分光光度计(常量法)和多功能酶标仪(微量法)同时进行蛋白质含量测定的综合性实验。这种方法是根据蛋白质与染料相结合时产生复合物导致染料的颜色发生变化的原理设计的,如图1 所示。
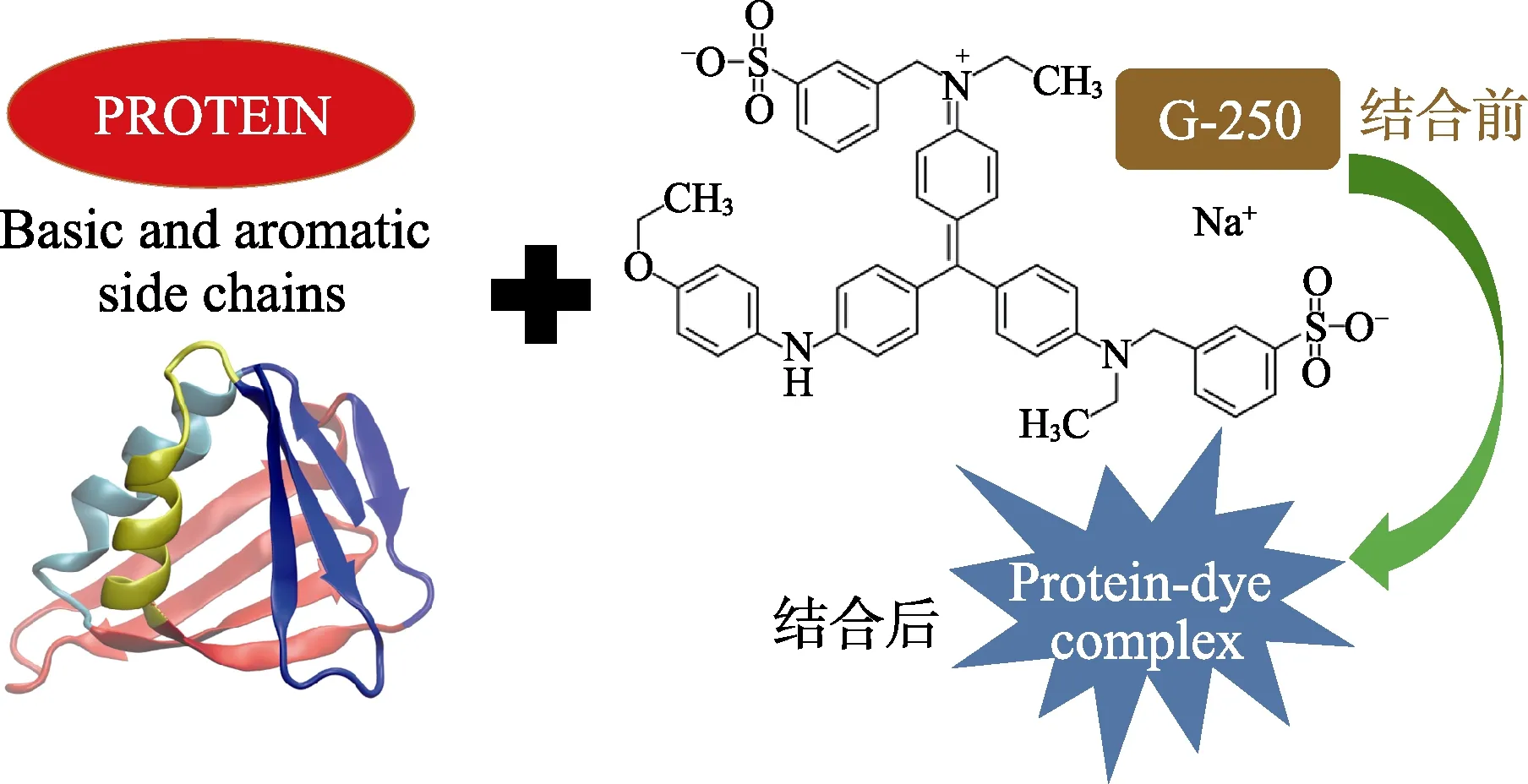
图1 Bradford 法测定蛋白质含量的原理示意图
染料考马斯亮兰G-250(二甲花青亮蓝)的磷酸溶液呈棕红色,最大吸收峰在465 nm,在酸性条件下其可与蛋白质中的精氨酸和芳香氨基酸结合,形成复合物时,溶液呈现浅蓝色,导致染料的最大吸收峰的位置变为595 nm。在一定范围内,595 nm 处测定的吸光度值A595与蛋白质含量呈线性关系,因此可以用于蛋白质含量的测定[5-11]。
紫外分光光度计[12]和多功能酶标仪[13-15]都是测量吸光度的仪器,但原理存在一定差异。紫外分光光度计在测量过程中可以通过设置特定波长的单色光直接作用于样品(见图2(a)),进而测得其在特定波长的吸光度;而多功能酶标仪则首先通过一定波段的滤光片获得目标波段,经过光路改变器改变入射光的方向,从顶部垂直照射在样品上(见图2(b)),进而测得样品的吸光度。另外,两种测量方法使用的样品池不同,紫外分光光度计测定吸光度一般用常量石英比色皿样品池,而多功能酶标仪则使用微量孔板(如96 孔板或384 孔板),使用移液枪将样品转移到孔板中。由于测量样品的体积不同,上述两种方法分别被称为常量法和微量法。相比于紫外分光光度计,多功能酶标仪根据用途的特殊性限定了范围和设置界面,快速且简便。同时,多功能酶标仪可同时在短时间内检测几十组样品,工作效率大大提高,这可保证不同样品在相同静置时间和仪器状态下进行测定。
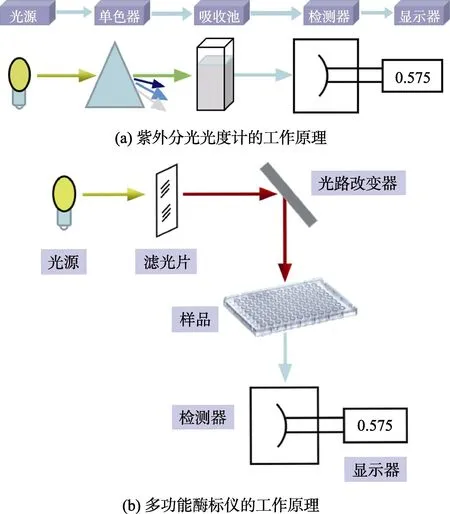
图2 紫外分光光度计和多功能酶标仪的工作原理
本实验首先配制了不同浓度的蛋白溶液并进行了吸光度测定,在此基础上绘制标准曲线方程,随后对未知样品进行测定,将其吸光度值代入标准曲线方程即可求得未知样品中的蛋白含量。在此基础上,考察了SDS 对蛋白质含量测定的影响并分析了原因。实验中,将学生分为两组,在测量蛋白质含量和SDS 干扰时仅选择一种仪器进行试验即可。这样,每组学生均可使用两种仪器进行吸光度测定,有助于拓宽学生的知识面。
本实验同时利用紫外分光光度计和多功能酶标仪开展实验,一方面,有助于学生同时掌握常量法和微量法测定蛋白质含量,了解上述两种仪器工作原理、操作流程和使用方法,为今后从事科研工作奠定基础。另一方面,由于多功能酶标仪和紫外分光光度计的配合使用,将大大提高多分组实验的测量效率,同时有助于学生学习和使用移液枪等常用工具,非常适合作为综合性实验向本科生开设。
1 实验部分
1.1 实验目的
(1)掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法。
(2)熟练紫外分光光度计和多功能酶标仪的使用和操作方法。
(3)了解紫外分光光度计和酶标仪测量方法的异同点。
1.2 实验药品与实验仪器
实验药品:牛血清蛋白BSA(纯度98%,Sigma);考马斯亮蓝G-250(99.9%,Sigma);乙醇(99%,上海国药);85%的磷酸溶液(上海国药);SDS(98%,Sigma)。
实验仪器:紫外光分光光度计/多功能酶标仪;漩涡混合器;容量瓶;量筒;电子分析天平;EP 管/96孔板;试管架;移液枪;一次性枪头。
1.3 溶液配制
(1)配制1 mg/mL BSA 标准蛋白质溶液:称量BSA 100 mg,用超纯水溶解并稀释至100 mL。
(2)配制0.01%(w/w)的考马斯亮兰G-250 染料溶液:称量100 mg 的考马斯亮兰,先溶于50 mL 95%的乙醇,再加入85%的磷酸溶液120 mL,用超纯水稀释至1 000 mL。
(3)不同浓度的样品液:取1 mg/mL 的BSA 母液,用超纯水稀释到所需浓度。
(4)配制SDS 100 μg/mL 的SDS 溶液:称量SDS粉末10 mg,加入超纯水溶解并稀释至100 mL。
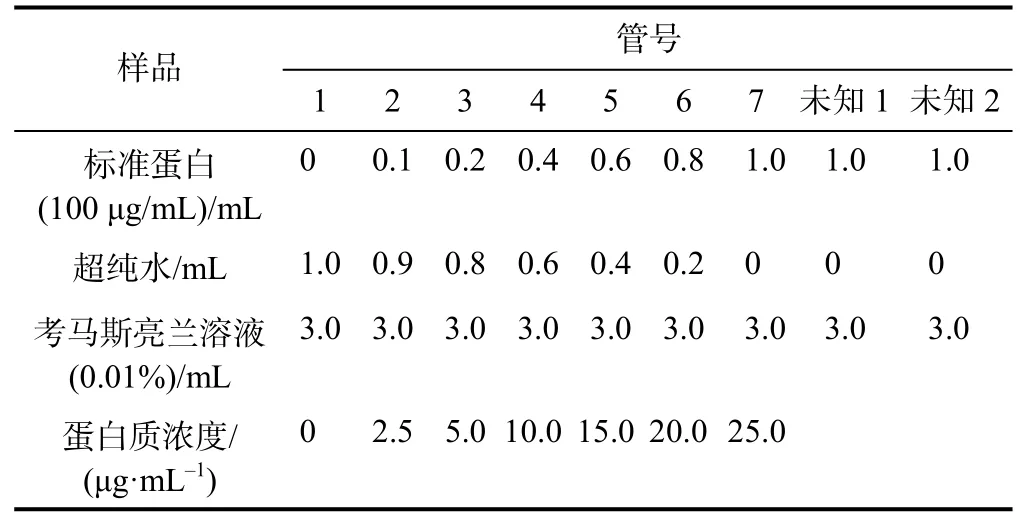
表1 考马斯亮蓝法测定蛋白质浓度-标准曲线的绘制所需样品的组分
1.4 实验方法
1)常量法和微量法测定蛋白质含量。
(1)取9 支试管,按表1 分别编号后依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮兰染料溶液,加完后立即在漩涡混合器上混合。
(2)上述混合后的样品室温下静置3 min,两组同学分别使用紫外分光光度计和多功能酶标仪测定样品在595 nm 处的吸光度A595(使用紫外分光光度计时,选择石英比色皿为样品池,以第一管为空白,加入一定体积的溶液;使用酶标仪时,取96 孔板,依次按照编号用移液枪移取样品200 μL 至对应孔中,每个样品平行测定5 组求平均值)。
(3)分别以蛋白浓度和A595为横坐标和纵坐标作图并进行直线拟合,得到标准曲线方程(Y=aX+b)。
(4)测量未知蛋白样品的吸光度A595,将测量值代入标准曲线方程,即可求得未知样品中的蛋白含量。
2)SDS 干扰试验。
(1)取7 支试管,分别编号后按表2 剂量依次加入标准蛋白、SDS、超纯水和考马斯亮兰染料溶液。每支试管加完后,立即在漩涡混合器上混合。
(2)将上述溶液混合后静置3 min,使用紫外分光光度计或多功能酶标仪(本文仅使用紫外分光光度计进行测量),测量595 nm 处吸光度A595。分别以A595和SDS 浓度为纵、横坐标作图,绘制SDS 干扰试验的曲线,在此基础上分析其干扰机理。

表2 测定SDS 干扰实验曲线的样品编号及不同成分的含量
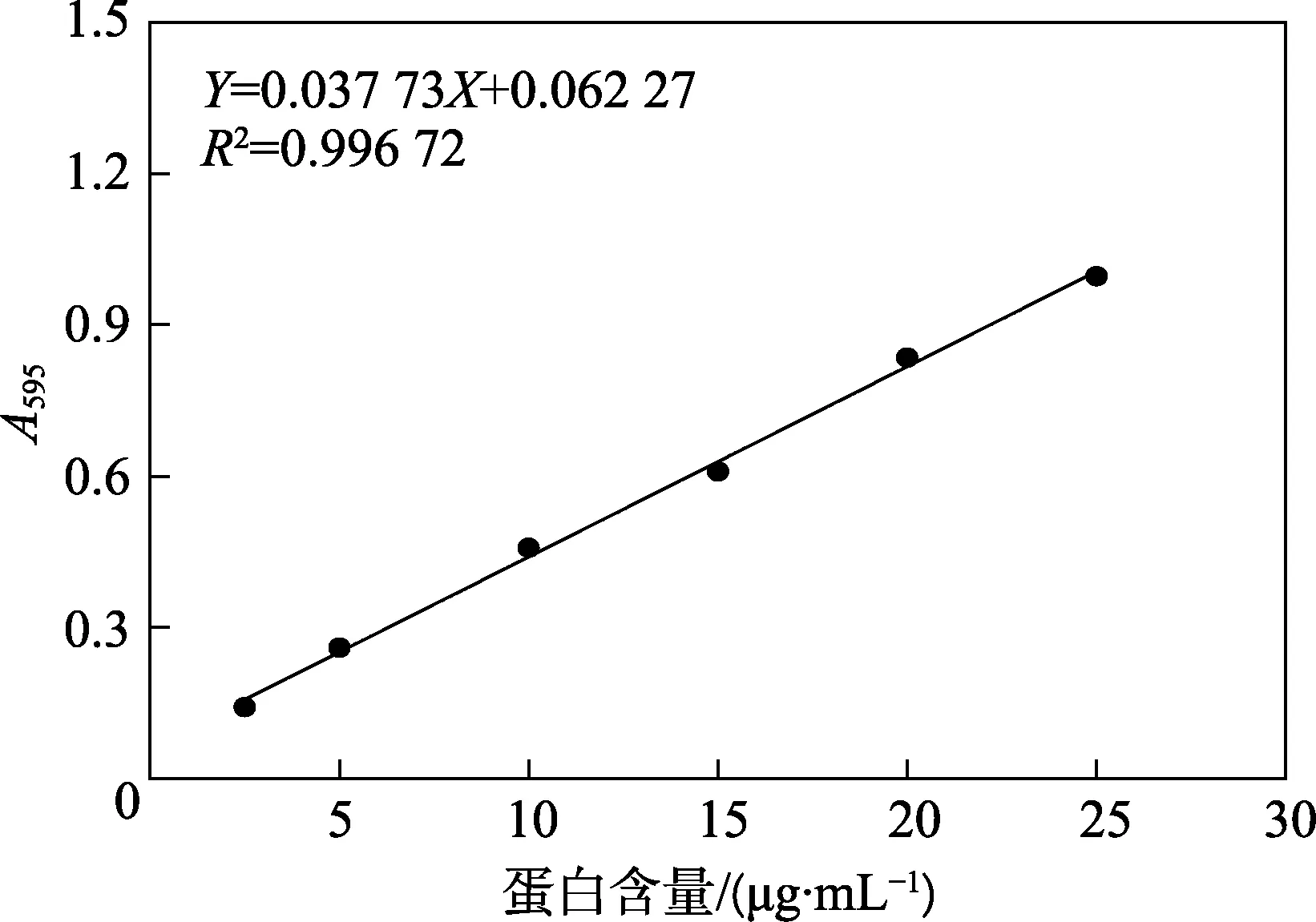
图3 通过常量法(紫外分光光度计)测量的标准曲线
2 结果与讨论
2.1 常量法测定蛋白质含量
首先利用常量法测定了蛋白质含量,通过紫外分光光度计测量了表1 中不同浓度的BSA 溶液与染料作用后在595 nm 处的吸光度值,作为纵坐标,BSA 浓度为横坐标进行作图,绘制标准曲线并进行拟合,如图3 所示。通过拟合曲线得到相关系数R2为0.996 72,相关性好,可用于进一步标定和计算未知蛋白质的浓度。此时,本文进一步对未知蛋白1 和2 进行测定,其在595 nm 处的吸光度值分别为0.543 和0.760,代入标准曲线方程得出未知蛋白浓度为12.62 μg/mL 和18.63 μg/mL。
2.2 微量法测定蛋白质含量
随后利用微量法测定了蛋白质的含量,通过酶标仪同时测量了表1 不同浓度的BSA 溶液与染料作用后在595 nm 处的吸光度值(每组样品平行测定5 个孔求平均值),以其为纵坐标,BSA 浓度为横坐标进行作图,绘制了标准曲线并进行拟合,如图4 所示。通过拟合曲线得到相关系数R2为0.998 08,相关性好,可用于进一步标定和计算未知蛋白质的浓度。此时,进一步对未知蛋白 1 和 2 进行了吸光度测定,其在595 nm 处的吸光度值分别为0.323 和0.430,代入标准曲线方程得出未知蛋白浓度为 14.70 μg/mL 和20.15 μg/mL,与通过常量法测得的数据相比,更接近未知蛋白的实际浓度15 μg/mL 和20 μg/mL,这主要是由于多功能酶标仪在测量过程中使用孔板,每次可同时测定多个样品,每个样品可平行测定多组,保证了同样的仪器状态和样品放置时间,一定程度上提高了测量的准确度,且大大提升了测量效率。但由于孔板的利用,也会导致实验成本相对增加。
上述结果表明,尽管常量法和微量法均可用于蛋白质含量测定,但两种方法的测量原理、所需样品量、测量效率以及测量准确度均存在差异,研究中需要根据实际情况进行选择。当需要测量的样品数量多,体积小时,应该选择多功能酶标仪利用微量法进行测定;而当样品数量较少,样品体积较多时,可选择紫外分光光度计用常量法进行测定。如果样品数量和体积居中,可以依据实验对测量准确度和实验成本等因素的要求选择其中一种方法进行测试或选取两种方法平行验证。
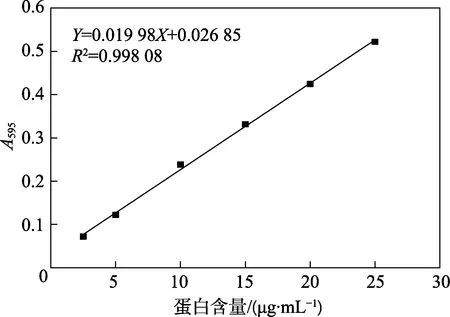
图4 通过微量法(酶标仪)测量的标准曲线
2.3 SDS 对蛋白质含量测定的干扰
尽管Bradford 法具有很多优点,但也存在一定缺点,如一些物质存在会干扰测量的准确性,这些物质主要包括去污剂、Triton X-100 和SDS 等,本部分考察了SDS 对蛋白质含量测定的干扰。利用常量法对表2的样品进行了测定,分别以吸光度和SDS 浓度为纵、横坐标进行作图,结果如图5 所示。
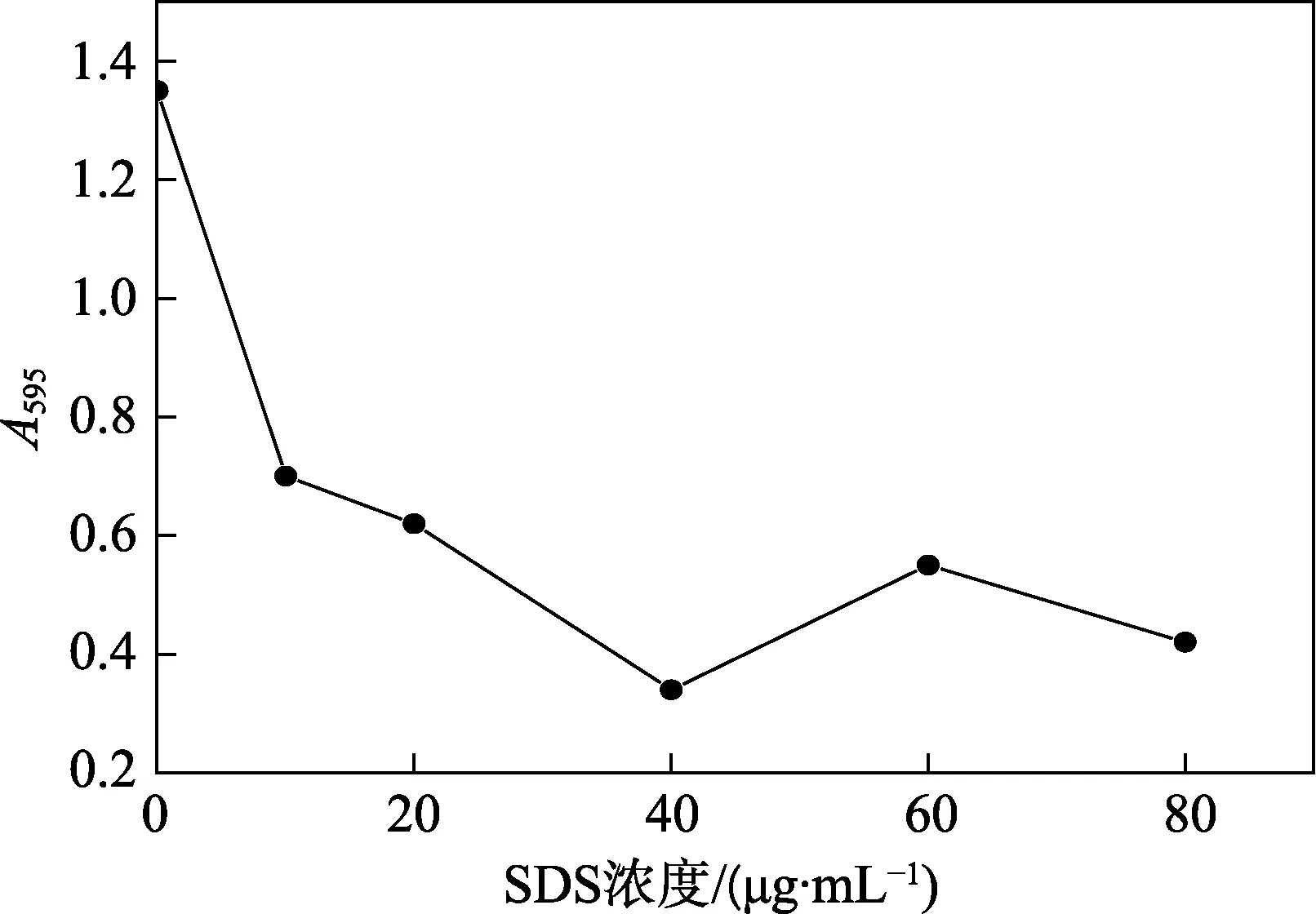
图5 SDS 对蛋白质含量测定的干扰曲线
从上图可以看出,SDS 可显著干扰蛋白质含量测定,测量结果表明:吸光度随SDS 浓度的增加出现了先减小后增大的现象,造成上述结果的主要原因是,SDS 可以有效断开分子内和分子间的氢键,破坏蛋白质的二级结构和三级结构,同时,当SDS 与蛋白质结合后会形成蛋白质-SDS 复合物,导致蛋白质带上大量的负电荷,阻碍染料与碱性氨基酸和芳香族氨基酸的有效结合,导致吸光度降低。而当SDS 加入蛋白质溶液后,导致蛋白质变性,又会使蛋白质的空间结构更加伸展,使原来一些包裹在结构中未与染料结合的碱性氨基酸和芳香族氨基酸暴露出来,促进染料与蛋白质的结合,因此导致测量结果出现先增加后减小的情况。
3 实验教学模式与内容拓展
本实验将常量法和微量法结合用于蛋白质含量的测定,分析了两种方法的异同点。在此基础上,考察了SDS 对蛋白质含量测定的干扰,发现随着SDS 含量的增加,蛋白浓度出现了先增加后减小的情况,这主要是由于静电作用和蛋白质变性两方面的因素造成。通过本实验的开展,可实现如下目标:
(1)学生可掌握Bradford 法测定蛋白质含量的方法和原理,即染料单体与复合物颜色不同,分别在465 nm 和595 nm 处存在吸收。
(2)学生可掌握紫外分光光度计和多功能酶标仪的使用方法和原理,了解常量法和微量法测定的异同点。同时紫外分光光度计和酶标仪的综合运用可提高测量效率,解决本科实验室人数多、大型实验仪器相对较少的问题。
(3)处理数据的过程中,学生可掌握利用Origin处理数据并进行标准曲线拟合的方法,提高学生的数据处理能力。而针对测量结果,特别是SDS 干扰实验,有助于学生理解氨基酸的电性和蛋白质变性等生物化学中的重要概念和知识点,提高学生分析问题和解决问题的能力。
(4)由于不同分组之间需要协调紫外分光光度计和多功能酶标仪的使用,该实验需要学生协作完成,这可有效提高学生的合作和沟通能力,为今后的科研工作奠定良好的基础。
