查尔酮衍生物DL32对脂多糖诱导的大鼠急性肺损伤的影响
2021-04-06董利利汤昱李敏陈超辉王静张亚利张磊
董利利 汤昱 李敏 陈超辉 王静 张亚利 张磊
急性肺损伤(Acute lung injury,ALI)/急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是机体在各种致伤因素(如严重感染、休克、创伤等)作用下,肺内大量炎症细胞浸润和渗出、肺泡上皮细胞及肺泡毛细血管内皮屏障损伤造成的非心源性肺水肿,进而出现进行性低氧血症和呼吸困难等症状[1,2]。ALI/ARDS是临床常见的急危重症,发病急骤,尽管呼吸支持技术不断进步、对分子机制了解逐步深入,病死率仍高达35%~46%[1,3],且对本病目前尚无特异的治疗方法,因此,探索新型药物防治ALI/ARDS是临床治疗的迫切需要。
细菌感染是ALI/ARDS 最常见的致病因素,其中又以革兰阴性细菌内毒素为主导,脂多糖(Lipopolysaccharide,LPS)是内毒素的主要活性成分,采用气管注射LPS是目前常用的制备ALI/ARDS 动物模型的方法且已经广泛应用于ALI 发病机理和药物防治等临床前研究[4]。
在生物体内,LPS 首先被LPS 结合蛋白(LPS binding protein,LBP)识别并形成复合物,然后在辅助蛋白CD14 的帮助下转运至细胞表面与Toll 样受体4(TLR4)和髓样分化蛋白2(Myeloid differentiated protein,MD-2)组成复合物,从而激活TLR4 依赖的炎症信号通路[5,6]。在LPS 的识别和TLR4 跨膜信号转导过程中,MD-2 起着至关重要的作用[5]。MD-2 含有一个容纳LPS 中脂质A 的疏水性口袋,LPS 一旦侵入,TLR4/MD-2复合物受体将迅速发生二聚化形成TLR4-MD-2-LPS 复合物,招募髓样分化因子88(Myeloid differentiation factor,MyD88)以启动炎症信号通路,导致炎症级联反应,促进炎症因子的释放和表达[6],如TNF-α、IL-6、 IL-1β 和COX-2 等均在ALI/ARDS 病程进展中起重要作用[7]。
研究发现,MD-2 基因敲除的大鼠对LPS 无反应且能耐受LPS诱导的脓毒性休克[8]。目前,与MD-2 直接结合并抑制其活性的天然产物有JSH、姜黄素、黄腐酚和异黄腐酚、葛杜宁等[9],均含有查尔酮类似结构。温州医科大学药学院化学生物学研究中心长期从事药物化学和化学生物学研究,发现在合成的查尔酮类化合物中DL32[(E)-2,3-Dimethoxy-30,40-dihydroxychalcone]具有良好的体外抗炎活性。本研究探讨DL32 以ALI 大鼠为模型的体内抗炎活性及其机制。
1 材料与方法
1.1 药物与试剂化合物DL32 由温州医科大学药学院化学生物学研究中心合成。
LPS(Sigma,货号L6386),动物组织蛋白抽提试剂(博士德生物技术有限公司,货号AR0101),大鼠TNF-α ELISA 试剂盒(eBioscience,货号85-88-7340-86),anti-TLR4 抗体(Santa Cruz Biotechnology,货号sc-293072),anti-MD-2 抗体(Santa Cruz Biotechnology,货号sc-80183),anti-CD68 抗体(Cell Signaling Technology,货号76437S),实时荧光定量PCR 试剂(Invitrogen,货号1708882AP),肺组织髓过氧化物酶(MPO)活性检测试剂盒(南京建成生物工程研究所,货号A044),瑞士-吉姆萨染色液(南京建成生物工程研究所,货号D010),羟甲基纤维素钠(中国医药上海化学试剂公司,货号30036328)。
1.2 仪器SpectraMax M2 酶标仪(美国 MD),电泳仪及转膜仪、曝光仪及PCR 扩增仪(美国 Bio-rad),落地式离心机(美国 Beckman),倒置显微镜(日本Olympus),包埋机及切片机(德国Leica)。
1.3 动物健康雄性Sprague Dawley(SD)大鼠(6~8周龄,180~220g)购自上海斯莱克实验动物中心,生产许可证号 SCXK(沪)2012-0005。大鼠在恒室温、12∶12h 昼夜节律条件下饲养,自由饮水并摄食。该动物实验经温州医科大学实验动物管理委员会批准并在温州医科大学医学院动物实验中心进行[wydw2014-0001]。
1.4 方法
1.4.1 实验分组及急性肺损伤模型建立 将SD 大鼠随机分为空白对照组、LPS 模型组、DL32 单纯给药组、DL32 预防组4组,每组8只,连续7 天灌胃给予DL32 20mg/kg 或等量0.5%羧甲基纤维素钠(CMCNa),各组大鼠吸入乙醚麻醉后,钝性分离暴露气管,LPS 模型组和DL32 预防组采用气管滴注5mg/kg LPS 建立急性肺损伤模型,空白对照组和DL32 单纯给药组滴入等量的生理盐水,逐层缝合伤口,24h后收取样本。
1.4.2 支气管肺泡灌洗液(BALF)的收集 ALI 动物模型建立24h后,大鼠腹腔注射10%的水合氯醛(5ml/kg)进行麻醉并结扎右肺,暴露气管行气管插管,左肺用1ml 生理盐水进行支气管肺泡灌洗,收集灌洗液,重复3次。
1.4.3 BALF 的蛋白浓度测定及细胞计数 将收集的BALF 4℃ 1000rpm 离心5min,取上清液检测蛋白浓度,用50µl 生理盐水重悬沉淀,混匀后取20µl 用细胞计数仪Standard 计数肺泡灌洗液中的总细胞数,并取10µl 做成涂片用Wright-Gimesa 染色法(按试剂盒说明书操作)计数BALF 中中性粒细胞计数。
1.4.4 肺湿重/干重比(W/D)的测定 ALI 动物模型建立24h后,取右肺上叶,滤纸吸去组织上的水分后称取湿重,放入60℃烘箱中72h 以上,直至恒重,称取干重,计算肺组织W/D,判断肺水肿程度。
1.4.5 MPO 活性测定 按MPO 活性检测试剂盒说明书进行操作。
1.4.6 BALF 中TNF-α 蛋白含量检测 按ELISA 试剂盒检测说明书测定BALF 上清液中TNF-α 蛋白含量。
1.4.7 实时荧光定量PCR(RT-qPCR)检测肺组织中IL-6 及TNF-αmRNA的表达 按试剂盒说明书进行:①提取大鼠肺组织中总RNA;②将RNA 逆转录成cDNA;③RT-qPCR 扩增仪检测CT值,并计算相对值。所用引物序列如下:大鼠β-actin 正义链5'-AAGTCCCTCACCCTCCCAAAAG-3',大鼠β-actin 反 义链 5'- AAGCAATGCTGTCACCTTCCC-3';大鼠TNF-α 正义链5'-TACTCCCAGGTTCTCT TCAAGG-3',大鼠TNF-α 反义链5'-TACTCCCAGG TTCTCTTCAAGG-3';大鼠IL-6 正义链5'-GAGTTG TGCAATGGCAATTC-3',大鼠IL-6 反义链5'-ACTC CAGAAGACCAGAGCAG -3'。
1.4.8 苏木素-伊红(HE)染色 4%多聚甲醇溶液中固定肺组织,经乙醇脱水,用石蜡包埋,切成5µm薄片于载玻片上进行HE 染色。染色完成后在光学显微镜(200×,Nikon,Japan)下行组织病理评分。组织损伤程度评分:0分(正常)~4 分(严重),包括间质性炎症、中性粒细胞浸润、充血、组织间隙变窄和水肿[10]。
1.4.9 免疫组织化学染色检测CD-68 肺组织经固定、脱水、包埋、切片、脱蜡和水化后,1% BSA 室温封闭30min,滴加CD68 抗体一抗于4℃过夜,PBS洗涤3次后加入辣根过氧化酶标记的二抗,室温孵育1h,加DAB 显色并用苏木素复染,中性树脂封片,镜检。
1.4.10 组织免疫共沉淀 用动物组织蛋白抽提试剂提取大鼠肺组织蛋白,向300µg 蛋白中加入MD-2抗体,4℃摇床孵育过夜,然后每个样品中分别加入20µl 蛋白A+G 磁珠收取免疫复合物并用冷的PBS洗去未被结合的蛋白,重复5次;样品中加入缓冲液煮沸并离心后取等量样品进行SDS-PAGE 电泳,将蛋白转至PVDF 膜,用5%的脱脂牛奶室温封闭1.5h,加入抗TLR4 抗体于4℃摇床过夜;0.1% TBST溶液洗膜3次后加入辣根过氧化酶标记的二抗室温孵育1h,经ECL 孵育显影并用化学发光凝胶成像系统成像。
1.5 统计学方法采用SPSS 19.0 软件进行统计学分析,计量资料用均数±标准差()表示,两组比较采用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 化合物DL32缓解LPS诱导的大鼠ALI组织病理学改变LPS可造成气道粘膜损伤,引起大鼠ALI 组织病理学改变,见图1。而DL32 预处理的大鼠肺损伤评分明显低于LPS 模型组(6.75±0.63 vs 13.75±0.85,t=6.60,P=0.0006),且DL32 单纯给药组与空白对照组肺损伤评分比较,差异无统计学意义(2.25±0.63 vs 3.00±0.41,t=1.00,P=0.3559)。
2.2 化合物DL32缓解LPS诱导的ALI大鼠肺W/D及BALF蛋白渗出与LPS模型组相比,DL32预处理可显著降低肺W/D 及BALF 中蛋白浓度(t=2.930、2.507,P=0.043、0.028);DL32 单纯给药组与空白对照组比较未见明显变化,差异无统计学意义(t=0.499、1.930,P=0.652、0.086),见表1。
2.3 化合物DL32缓解LPS诱导的ALI大鼠炎性细胞浸润气管滴注LPS 24h后,免疫组化显示CD68 阳性细胞于肺组织中大量聚集,见图2。CD68 为巨噬细胞表面的一种特异性抗原,与LPS模型组相比,化合物DL32 预处理后能明显减少巨噬细胞浸润(t=6.398,P=0.001),DL32 单纯给药组与空白对照组相比,差异无统计学意义(t=0.824,P=0.441)。LPS 模型组BALF 中总细胞数及中性粒细胞数明显增加,而经化合物DL32 预处理后,炎性细胞数量显著减少,差异均有统计学意义(t=2.433、5.197,P=0.045、0.004),DL32 单纯给药组与空白对照组相比,差异均无统计学意义(t=0.005、2.161,P=0.996、0.083)。LPS 刺激MPO 活性的增高,DL32预处理后组织中MPO 活性明显降低,差异有统计学意义(t=2.648,P=0.046),DL32单纯给药组与空白对照组相比,差异无统计学意义(t=0.417,P=0.698),见表2。
2.4 化合物DL32缓解LPS诱导的ALI大鼠炎症因子的释放气管滴注LPS 24h后,BALF 中TNF-α 浓度明显升高,组织中炎症因子IL-6、TNF-α 基因表达也显著增多,化合物DL32 预处理可显著抑制炎症因子的释放和表达,差异均有统计学意义(t=3.320、25.310、7.203,P=0.030、<0.0001、0.002),DL32 单纯给药组与空白对照组相比,差异无统计学意义(t=2.175、1.283、0.246,P=0.118、0.256、0.818),见表3。
2.5 化合物DL32抑制ALI 大鼠中TLR4/MD-2复合物的形成为进一步探讨DL32缓解ALI 的靶向性,进行肺组织免疫共沉淀检测,结果显示,LPS 可诱导TLR4/MD-2 的大量形成,DL32 预处理则明显减少该复合物的形成,并且DL32 单纯给药组未见明显变化,见图3。
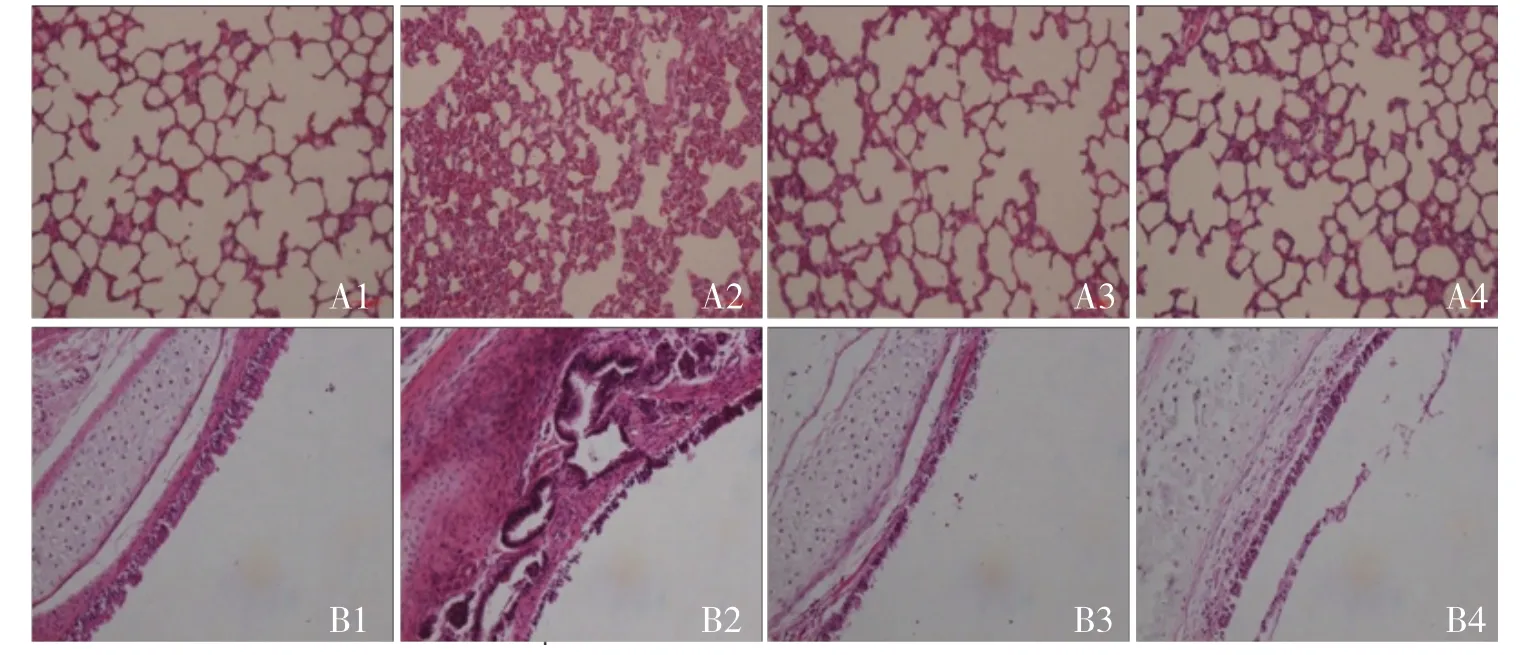
图1 化合物DL32缓解LPS诱导的大鼠ALI 结果(HE 染色,200×)

表1 肺W/D 及BALF 蛋白浓度测定

图2 化合物DL32缓解LPS诱导的ALI 大鼠炎性细胞浸润(CD68 免疫组化染色,200×)

表2 炎性细胞及活动测定
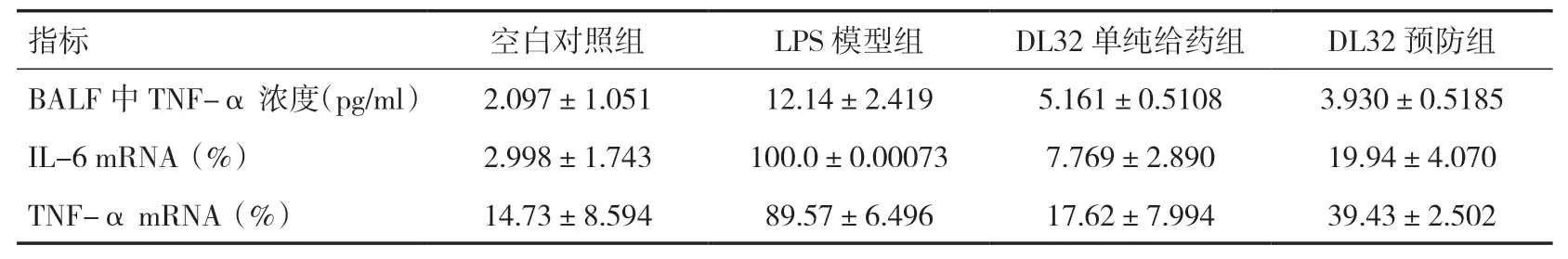
表3 炎症因子测定
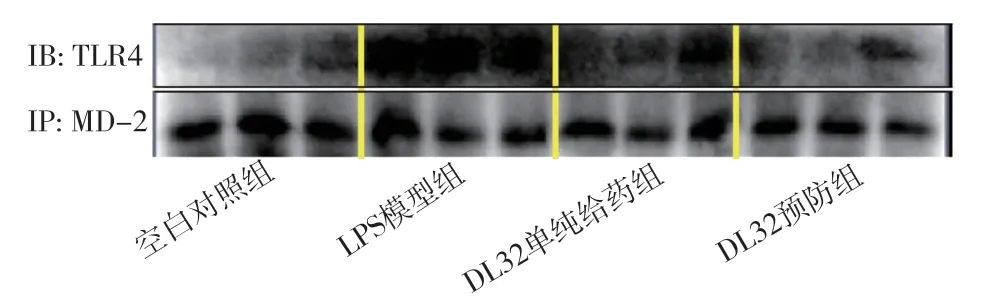
图3 化合物DL32缓解LPS诱导的ALI 大鼠炎症因子的释放及TLR4/MD-2复合物的形成
3 讨论
本研究发现,DL32 以MD-2 为靶点可缓解LPS诱导的大鼠ALI。MD-2是TLR4 的一个共同受体,它与TLR4 在细胞表面结合并介导LPS 和TLR4 的结合,促进TLR4 二聚化并激活下游信号通路从而上调炎症因子的表达[6]。由于MD-2 可直接识别LPS 的脂质A 部分而介导TLR4 活性,在感染引起的炎症中,MD-2是比TLR4 更具吸引力的药物作用靶点[11]。研究发现,通过药理学和遗传学方法抑制MD-2 活性可使炎症性疾病减轻,如脓毒血症、肺炎、肾炎、哮喘、心肌炎、非酒精性脂肪肝和纤维化等[9]。肾组织中,紫杉醇与MD-2 的结合可阻断LPS 与TLR4/MD-2 的复合,从而抑制NF-κB的活化及促炎因子的产生[12]。在大鼠体内,小干扰RNA 敲除肺MD-2 可减轻花粉和猫毛引起的过敏性炎症反应[13]。
近年来,相继报道的作用于MD-2 而抑制LPS与TLR4 结合的脂质类或非脂质小分子抑制剂已有几十种[9]。其中,最具代表性的脂质类化合物Eritoran 可与LPS 竞争结合于MD-2 的位点,而与TLR4 却没有直接作用,但是,在脓毒症Ⅲ期临床实验中,Eritoran 治疗组与安慰剂组相比并无显著差异[14]。天然产物如姜黄素、查尔酮、葛杜宁以及我们实验室新合成化合物L6H21[15]和L48H37[16]可直接与MD-2 结合从而抑制MD-2 与LPS 结合介导的炎症反应,具有显著的抗炎效果,同时再次证实MD-2 在介导炎症反应中的重要作用。本研究发现,DL32 在体内具有良好的抗炎作用。
LPS是引起ALI/ARDS 最常见的原因之一,常进展较快,气管内滴注LPS 可以导致肺气-血屏障受损引起毛细血管内皮细胞及肺泡上皮细胞损伤,组织学特征及病理生理变化主要表现为肺泡间隔增厚、充血、水肿、中性粒细胞及巨噬细胞浸润聚集,气管壁增厚、充血、水肿、杯状细胞和粘液细胞增多、中性粒细胞及巨噬细胞浸润聚集及炎症介质的大量合成和释放(TNF-α、IL-6、IL-8、IL-1β 等)[2]。然而,目前临床上尚无有效的药物治疗且死亡率依然较高。研究发现,抑制MD-2 活性可缓解肺部炎症,MD-2 基因敲除的大鼠经鼻滴入脑膜炎奈瑟菌来源的LPS诱导的肺炎BALF 中性粒细胞数显著减少[17]。Zhang 等[5]研究发现,抑制MD-2 活性可减轻革兰氏阴性细菌内毒素诱导的肺部炎症。本研究发现,MD-2 抑制剂DL32 可显著缓解大鼠肺水肿及减少中性粒细胞浸润。同时,DL32 减轻了肺泡毛细血管的通透性增加及蛋白渗出并抑制了BALF及肺组织中炎症介质的释放。此外,肺组织中,LPS诱导促使TLR4/MD-2复合物的形成,而DL32 预处理则明显减少该复合物的含量。因此,DL32 作为MD-2 抑制剂有望成为治疗ALI 的候选药物,而抑制MD-2 有望成为治疗ALI 的新策略。
总之,本研究表明DL32 可缓解LPS诱导的大鼠ALI 且MD-2是LPS诱导的ALI 的重要治疗靶点,但DL32 抑制MD-2 的具体分子作用机制有待进一步研究。
