吡拉西坦分散片处方的工艺研究
2021-04-06杨柳赵鼎朱雪媞田志豪
杨柳,赵鼎,朱雪媞,田志豪
吡拉西坦分散片处方的工艺研究
杨柳,赵鼎,朱雪媞,田志豪
(东北制药集团沈阳第一制药有限公司,辽宁 沈阳 110027)
针对吡拉西坦片生物利用度不高的问题,原料以超微粉方式增加其生物利用度,并以粉末直压的生产工艺方式生产吡拉西坦片。以性状、溶出度、有关物质、质量分数等一系列的关键质量参数对其稳定性进行了考察,稳定性存放的测试结果完全符合中国药典的要求。
吡拉西坦; 粉末直压; 超微粉
吡拉西坦是由比利时UCB研究所于1963年研制合成,我国于1980年由东北制药总厂首先仿制成功、批量生产并上市销售[1-4]。研究表明,吡拉西坦具有激活、保护和修复神经细胞的作用,是作用于中枢神经系统的药物,常被称为益智药[5]。临床上用于急、慢性脑血管病、脑外伤、各种中毒性脑病等多种原因所致的记忆减退及轻、中度脑功能障碍的治疗,也可用于儿童智能发育迟缓等症。本品为脑代谢改善药,属于γ-氨基丁酸的环形衍生物,有抗物理因素、化学因素所致的脑功能损伤的作用,能促进脑内ADP 转化为ATP,可促进乙酰胆碱合成并增强强神经兴奋的传导,具有促进脑内代谢作用[6-7]。
1 实验部分
1.1 仪器与试药
微晶纤维素,批号c1911022,眀台化工股份有限公司;橘子香精,批号201912061,苏州禾田香料有限公司;交联羧甲基纤维素钠,批号170902;胶态二氧化硅,批号20190809,德国WACKER公司;吡拉西坦对照品,批号100386-201703,中国食品药品检定研究院。RC1208D型溶出试验仪,天津市天大天发科技有限公司;岛津LC-20A型高效液相色谱仪,日本岛津。
2 方法和结果
2.1 处方筛选
根据原研产品Nootrop的处方组成,以交联羧甲基纤维素钠为崩解剂,以微晶纤维素为主要的填充剂,胶态二氧化硅为润滑剂,橙子香精为矫味剂。以上所选用的微晶纤维素、联羧甲基纤维素钠、胶态二氧化硅,菠萝香精均为口服级药用辅料。
原辅料相容性实验:根据《化学药物制剂研究技术指导原则》和《化学药物(原料药和制剂)稳定性研究技术指导原则》,考察吡拉西坦的质量分数和有关物质,结果如表1所示。

表1 原辅料相容性实验
从表1中可以得出,原辅料在上述条件下各检测指标均符合标准要求且无增加趋势,相容性良好。
2.2 处方用量筛选
参考原研品Nootrop处方组成,设计自制品的片重约为0.805 g,采用微晶纤维素作为填充剂,根据有关资料及吡拉西坦原辅料的相容性试验结果,采用超微粉碎前处理工艺粉碎吡拉西坦原料,并以粉末直压的工艺进行制备,以片剂的外观、质量分数、分散均匀性、脆碎度、流动性和可压性作为考察指标,对处方量进行筛选,试验结果见表2。
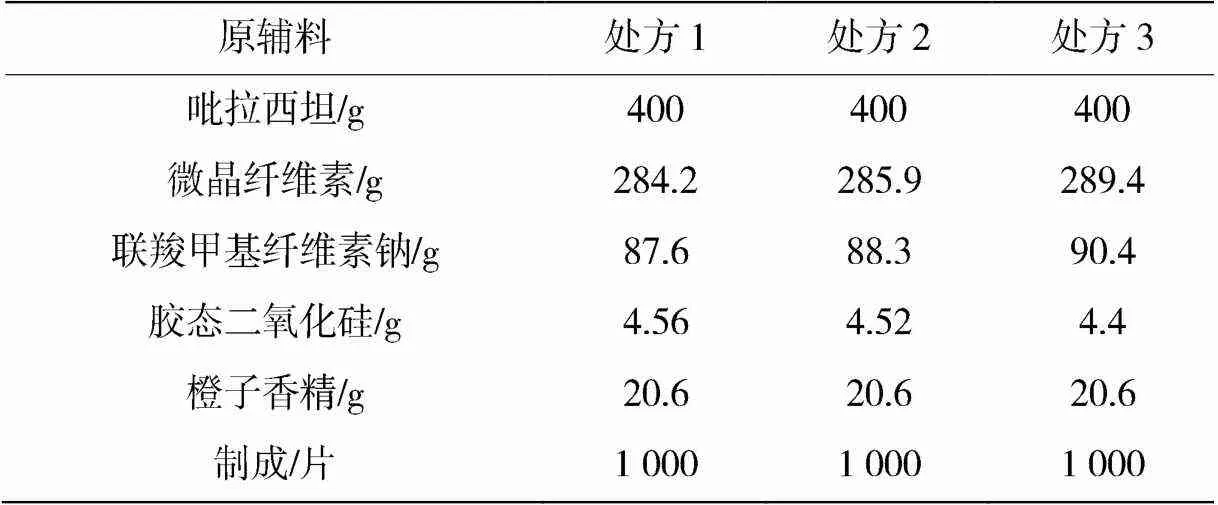
表2 处方筛选试验结果
制备工艺:称取处方量的原料,将微粉化的原料过200目(0.075 mm)筛后备用。称取处方量的除胶态二氧化硅外的辅料均匀混合,最后加入处方量胶态二氧化硅一起放入四维混料机,待混合均匀后,按理论片重粉末直压,试验结果见表3。

表3 处方筛选试验结果
通过以上的检测结果可以得出,随着联羧甲基纤维素钠用量的增加,片剂的溶散性增加,脆碎度变化不大,可压性更好,综合考虑各因素,处方3的工艺参数更好,所以选择处方3的用量作为本品的处方量。
2.3 稳定性试验考察
按以上优化后的处方3,自制3个批次的样品,在温度为40±2 ℃,湿度为RH 75%±5%进行加速试验,所自制的吡拉西坦分散片采用双铝包装,结果见表4。

表4 吡拉西坦分散片稳定性blxt-1批供试品加速试验数据
2.4 溶出曲线考察
参照日本橙皮书收载的溶出方法:桨法,溶出介质体积900 mL,转速50 r·min-1,溶出介质为水溶出介质。参比制剂和自制制剂在水介质中溶出15 min均大于85%,属快速溶出制剂。参照《普通口服固体制剂溶出曲线测定与比较指导原则》比较被评价制剂与参比制剂的溶出曲线相似性结果,通常以非模型依赖法中的相似因子(f2)法。但由于参比制剂15 min的溶出量不低于85%,则无需比较f2,自制样品溶出15 min溶出量亦不低于85%,即认为相似。
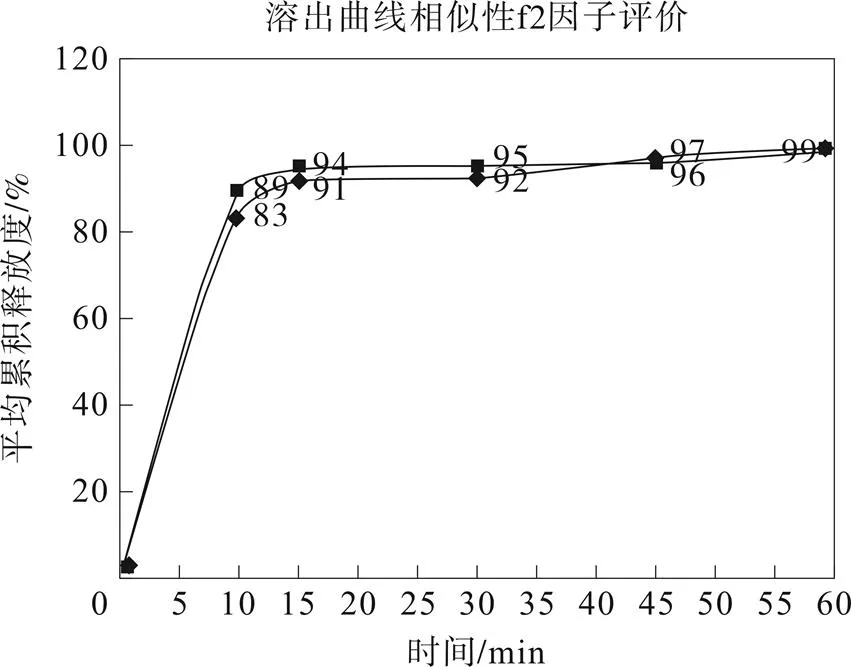
图1 原研品与自制制剂的溶出曲线
从图1中可以看出,原研和自制制剂在15 min溶出量均已达到了85%,所以自制的吡拉西坦分散片与原研制剂体外溶出一致性相似。
3 结 论
1)参考原研处方,考察了其原辅料相容性,试验结果相容性良好,质量分数和有关物质几乎没有变化。
2)通过对原料超微粉的前期处理,结合微晶纤维素这一干黏合剂的使用,进一步提高了溶出行为。并在工艺中大胆地应用粉末直压技术,与传统工艺相比除去了制粒干燥等繁琐步骤,提高了生产效率。
3)通过稳定性试验结果可得出,自制的吡拉西坦片的各项关键质量参数完全符合2015版药典要求且生产工艺稳定。
4)通过溶出曲线的考察,进一步确保该制剂与原研品溶出行为一致性。
[1] 李霞.奥拉西坦与吡拉西坦的药理作用及临床效果比照观察[J].健康之友,2020(16):288.
[2] 李锁南,尹江柳,向鹏.甘露醇联合吡拉西坦治疗脑出血所致脑水肿的效果及安全性分析[J].中国处方药,2020,18(9):79-80.
[3] 程守雨.奥拉西坦与吡拉西坦治疗高血压脑出血的临床效果分析[J].中国实用医药,2020,15(19):108-109.
[4] 樊晓军,闫晋康.吡拉西坦联合血栓通治疗脑梗死后遗症的疗效观察[J].中国药物与临床,2020,20(7):1123-1124.
[5] 宋小娜,陈博.应用醒脑静注射液联合吡拉西坦治疗脑出血后认知功能障碍的效果分析[J].中国校医,2020,34(8):626-627.
[6] 张鑫林.吡拉西坦对急性脑梗死患者神经功能缺损的疗效[J].中国保健营养,2020,30(20):330-331.
[7] 张慧锋,马永春.依达拉奉与吡拉西坦联合治疗大面积脑梗死的疗效研究[J].泰山医学院学报,2020,41(6):424-426.
Study on the Formulation of Piracetam Dispersible Tablets
(Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co., Ltd., Shenyang Liaoning 110027, China)
To solve the problem of low bioavailability of piracetam, the bioavailability of piracetam tablets was increased by using ultrafine powder, and piracetam tablets were produced by direct powder pressing. The stability was investigated by some key quality parameters, such as character, dissolution, related substances, mass fraction and so on. The test results of stable storage completely met the requirements of Chinese Pharmacopoeia.
Piracetam; Direct powder pressing; Ultrafine powder
2020-10-16
杨柳(1986-),女,辽宁省沈阳市人,中级工程师,毕业于沈阳化工大学化学工程与工艺专业,研究方向:药物制剂。
TQ460.6
A
1004-0935(2021)03-0326-03
