儿童原发性肾病综合征VCAM−1、hs−CRP水平及与脂代谢的关系
2021-04-04刘竹枫王文红张瑄魏宁宋少娜
刘竹枫,王文红,张瑄,魏宁,宋少娜
原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童常见的肾小球疾病,目前病因及发病机制尚未明确。通常认为免疫异常是PNS的始发因素,炎症反应在PNS发生及进展中发挥重要作用。高脂血症是PNS四大特征之一,脂代谢紊乱与进行性肾损害及动脉粥样硬化的发生有着密切关系。高脂血症可引起血管内皮细胞损伤,促使脂蛋白在肾小球系膜区聚集,从而导致肾小球系膜增生和硬化,加重肾损害[1];还可引起血管内皮细胞损伤,增加全血黏度,造成血液高凝状态,促进血栓形成[2]。有研究表明,作为内皮损伤的标志物,血管细胞黏附分子1(VCAM−1)通过促进单核细胞在血管内皮积聚,介导血管内皮炎症反应,引起动脉粥样硬化[3]。超敏C反应蛋白(hs−CRP)的测定方法较C反应蛋白更为敏感,较低水平亦可反映机体的微炎症状态。hs−CRP可通过直接参与局部和全身炎症反应,损伤血管内皮细胞,促进动脉粥样硬化的形成发展,是冠心病患者发病、进展、死亡的独立预测因子[4]。目前国内关于VCAM−1、hs−CRP与PNS患儿脂代谢紊乱及高凝状态关系的报道较少。基于此,本文主要探究PNS患儿外周血VCAM−1和hs−CRP的水平及与脂质代谢紊乱的关系,探讨其在临床及发病机制中可能的意义。
1 资料与方法
1.1 一般资料收集2016年12月—2017年12月天津市儿童医院肾内科住院的初发和激素停药6个月以上复发的PNS患儿65例作为病例组,其中男52例,女13例,年龄1~14岁,平均(5.56±2.84)岁,均为激素敏感患儿(SSNS);同期,选取我院性别、年龄与病例组匹配的健康体检儿童45例作为对照组,排除肾脏相关疾病及脂代谢异常者,其中男29例,女16例,年龄1~13岁,平均(5.73±2.56)岁,对照组与病例组在性别(χ2=3.314)、年龄(t=0.286)方面差异均无统计学意义(P>0.05),具有可比性。本研究通过本院医学伦理委员会批准(伦理号L2020−27),患儿监护人均签署知情同意书。
1.2 病例组的纳入及排除标准纳入标准:(1)符合2016年中华医学会儿科学分会肾脏病学组制定的《儿童激素敏感、复发/依赖肾病综合征诊治循证指南》关于初发及复发PNS的诊断标准[5]。(2)患儿经过临床规范糖皮质激素(GC)治疗,口服曲安西龙(4 mg/片,天津天药药业股份有限公司)1.6 mg/(kg·d),等效于泼尼松足量2 mg/(kg·d)或60 mg/(m2·d),最大剂量60 mg/d治疗≤4周尿蛋白转阴者。(3)临床病历资料完整。排除标准:(1)继发性肾病综合征或其他慢性肾脏疾病患儿。(2)激素耐药患儿。(3)急慢性感染患儿。(4)合并其他自身免疫性疾病、肝脏疾病、内分泌疾病和肿瘤性疾病等。
1.3 研究方法
1.3.1 VCAM−1与hs−CRP的检测病例组GC治疗前及尿蛋白转阴后(治疗后)分别于清晨空腹取静脉血约2 mL,对照组于体检当日清晨空腹取静脉血约2 mL,于3 000 r/min下离心15 min,离心半径90 mm,将其中1 mL静脉血取上清液放置−70℃冰箱保存待测。采用酶联免疫吸附测定(ELISA)法检测血浆VCAM−1水平,全自动酶标仪(SLTⅢ型)购自奥地利TECAN SUNRISE公司,VCAM−1试剂盒购自上海研域生物科技有限公司。将剩余1 mL静脉血上清液放置−20℃冰箱保存待测,1周内采用免疫比浊法于COBAS 6000−C501全自动生化仪(德国罗氏公司)测定血浆hs−CRP水平,hs−CRP试剂购自北京康大泰科医学科技有限公司。
1.3.2 临床指标的测定2组治疗前后分别于清晨空腹抽取静脉血5 mL,应用COBAS 6000−C501全自动生化仪检测血浆白蛋白(ALB)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL−C)、高密度脂蛋白胆固醇(HDL−C)、载脂蛋白(Apo)A1、ApoB、脂蛋白a[LP(a)]、纤维蛋白原(Fb)、D二聚体、血浆凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、血浆凝血酶时间(TT);留取24 h尿,应用特种蛋白分析仪(美国贝克曼hnmage800)进行蛋白定量检测。
1.4 统计学方法运用SPSS 19.0统计软件对各组数据进行分析。所有计量资料均采用x±s表示,2组间比较采用成组t检验,病例组治疗前后比较采用配对t检验。采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 病例组治疗前与对照组VCAM−1、hs−CRP水平及临床指标比较病例组治疗前VCAM−1、hs−CRP、TG、TC、LDL−C、ApoB、LP(a)、Fb、D二聚体及24 h尿蛋白定量水平均高于对照组,而ALB、HDL−C水平低于对照组(P<0.05),见表1。
2.2 病例组治疗前后血浆VCAM−1、hs−CRP水平及临床指标比较治疗后血浆VCAM−1、hs−CRP、TG、TC、LDL−C、ApoB、LP(a)、Fb、D二聚体及24 h尿蛋白定量水平均下降,而ALB、HDL−C水平升高(P<0.05),见表1。
2.3 病例组血浆VCAM−1、hs−CRP水平与临床指标的相关性病例组血浆VCAM−1、hs−CRP与24 h尿蛋白定量、血TG、TC、LDL−C、ApoB、LP(a)、Fb、D二聚体水平呈正相关(P<0.05),而与血清ALB、HDL−C呈负相关(P<0.05),见表2。
3 讨论
脂代谢紊乱与肾脏疾病关系密切,以PNS最为突出。PNS脂质代谢紊乱的特点主要包括TC、TG、LP(a)、LDL−C、ApoB水平的增高。本研究中,PNS急性期患儿血浆TC、TG、LP(a)、LDL−C、ApoB水平高于对照组,ALB、HDL−C低于对照组,符合PNS血脂紊乱的表现;Fb是血栓形成的重要因素之一,而D二聚体水平增高可作为反映高凝和纤溶亢进的分子标志物[6]。PNS患儿Fb、D二聚体较对照组明显增高,提示PNS患儿急性期存在高凝状态及血栓形成的风险。PNS患儿尿蛋白转阴后血浆TC、TG、LP(a)、LDL−C、ApoB、Fb、D二聚体、24 h尿蛋白定量均低于治疗前,而血ALB、HDL−C水平高于治疗前,提示尿蛋白转阴后PNS患儿的脂代谢紊乱和高凝状态出现明显改善。

Tab.1 Comparison of clinical data between the three groups表1 各组临床资料比较 (x±s)
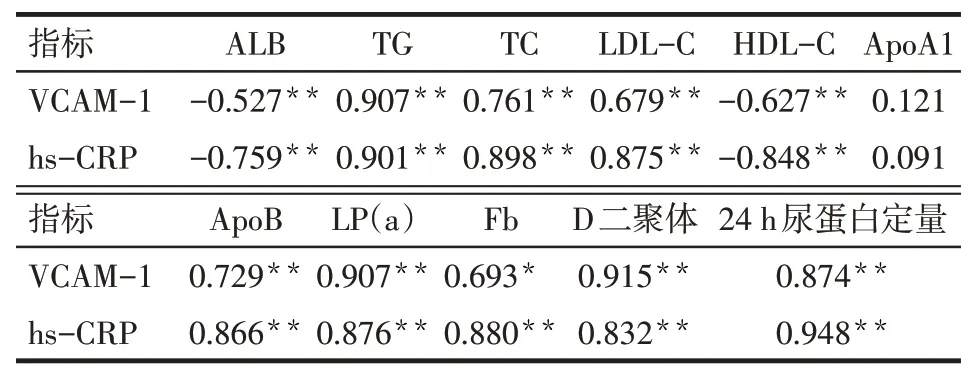
Tab.2 The correlation between the levels of VCAM-1,hs-CRP and clinical indexes in children with PNS表2 原发性肾病综合征患儿血浆VCAM-1、hs-CRP水平与临床指标的相关性
肾病综合征属于免疫介导的炎症反应,免疫紊乱为始发机制,在此基础上的炎症反应在PNS发生发展中发挥重要作用。生理情况下,VCAM−1血浆中检测不到或水平较低;当内皮细胞被激活或受损后,VCAM−1表达增多,可作为内皮细胞受损预测指标。Malyszko等[7]发现VCAM−1等在成人PNS急性期显著升高,提示PNS活动期存在内皮损伤。VCAM−l还参与免疫细胞的黏附和迁移,在免疫炎症反应中具有重要作用[8]。Tsalik等[9]研究发现在炎症反应中,细胞黏附分子被激活并促进炎性细胞介导全身炎症反应。Wei等[10]认为VCAM−1在脱落和凋亡的肾小管上皮细胞表达增强伴随着白细胞浸润,最终导致肾病的发生。本研究显示,PNS患儿急性期VCAM−1水平高于对照组,尿蛋白转阴后下降,提示患儿存在内皮细胞损伤及炎症状态,且VCAM−1参与了PNS的发病过程,可能与炎细胞浸润有关。
PNS患儿血浆VCAM−1与尿蛋白定量、血TG、TC、LDL−C、ApoB、Fb、D二聚体水平呈正相关,与血清ALB、HDL−C呈负相关,提示VCAM−1与PNS患儿高凝状态及血栓形成有关。相比成人,儿童PNS更容易出现高凝状态[11]。血清VCAM−1在炎症反应中促进白细胞在炎症区域与内皮细胞结合引起微血管功能障碍和组织损伤,可促进血栓形成。Inami等[12]发现肺血栓栓塞患者中VCAM−1显著升高。González−Ordóñez等[13]发现在严重深静脉血栓患者的血浆中,VCAM−1更高,为VCAM−1导致血管损伤加重高凝状态进而形成血栓提供了依据。因此,VCAM−1既参与PNS高凝状态的形成,又对血栓栓塞早期诊断提供帮助,还可作为监测肾病严重程度的指标。
hs−CRP是区分低水平炎症状态的灵敏指标。hs−CRP可直接参与局部或全身炎症反应,激活炎性细胞,损伤血管内皮,诱发免疫损伤,造成肾小球硬化,在慢性肾脏病的发生发展中起重要作用[14]。杨水金等[15]研究显示随着肾功能水平的下降,慢性肾病患者血清hs−CRP水平呈上升趋势。刘栋等[16]研究显示肾病组C反应蛋白与血尿素氮呈正相关,说明hs−CRP可以反映PNS患儿肾功能的状况。本研究显示病例组血清hs−CRP水平较对照组增高,尿蛋白转阴后下降,提示PNS患儿存在微炎症状态,与既往研究一致,hs−CRP可能通过直接激活炎性细胞,参与炎症反应,诱导免疫损伤,参与PNS的发生发展过程,并可作为疾病活动及严重程度的监测指标之一。hs−CRP与TG、TC、LDL−C、ApoB呈正相关,提示其通过一定的机制参与了脂代谢紊乱的发生、发展;与Fb、D二聚体呈正相关,提示其参与了高凝状态的形成,可作为早期预测血栓形成的指标。
总之,PNS发病机制及脂代谢紊乱成因非常复杂,是多种因素综合作用的结果。到目前为止,有关炎症反应、免疫损伤和血管内皮损伤在PNS状态下究竟通过怎样的途径发挥了作用还不清楚。血管内皮损伤和微炎症状态可能参与了PNS的发病过程或疾病进展,也可能通过不同的途径参与了脂代谢紊乱和高凝状态的形成,联合检测VCAM−1和hs−CRP的水平为探讨PNS的发病机制以及对脂代谢紊乱、高凝状态及病情严重程度的评估提供了新的思路及有价值的依据。
