栀子豉汤固体发酵菌质的制备及主要成分含量变化
2021-04-02陈丽艳宓月光孙国东孙银玲冯丽娜王伟明
陈丽艳,邢 怡,宓月光,孙国东,孙银玲,曹 阳,冯丽娜,王伟明*
(黑龙江省中医药科学院,黑龙江哈尔滨 150036)
栀子豉汤为张仲景的经典名方,由栀子和淡豆豉两味药食同源中药配伍而成,为清宣胸中郁热,治疗虚烦懊恼不得眠之良方[1]。现代药理研究表明,栀子豉汤具有抗抑郁作用,环烯醚萜类成分为其主要药效物质,其中栀子苷含量最高[2-3]。药代动力学和肠吸收代谢动力学研究表明,栀子苷生物利用度低,口服需经肠道微生物及肠壁酶将其代谢为京尼平而被吸收利用[4-5]。然而京尼平不稳定,在一定条件下可与多种氨基酸结合生成稳定的栀子蓝[6],且栀子蓝较栀子苷和京尼平肝毒性更低[7]。崔元璐等[8]研究推测,栀子豉汤采用“先煎栀子再加淡豆豉煎煮”的方法是由于栀子豉汤在煎煮过程中存在:栀子苷京尼平(不稳定)京尼平-氨基酸复合物(栀子蓝)的转化过程,其中京尼平-酪氨酸复合物已被证实其抗抑郁作用优于栀子苷和京尼平[9-10]。淡豆豉为特殊的发酵类中药饮片,含有一定数量的枯草芽孢杆菌等益生菌,具有调节肠道菌群作用[11],在栀子豉汤煎煮过程中,由于高温煎煮会杀灭一部分有益微生物并降低酶的活性,不能充分实现栀子苷的生物转化,且京尼平与氨基酸的结合属于静态恒定过程。
本研究在栀子豉汤原方基础上,采用双向固体发酵技术,以栀子、青蒿、桑叶水煎液浸泡黑豆作为发酵基质,以枯草芽孢杆菌(Bacillus subtilis)和伞枝犁头霉(Fusariumumbellatum)复合菌作为发酵菌株制备栀子豉,通过发酵菌株及发酵时间的考察,以栀子苷的转化率为评价指标,在体外实现栀子苷的降解及京尼平-氨基酸复合物的动态积累过程,为提高栀子豉汤药效及新产品开发提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 药材和菌株
青蒿和桑叶(批号170101):河北祁新中药颗粒饮片有限公司;黑豆(批号20170503):北京本草方源药业集团有限公司;栀子(批号171001):亳州市张仲景中药饮片有限责任公司。
枯草芽孢杆菌(Bacillus subtilis)DDC-SP1、伞枝梨头霉(Absidia corymbifera)DDC-SP11、米根霉(Rhizopus oryzae)DDC-SP14:均从市售淡豆豉饮片中分离,经中国工业微生物菌种保藏管理中心鉴定(报告编号分别为17-066-161-169,17-276-852-1123和17-066-163-171),三株菌经筛选具有较高的蛋白酶和β-葡萄糖苷酶活性。
1.1.2 化学试剂
栀子苷对照品(批号Z-003-170222)(纯度>98%)、京尼平对照品(批号J-028-161216)(纯度>98%):成都瑞芬思生物科技有限公司;17种氨基酸水解标样混合液:天冬氨酸(Asp)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、胱氨酸(Cys)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、赖氨酸(Lys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe);AccQ·Fluor衍生剂(硼酸缓冲液、衍生剂粉末、衍生剂稀释液、三水乙酸钠-磷酸钠洗脱液):美国Waters公司;甲醇、乙腈(均为色谱纯)。其他试剂均为国产分析纯。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基:蛋白胨10.0 g/L,牛肉粉3.0 g/L,氯化钠5.0 g/L,琼脂15.0 g/L,加热溶解于1 000 mL蒸馏水中。121 ℃高压灭菌15 min。
营养肉汤(NB)培养基:称取蛋白胨10.0 g/L,牛肉浸粉3.0 g/L,氯化钠5.0 g/L,加热溶解于1 000 mL蒸馏水中。121 ℃高压灭菌15 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸粉6.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L,加热溶解于1 000 mL蒸馏水中。115 ℃高压灭菌20 min。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯浸粉6.0 g/L,葡萄糖20.0 g/L,加热溶解于1 000 mL蒸馏水中。115 ℃高压灭菌20 min。
1.2 仪器与设备
Waters Alliance 2489高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Waters公司;DHP9272恒温培养箱:上海一恒科学仪器有限公司;UV/VIS Lambda 365紫外-可见分光光度计:美国PE公司;BSA224S电子天平:德国赛多利斯科学仪器有限公司;HNY-2102C恒温培养振荡器:天津欧诺仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;DH6-907385-III电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 栀子豉汤各药味配伍剂量的换算
《伤寒论》记载栀子豉汤由“栀子十四个(掰),香豉四合(绵裹)”配伍而成。依据东汉时期度量衡的计量方法,换算为现代的栀子15 g、淡豆豉50 g[12]。《中国药典》淡豆豉质量标准规定每1 kg大豆用青蒿、桑叶分别为70~100 g[13]。因此,本研究栀子豉汤制备中栀子∶青蒿∶桑叶∶黑豆质量比为15∶5∶5∶50。
1.3.2 发酵基质的制备
按照1.3.1的比例称取栀子(打碎)、桑叶、青蒿加10倍水煎煮2次,每次1 h,过滤,合并滤液并浓缩至100 mL,拌入洗净的黑豆中(黑豆与药液的比例为1∶0.8(g∶mL))浸泡12~16 h,待药液吸尽,于121 ℃高压灭菌30 min,即得。
1.3.3 菌液的制备、接种及培养
分别利用枯草芽孢杆菌(Bacillus subtilis)DDC-SP1、伞枝梨头霉(Absidia corymbifera)DDC-SP11、米根霉(Rhizopus oryzae)DDC-SP14三株菌采用单菌和双菌发酵,发酵样品编号及采用的发酵菌株分别为1号:菌株DDC-SP1;2号:菌株DDC-SP11;3号:菌株DDC-SP14;4号:菌株DDC-SP1和DDC-SP11(1∶1,V/V);5号:菌株DDC-SP1和DDC-SP14(1∶1,V/V);6号:菌株DDC-SP11和DDC-SP14(1∶1,V/V)。按照细菌和霉菌的常规培养温度,本研究采用单菌细菌(即菌株DDC-SP1)发酵温度37 ℃,霉菌和复合菌发酵温度为28 ℃。将菌株DDC-SP1接种至营养肉汤中于37 ℃、120 r/min摇床培养18~24 h,得到枯草芽孢杆菌DDC-SP1菌液(108~109CFU/mL);菌株DDC-SP11和DDC-SP14分别接种至马铃薯葡萄糖培养液中,于28 ℃、120 r/min摇床培养3~5 d,分别制成孢子菌悬液(105~106孢子/mL)。将1.3.2的发酵基质接种上述菌液,单菌发酵样品接菌量为2 mL/100 g,双菌发酵样品每种菌液接菌量为1 mL/100 g,混匀,除1号样品于37 ℃、120 r/min摇床培养外,其余5组均于28 ℃、120 r/min摇床培养,分别于不同发酵时间取样,60 ℃干燥。
1.3.4 样品中栀子苷和京尼平的含量测定
采用高效液相色谱法(HPLC)测定栀子苷、京尼平和氨基酸的含量。
供试品溶液制备:分别取发酵0、1 d、3 d、7 d、10 d、15 d的干燥样品,粉碎成细粉(80目),精密称取粉末3.0 g,置具塞锥形瓶中,加入体积分数为50%甲醇50 mL,称质量,摇匀,超声40 min,放冷后再次称定质量,用体积分数为50%甲醇补足质量损失,以3 000 r/min离心20 min,精密吸取上清液10 mL加体积分数为50%甲醇定容至50 mL,摇匀,0.45 μm滤膜过滤备用。
对照品溶液的配制:精密称取栀子苷和京尼平对照品,分别加体积分数为50%甲醇制成400 μg/mL的对照品溶液,用体积分数为50%甲醇进行系列稀释,0.45 μm滤膜过滤。
HPLC色谱条件:参照李翔等[14]的方法,Symmetry C18柱(4.6 mm×150 mm,5 μm);流动相A为甲醇,流动相B为0.5%冰醋酸;流速1 mL/min,检测波长254 nm,进样量10 μL,柱温40 ℃;梯度洗脱程序设置以流动相A计:0~2 min,10%;3~8min,22%;9~13min,30%;14~40min,60%;41~42min,30%;43~50 min,10%。
1.3.5 样品溶液吸光度值测定
京尼平可与多种氨基酸形成复合物产生蓝色或黄色色素,但聚合度不一,分子质量相差很大,一般以色价或者吸光度值衡量其品质[15]。分别精密称取不同发酵时间栀子豉样品干燥粉末1 g,加蒸馏水100 mL摇匀,超声提取20 min,静置过滤,取滤液,以6 000 r/min离心15 min,取上清液,于波长590 nm处测定吸光度值。
1.3.6 样品游离氨基酸含量测定
采用高效液相色谱-荧光检测器法(high performance liquid chromatography-fluorescence detector,HPLC-FLD)测定游离氨基酸的含量。
在确定7 d为最佳发酵时间的前提下考察游离氨基酸的含量变化,分别于发酵0、6 h、12 h、24 h、48 h、72 h、120 h、168h取样,60℃干燥,粉碎。参照宓月光等[16]游离氨基酸含量测定方法,分别精密称取各样品粉末200 mg,加入0.1 mol/mL的盐酸10mL,混匀,超声提取40min,8 000 r/min离心20 min,取上清液过0.45 μm滤膜,进样量10 μL。
2 结果与分析
2.1 栀子豉发酵过程中栀子苷和京尼平的含量变化
对照品栀子苷(A)、京尼平(B)及栀子豉样品(C)的高效液相色谱见图1。由图1可知,栀子苷在24~390 μg/mL质量浓度范围内线性关系良好,标准曲线线性方程为Y=6 962.804 4X+35 420.657 1,相关系数R为0.997 4;京尼平在22~355 μg/mL质量浓度范围内呈良好线性关系,标准曲线线性方程为Y=110.56X+32 838,相关系数R为0.998 2,栀子苷和京尼平色谱峰均达到了基线分离。
各组样品发酵过程中栀子苷含量变化结果见图2。由图2可知,发酵第1天,2号、3号和6号样品栀子苷含量略有上升,其他各组稍有下降,第3天开始各组样品栀子苷含量均随发酵时间延长而逐渐下降,2号和4号样品均在7 d降为0,4号样品在3 d降解最快,1号、3号和5号样品于发酵15 d栀子苷完全转化,6号转化最慢。由于2号、3号和6号的发酵菌均为霉菌,第1天生长处于迟缓期,因此栀子苷未发生降解,28 ℃恒温1 d可能利于栀子苷的溶出而呈小幅上升趋势,而其他各组均有1号枯草芽孢杆菌,由于细菌生长较快,酶活逐渐提高而使栀子苷含量下降;3~7 d霉菌处于对数生长期,各组栀子苷在微生物酶的作用下快速降解。结果表明,采用菌株DDC-SP1和DDC-SP11复合菌发酵7 d栀子苷转化最快。
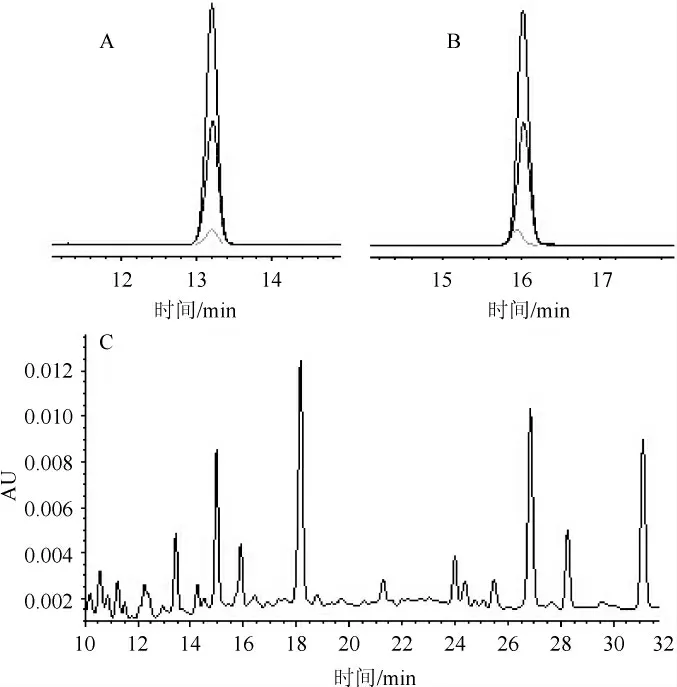
图1 栀子苷(A)、京尼平(B)及栀子豉样品(C)高效液相色谱图Fig.1 HPLC chromatography of geniposide (A),genipin (B) and Zhizichi sample (C)

图2 各组样品发酵过程中栀子苷含量变化Fig.2 Changes of gardenoside contents in each group of samples during fermentation
各组样品发酵过程中京尼平含量变化结果见图3。由图3可知,1号、2号和4号样品京尼平含量均在7 d降为0,推测此时段京尼平与氨基酸可能完全形成复合物,在发酵3 d京尼平降解速率1号>4号>2号;3号样品发酵15 d京尼平转化完全,而6号样品京尼平转化最慢,15 d仍含有0.14 mg/g。除1号样品外,其他各组样品京尼平含量呈先下降后小幅升高再下降的趋势,可能与各发酵菌酶系的构成及活力相关,除1号为单一枯草芽孢杆菌发酵外,其他各组的发酵菌均含有霉菌,发酵1~3 d霉菌生长处于迟缓期。发酵第1天,由于栀子苷较少量转化为京尼平,栀子中原有的京尼平与大豆中的氨基酸结合生成栀子蓝而使京尼平含量下降,在1~3 d又有小幅升高,此阶段细菌正处于生长繁殖的活跃期,栀子苷转化速度高于京尼平与氨基酸结合的速度,使京尼平产生积累,发酵3 d后随着栀子苷和大豆蛋白的逐渐降解,生成的京尼平动态与多种氨基酸结合生成栀子蓝复合物,导致京尼平含量迅速下降。结果表明,采用菌株DDC-SP1与DDC-SP11复合菌发酵可促进栀子苷降解为京尼平且于发酵7 d完全转化。

图3 各组样品发酵过程中京尼平含量变化Fig.3 Changes of genipin contents in each group of samples during fermentation
综上,2号和4号样品均在7 d栀子苷和京尼平含量降为0,一方面表明栀子苷完全降解,另一方面表明京尼平完全与氨基酸形成复合物,而4号在第3天两种成分转化速率更快。4号是采用菌株DDC-SP1与DDC-SP11复合菌发酵制备栀子豉,可发挥多种酶协同作用促进栀子苷的转化及京尼平-氨基酸的结合。
2.2 不同发酵时间栀子豉水溶液吸光度值变化
各组样品发酵过程中吸光度值(OD590nm值)变化结果见表1。

表1 各组样品发酵过程中OD590nm值变化Table1 Changes of OD590nmvalue of each group of samples during fermentation
由表1可知,随着发酵时间的延长,各组样品溶液的吸光度值未呈规律性变化,但4号样品发酵7 d吸光度值最大为0.575,表明其产生的栀子蓝色价最高。由于各组发酵菌的酶系及活性不同,对栀子苷和大豆蛋白的转化能力存在差异,每组样品中京尼平与不同氨基酸生成栀子蓝复合物的组成及含量也不一样。徐尤智等[15]研究表明,赖氨酸、甘氨酸、谷氨酸和丙氨酸与京尼平反应呈色较深,而天冬氨酸、苏氨酸和酪氨酸呈色较浅,脯氨酸几乎不显色,因此栀子豉水溶液OD590nm值不呈规律变化。结果表明,采用菌株DDC-SP1与DDC-SP11复合菌发酵7 d生成栀子蓝的色价最高。
2.3 栀子豉最佳发酵工艺
栀子豉最佳发酵工艺为栀子(打碎)15 g、青蒿5 g、桑叶5 g,加10倍量水煎煮2次,每次1 h,合并滤液,滤液浓缩至100 mL,拌入净黑豆(黑豆与药液的料液比为1.0∶0.8(g∶mL))浸泡12~16 h,待黑豆将药液吸尽,装袋,121 ℃高压灭菌30 min,稍凉,分别接种菌株DDC-SP1菌液(108~109CFU/mL)和菌株DDC-SP11菌液(105~106孢子数/mL)各1 mL/100 g,摇匀,于28 ℃培养168 h(7 d),60 ℃干燥,即得栀子豉。
2.4 栀子豉发酵过程中游离氨基酸的含量变化
在确定栀子豉最佳工艺的基础上,考察发酵7 d内样品游离氨基酸的含量变化氨基酸混合标样及样品的HPLC-FLD色谱图见图4,各组样品氨基酸含量测定结果见表2。

图4 氨基酸混合标准品及栀子豉样品的HPLC-FLD色谱图Fig.4 HPLC-FLD chromatogram of mixed amino acid standards and Zhizichi samples
由图4可知,17种氨基酸衍生物均达到基线分离,分离良好。由表2可知,氨基酸含量于发酵24~72 h变化明显,72 h后趋于平稳。发酵基质(0 h)中精氨酸(Arg)含量最高为3.16 mg/g,丝氨酸(Ser)和脯氨酸(Pro)次之,分别为0.81 mg/g和0.73 mg/g,其他氨基酸含量在0~0.3 mg/g(所有样品中均未出现胱氨酸色谱峰)。随着发酵时间的延长,样品中不同氨基酸含量变化趋势不一致,168 h精氨酸(Arg)含量下降了94.9%,丝氨酸(Ser)和天冬氨酸(Asp)含量分别下降了71.6%和52.0%,而脯氨酸(Pro)含量升高了3.4倍,组氨酸(His)和谷氨酸(Glu)含量均升高1.5倍,其余氨基酸含量未发生明显变化。栀子豉发酵过程中出现了几种氨基酸含量上升或下降的现象,其中精氨酸含量下降幅度最大,可能京尼平与精氨酸结合较多[18-20],另外,栀子豉发酵过程复杂,涉及多种成分的变化及相互作用,尚需进一步深入研究。

表2 栀子豉发酵过程中17种游离氨基酸的含量变化Table 2 Changes of 17 kinds of free amino acids contents during Zhizichi fermentation
3 结论
双向固体发酵技术已成为开发中药新药的新途径,国家一类新药——槐耳菌质即是采用此技术研制而成[17]。本研究在栀子豉汤原方基础上,采用双向固体发酵技术制备栀子豉,确定了其最佳发酵工艺条件为以栀子、青蒿、桑叶水煎液浸泡黑豆作为发酵基质,接种枯草芽孢杆菌(Bacillus subtilis)和伞枝犁头霉(Fusarium umbellatum)复合菌(1∶1,V/V)于28 ℃发酵168 h。此条件下,栀子苷和京尼平含量降为0,生成的京尼平-氨基酸复合物的色价最高(OD590nm为0.575),精氨酸(Arg)、丝氨酸(Ser)和天冬氨酸(Asp)含量分别下降了94.9%、71.6%、52.0%,而脯氨酸(Pro)、组氨酸(His)和谷氨酸(Glu)含量含量分别升高了3.4倍、1.5倍、1.5倍。本研究根据栀子豉汤抗抑郁活性成分的代谢转化机制制备栀子豉,明确了其最佳发酵工艺及主要成分含量变化,后续将进一步通过抑郁症大鼠模型进行药效学研究,为基于经典名方的新型抗抑郁食疗产品或新药开发奠定基础。
