产乳酸芽孢杆菌DU-106益生特性的研究
2021-04-02赖玉健陈素梅罗珮桓
赖玉健,陈素梅,罗珮桓,黎 攀,杜 冰*
(华南农业大学食品学院,广东广州 510642)
乳酸作为世界公认三大有机酸之一,在食品、医药、化妆品、农业上都有着十分广泛的应用,也是生物体机体代谢的重要中间产物,具有重要的生理功效[1-2]。菌株DU-106是一株从内蒙古发酵酸奶中分离出来新菌种,经过鉴定属于芽孢杆菌属(Bacillussp.)[3],是蜡样芽孢杆菌种的一个亚种,具有抗逆性强、耐高温、耐酸、易储存等芽孢杆菌所具备的独特性,同时又具有乳酸菌中产生乳酸的特性,在培养基发酵过程中能产生6.3 g/kg的乳酸,具备较大的潜在应用价值。在前期的应用研究中,发现菌株DU-106具有良好的发酵特性,目前已经应用在果酒[4-5]、饮料[6]、中草药[7-8]的在的发酵上。同时,在对其生理活性的研究中,发现其在降血脂、抗腹泻方面有良好的效果,在提高免疫力方面也表现优异。本研究以产乳酸芽孢杆菌(Bacillussp.)DU-106为研究对象,探讨其是否具备益生菌在体内存活的能力,并与凝结芽孢杆菌(Bacillus coagulans)BC30及鼠李糖乳杆菌(Lactobacillus rhamnosus)R11耐受性进行比较,对乳酸芽孢杆菌(Bacillussp.)DU-106的深层次开发利用颇为重要,不仅可以提高其功能在生产应用中发挥的效能,还便于开发出新的用途。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
乳酸芽孢杆菌(Bacillussp.)DU-106:本实验室保藏菌种;凝结芽孢杆菌(Bacillus coagulans)BC30:美国杜邦公司;鼠李糖乳杆菌(Lactobacillus rhamnosus)R11:法国拉曼公司。
1.1.2 化学试剂
酵母膏、蛋白胨(均为生化试剂):上海哈灵生物科技有限公司;人工胃液、人工肠液:北京雷根生物技术有限公司;猪胆盐(生化试剂):广东环凯微生物科技有限公司;其他均为广州化学分析厂分析纯试剂。
1.1.3 培养基
MRS培养基:青岛海博生物技术有限公司。
发酵培养基:酵母膏10 g,蛋白胨10 g,葡萄糖10 g,硫酸镁1 g,磷酸氢二钾2 g,硫酸锰10 g,琼脂20 g,蒸馏水1 000 mL,pH 7.0。115 ℃灭菌20 min。
1.2 仪器与设备
PHS-25型pH计:上海精密科学仪器有限公司;YXQ-LS-5OS型立式蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;SW-CJ-1D型单人净化工作台:苏州净化设备有限公司;SPX-150B微机生化培养箱:上海悦丰仪器仪表有限公司;UV-1200紫外可见分光光度计:广州沪瑞明仪器有限公司;Agilent 6890N高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司。
1.3 方法
1.3.1 菌株DU-106生长曲线及产酸曲线的绘制
将菌株DU-106接种至发酵培养基中,最终接种量为107个/mL,在37 ℃、120 r/min的摇床中进行培养,得到菌株DU-106发酵液,隔4 h测一次吸光度值(OD600nm值)、pH和总酸[9],分别绘制菌株DU-106的生长曲线及产酸曲线。
1.3.2 分析检测
(1)总酸的测定
取发酵液样品4 mL,加入1%的酚酞2~3滴,用浓度为0.100 mol/L的氢氧化钠溶液进行滴定至出现颜色变化,并保持颜色不变色30 s,记录氢氧化钠滴定量,再用公式算出总酸的量[10]。总酸计算公式如下:

式中:x为总酸含量,mg/mL;C为氢氧化钠溶液的浓度,mol/L;V1为滴定NaOH的体积,mL;V2为滴定空白的体积,mL;m为取的菌液的体积,mL;0.09为乳酸换算系数。
(2)菌株存活率
取不同时间的发酵培养基样品1 mL加入发酵培养基中,在37 ℃条件下恒温培养24 h后,用平板计数法测数菌落数,并记录。菌株存活率计算公式如下:
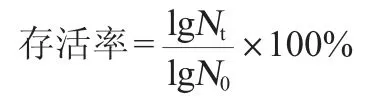
式中:N0为0 h活菌数,CFU/mL;Nt为t(t=1.0或3.0)h活菌数,CFU/mL。
(3)有机酸测定
取37 ℃、120 r/min的摇床中发酵24 h后的DU-106发酵液,3 600 r/min离心10 min,取上清液,采用高效液相色谱法(HPLC)测定其有机酸含量。HPLC色谱条件:色谱柱:AtlantisRR T3色谱柱(250 mm×4.6 mm,5 μm);流动相A相为甲醇,B相为KH2PO4,用磷酸调pH至2.7;流速为1 mL/min,检测器为光电二极管阵列检测器;检测波长为210 nm;进样量为10 μL。
1.3.3 菌株DU-106生长耐受性试验
(1)胆盐的耐受性
以5%接种量接种至含有质量分数为0.3%、0.6%、0.9%猪胆盐的培养基中,以不加猪胆盐的培养基为空白对照,在37 ℃、120 r/min的摇床中进行培养4 h,用平板计数法测定菌落总数。
(2)模拟液的耐受性
在培养基中添加适量模拟胃液,分别接入菌株DU-106、BC30、R11,在37 ℃、120 r/min的摇床中进行培养4 h后,取5 mL样品接入肠液中,以不加模拟液的培养基为空白对照,培养24 h后,测定菌落总数。
(3)pH耐受性
以5%接种量将菌株DU-106、BC30、R11菌种分别加入pH值为2、3、4、5的培养基中,在37 ℃、120 r/min条件下振荡培养1 h、3 h后,分别测定菌落总数。
1.3.4 菌株DU-106抗生素敏感性试验
采用微量肉汤稀释法[11],在96孔板里,1~10孔抗菌药物青霉素G、庆大霉素、克林霉素、头孢曲松、加替沙星、环丙沙星、链霉素、四环素、阿莫西林、阿莫西林/克拉维酸、头孢噻吩、头孢吡肟、利福平、红霉素、氯霉素、诺氟沙星、甲氧氨苄嘧啶/磺胺甲基异恶唑、头孢噻肟、亚胺培南、万古霉素、磷霉素、硫酸卡那霉素、氨苄西林、蔡啶酮酸等24种,2倍稀释,第11孔加菌不加药作为生长对照,第12孔两者都不加作为空白对照。每种抗菌药物做两个重复。将用直接菌悬液法制备浓度为0.5麦氏(相当于1.5×108CFU/mL)的菌悬液,经MH肉汤(Mueller-Hinton Broth)培养基1∶20稀释后加入1~11孔。密封后置35 ℃生化培养箱中,孵育48 h判断结果。第1孔至第10孔药物质量浓度分别为128 μg/mL、64 μg/mL、32 μg/mL、16 μg/mL、8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL。
1.3.5 数据处理
利用SPSS version 22.0进行差异显著性分析,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 菌株DU-106的生长曲线和产酸曲线
2.1.1 菌株DU-106的生长曲线
由图1可知,菌株DU-106的OD600nm值随发酵时间增加呈逐步上升的趋势,OD600nm值由0增加至2左右。发酵时间为0~12 h,OD600nm值几乎没有增加,这是由于菌株刚刚接种到培养基中,正在缓慢适应生长环境,不断地吸收营养物质来生长繁殖,这是菌株DU-106的生长迟缓期。发酵时间为12~36 h,OD600nm值急剧增加,这是由于菌株DU-106逐渐适应环境,经历指数增长阶段,不断地生长繁殖,这是菌株DU-106的对数生长期。发酵时间为36~48 h,OD600nm值增加相对缓慢,最后趋于稳定,这是因为菌株DU-106菌落数前期急剧增加,对营养物质的消耗造成营养物质缺乏、有害代谢产物积累[12]、pH值等条件不适宜,这是菌株DU-106的稳定期。发酵时间为48 h后,菌株DU-106生长不再增加,开始进入衰亡期。综上所述,菌株DU-106在0~12 h处于生长迟缓期,12~36 h处于对数生长期,36~48 h处于稳定期,48~60 h处于衰亡期。
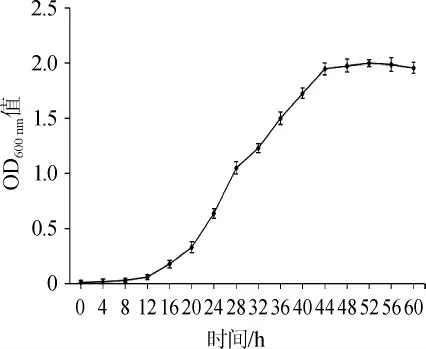
图1 菌株DU-106的生长曲线Fig.1 Growth curve of strain DU-106
2.1.2 菌株DU-106的产酸曲线
菌株DU-106属于产乳酸芽孢杆菌,在适宜的生长条件下,能够产生乳酸,导致培养液pH降低和总酸升高,因此,可以通过pH和总酸的变化了解菌株DU-106的产酸情况[13]。
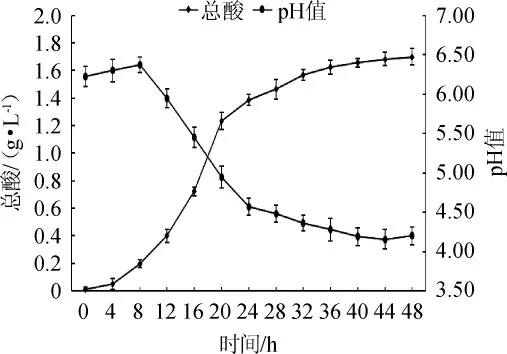
图2 菌株DU-106的产酸曲线Fig.2 Acid production curve of strain DU-106
由图2可知,总酸含量表现出先增加后平稳的趋势,进过36 h发酵,总酸由0增加至1.7 g/L;pH测定表现出先增加后降低再趋向平稳的趋势,pH由6.20上升至6.50,再降低至5.00并保持。0~8 h,总酸增加缓慢,pH值先上升,可能是因为菌株DU-106刚刚接种到MRS培养基中,其代谢系统需要适应新的环境,同时要合成酶、辅酶、其他代谢中间代谢产物等[14],因此,0~8 h是DU-106的迟缓期。8~24 h,总酸急剧增加,pH急剧降低,可能是因为DU-106逐渐适应环境,从环境中获得营养物质,不断地生长繁殖,以及大量产酸。因此,8~24 h是菌株DU-106的对数生长期。24~36 h时总酸继续增加,但是增加的趋势较为缓慢,pH值变化相对缓和,可能进入菌群生长稳定期,但是由于生长空间有限,营养物质不断消耗、有害代谢产物积累、pH值等理化条件不适宜,导致菌落之间进行竞争式生长,不断有新菌产生,也有旧菌凋亡的阶段[15]。36 h后pH和总酸变化不大,表明菌落进入生长稳定期。
2.2 菌株DU-106生长耐受性
2.2.1 胆盐耐受性
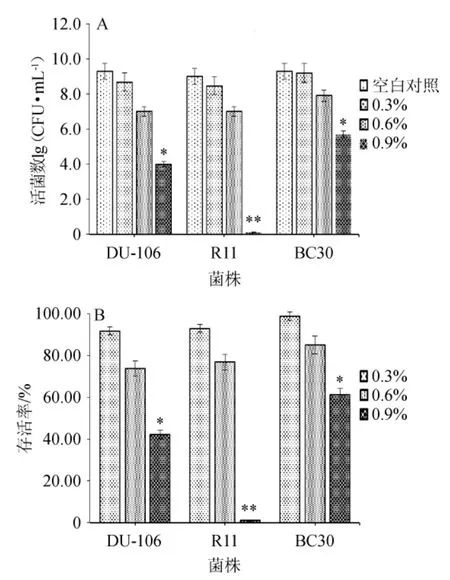
图3 三组菌株经不同浓度的胆盐处理后的活菌数(A)和存活率(B)Fig.3 Viable count (A) and survival rate (B) of three groups of strains treated with different concentrations of bile salt
由图3A可知,菌株DU-106在经过0.3%、0.6%、0.9%浓度的胆盐处理后,活菌数分别为8.7×1010CFU/mL、7.0×1010CFU/mL、4.0×1010CFU/mL。由图3B可知,菌株DU-106在经过0.3%、0.6%、0.9%浓度的胆盐处理后,存活率分别为91.8%、73.9%、42.2%,与空白对照组(9.3×1010CFU/mL)相比,活菌数和存活率均有所下降,而且随着胆盐浓度升高,耐受性显著降低,0.3%胆盐浓度下存活率能超过90%,而在0.9%胆盐浓度下存活率仅有42.2%。同时,对比菌株R11在经过0.3%、0.6%、0.9%浓度的胆盐处理后,活菌数分别为8.5×1010CFU/mL、7.0×1010CFU/mL、未检出,存活率分别为91.8%、73.9%、0,与空白对照组(9.0×1010CFU/mL)相比,活菌数和存活率均有所下降,特别明显的是,菌株R11对0.9%浓度的胆盐不能耐受。而对于凝结芽孢杆菌BC30来说,经过0.3%、0.6%、0.9%浓度的胆盐处理后,活菌数分别为9.2×1010CFU/mL、7.9×1010CFU/mL、5.7×1010CFU/mL,存活率分别为98.9%、84.9%、61.3%,与空白对照组(9.3×1010CFU/mL)相比,在0.3%浓度的胆盐下活菌数和存活率几乎没有变化,而在0.6%和0.9%浓度下则降低,而且随着胆盐浓度升高,耐受性显著降低。众所周知,芽孢杆菌的抗逆性是比较好的,所以菌株BC30对0.3%浓度的胆盐的耐受性也是最好的,存活率达到98.9%。而菌株DU-106组在0.3%浓度下也能保持90%以上的存活率,说明菌株DU-106对0.3%浓度的胆盐具有良好的耐受性。
2.2.2 模拟胃肠液耐受性
经过4 h模拟胃液和肠液处理后,菌株DU-106和其他两株对比菌种的活菌数和存活率见图4。
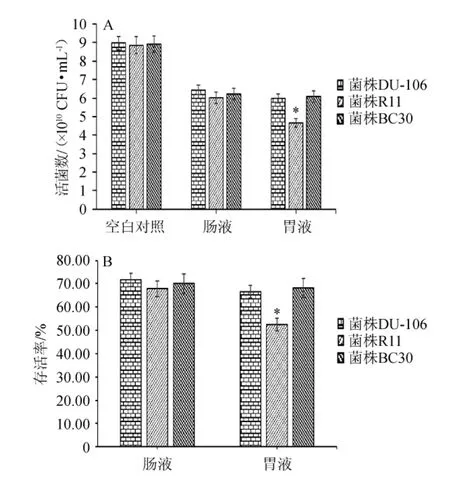
图4 三组菌株经模拟胃液和肠液处理后的活菌数(A)和存活率(B)Fig.4 Viable count (A) and survival rate (B) of three groups of strains treated with simulated gastric juice and intestinal juice
由图4A可知,菌株DU-106、R11、BC30在经胃液处理4 h之后,活菌数均降低,分别由9 CFU/mL降至5.97×1010CFU/mL、4.65×1010CFU/mL、6.07×1010CFU/mL,其中,菌株R11降低幅度最大,菌株DU-106和BC30的活菌数变化不大,均能保持在6×1010CFU/mL左右。再经过肠液处理24 h后测得活菌数有所增加,分别为6.43×1010CFU/mL、6.02×1010CFU/mL、6.23×1010CFU/mL,其中菌株DU-106组经肠液处理后的活菌数要略优于其他两组对比菌株,但都比空白对照组(即MRS培养基组)的活菌数要低。由图4B可知,菌株DU-106经过胃液和肠液处理后仍然能保持66.5%和71.7%的存活率,菌株R11经过胃液和肠液处理后的存活率仅为52.48%和67.95%,菌株BC30进过胃液和肠液处理后的存活率也能达到68.31%和70%。因此,结果表明菌株DU-106对胃液和肠液具有一定的耐受性,在胃液和肠液中能保持良好的存活率,耐受性和存活率相比对比菌株均优异。
2.2.3 酸耐受性
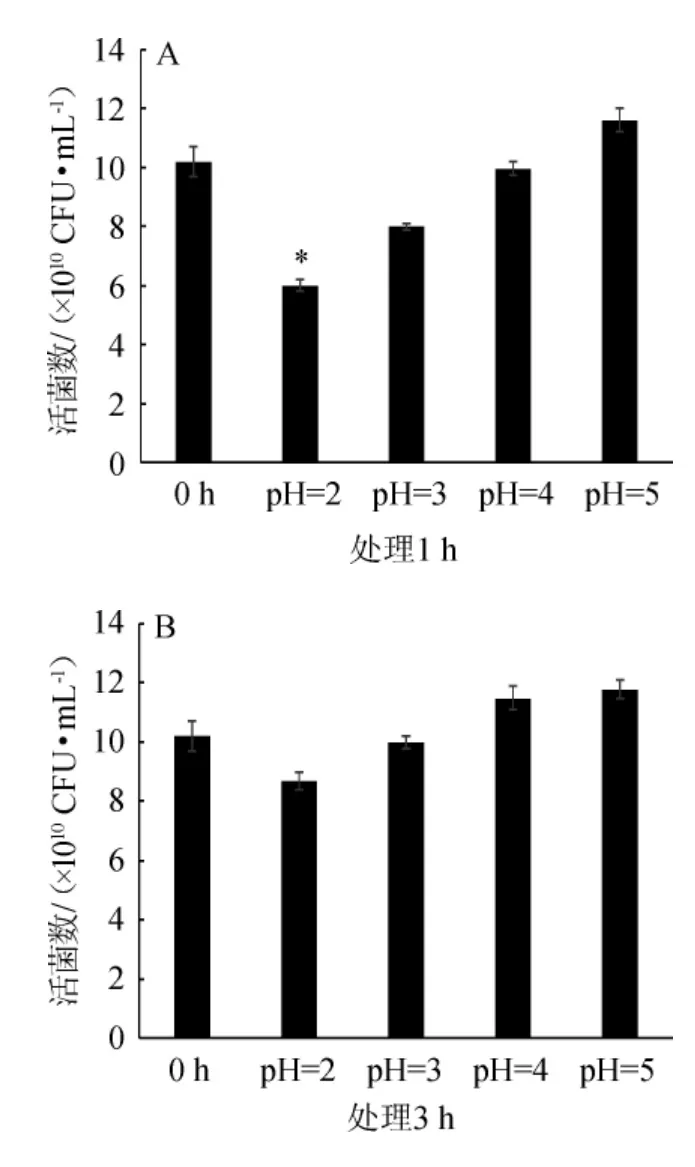
图5 菌株DU-106经过不同pH值处理1 h(A)和3 h(B)后活菌数Fig.5 Viable count of strain DU-106 treated with different pH for 1 h (A) and 3 h (B)
由图5可知,菌株经过不同pH值的环境处理对活菌数的影响不一样,酸性越强,则存活率越低,酸性越弱,存活率越高。由图5A可知,经过1 h处理,在pH值为2、3、4、5中的活菌数分别为6.0×1010CFU/mL、8.0×1010CFU/mL、9.9×1010CFU/mL、11.6×1010CFU/mL,而空白对照的活菌数为10.2×1010CFU/mL,存活率分别为58.8%、78.4%、97.1%和113.7%。由图5B可知,经过3h处理后,在pH值为2、3、4、5中的活菌数分别为8.7×1010CFU/mL、10.0×1010CFU/mL、11.5×1010CFU/mL、11.7×1010CFU/mL,存活率分别为85.3%、98.0%、112.7%和114.7%。由于在pH值较强的环境中仍然存活,所以使得菌株DU-106在经过1 h和3 h处理后的活菌数超过空白对照组,存活率超过100%。结果表明,菌株DU-106在pH值为2的强酸性环境中仍然能保持58%以上的存活率,说明菌株DU-106对强酸环境也具有良好的耐受性。
2.2.4 菌株DU-106抗生素敏感性
试验所用抗菌药物对菌株DU-106的最低抑菌浓度(minimal inhibitory concentration,MIC)见表1。
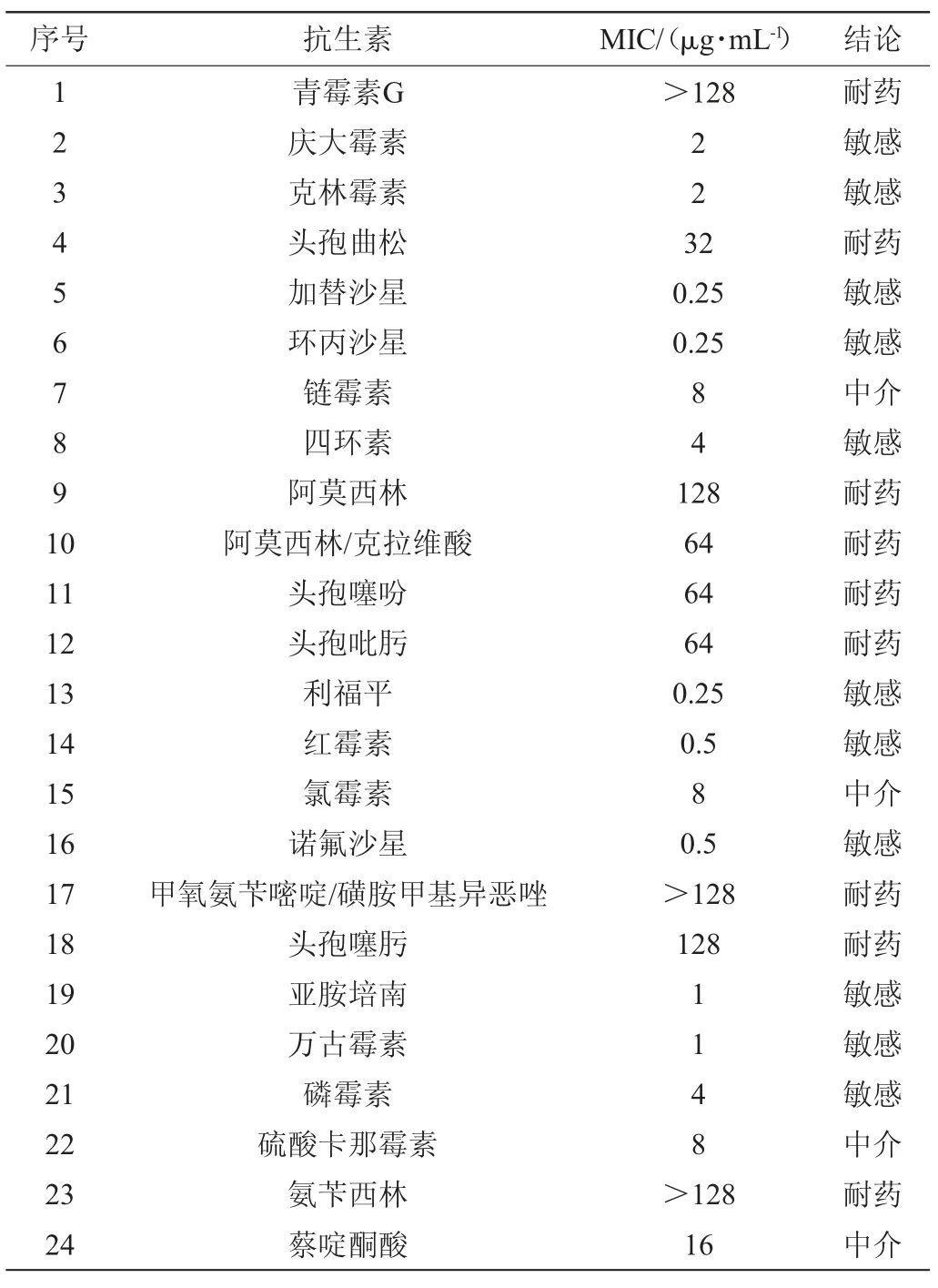
表1 抗生素对菌株DU-106的最小抑菌浓度Table 1 Minimum inhibitory concentration of antibiotics against strain DU-106
由表1可知,菌株DU106敏感的抗菌药物有庆大霉素、四环素、红霉素、克林霉素、万古霉素、诺氟沙星、环丙沙星、加替沙星、克林霉素、磷霉素、亚胺培南11种。处于中介的抗菌药物有链霉素、硫酸卡那霉素、萘啶酮酸、氯霉素4种。耐药的抗菌药物有青霉素G、阿莫西林、阿莫西林/克拉维酸、氨苄西林、头孢噻吩、头孢噻肟、头孢曲松、头孢吡肟、甲氧氨苄嘧啶/磺胺甲基异恶唑9种。菌株DU-106对常用的部分抗生素具有敏感性,在后续的研发和服用中,应尽量避免与敏感性抗生素共同食用。
2.3 菌株DU-106产有机酸结果
菌株DU-106代谢产有机酸的HPLC检测结果见表2。

表2 菌株DU-106代谢产有机酸种类及含量Table 2 Types and contents of organic acids produced by strain DU-106 metabolism
由表2可知,菌株DU-106代谢产生的有机酸种类有乳酸、草酸、苹果酸、乙酸、柠檬酸等有机酸。其中,乳酸含量最高,达6.3 g/kg,其他种类的有机酸含量为草酸0.25~2.7 g/kg。结果表明,菌株DU-106发酵过程中能产生较多的乳酸,具备良好的乳酸发酵特性。
3 讨论
菌株DU-106属于产乳酸芽孢杆菌属,其特点为能够发酵糖类产生大量的乳酸,因此,培养基中的糖类、无机盐等成分对其的生长至关重要。当菌株DU-106拥有适宜生长条件之后,其产酸活动随着菌的生长繁殖也增加,当培养基中的营养物质逐渐被菌株DU-106消耗完毕,以及菌株DU-106的菌数逐渐增加,菌株DU-106的生长和产酸活动也就减少,乳酸积累接近饱和状态,生长进入衰亡期[16]。因此,该菌株在发酵产乳酸时,如果要获得较高的乳酸产量,需要及时补充营养物质。
对于益生菌来说,必须进入人体的胃肠道才能发挥其有益功能,从口腔到人体肠道过程中,人体的胃部是益生菌的必经之路[17],胃液pH的大小由饮食结构不同有所差异,通常在3左右[18],空腹或食用酸性食物时,胃酸pH可达1.5。胆盐是人体内一道重要的消化液,对人体消化吸收营养有着重要的作用。然而,益生菌要达到人体小肠内发挥功效,需要拥有耐受高浓度胆盐的能力[19]。人体小肠中胆酸盐含量在0.03%~0.30%范围内波动[20],而益生菌经摄入后,经过胃和小肠,最终才能定植。菌株DU106在经过模拟胃肠道液和胆盐处理数小时后,仍能保持较高的存活率,说明其具备良好的抗逆性,能够经受住人体胃肠道中的强酸性环境。
4 结论
本实验对乳酸芽孢杆菌DU-106的生长性能进行探讨,通过对其生长曲线、产酸曲线、生长耐受性、抗生素耐受性的研究。结果显示,乳酸芽孢杆菌DU-106具备较好的生长能力、产酸能力和生长耐受性,具有潜在益生菌候选菌株的开发潜力。
