干扰LINC00265上调miR-485-5p的表达影响缺氧诱导的心肌细胞凋亡、增殖机制研究
2021-04-02朱银川王丰云杨雁华宿东升汤建民
朱银川,王丰云,杨雁华,宿东升,汤建民
心肌细胞凋亡参与了多种心血管疾病的发生及发展,如心肌梗死、心力衰竭及心律失常等;因此抑制心肌细胞凋亡,保护正常心肌细胞功能对治疗多种心血管疾病有重要意义[1,2]。研究表明长链非编码RNA(lncRNA)与心血管疾病的发生及发展有关[3]。研究报道LINC00265是缺血性卒中重要的lncRNAs生物标志物[4]。LINC00265在急性心肌梗死患者中上调表达[5]。LINC00265通过使miR-let-7a变海绵促进血管炎症和腹主动脉瘤的形成[6]。然而LINC00265对缺氧诱导的心肌细胞凋亡、增殖的影响及其机制尚不清楚。微小RNA(miRNA)是一类有调控功能的小分子非编码RNA,miRNA与心血管疾病密切相关,参与了心肌肥厚、心肌纤维化、动脉粥样硬化等,可作为一种生物标记物,为疾病诊断与治疗提供新依据[7]。研究报道miR-485-5p过表达可阻止苯肾上腺素诱导的线粒体裂变和心肌肥大[8]。因此本实验旨在研究LINC00265对缺氧诱导的心肌细胞凋亡、增殖的影响及其机制是否与miR-485-5p有关。
1 材料与方法
1.1 实验材料 心肌细胞H9C2购自无锡欣润生物科技有限公司;RPMI-1640培养基、胎牛血清购自;Trizol试剂、反转录试剂盒、SYBR Premix ExTaqTM试剂盒购自日本Takara公司;细胞周期检测试剂盒购自北京凯瑞基生物科技有限公司;膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/PI)凋亡检测试剂盒、双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;RIPA蛋白裂解液、二辛可宁酸(BCA)试剂盒购自厦门慧嘉生物科技有限公司;抗体购自武汉维诺赛生物技术有限公司。
1.2 分组 将H9C2细胞用含10%胎牛血清的RPMI-1640培养液,取对数生长期细胞H9C2,将其置于含95%N2和5%CO2的培养箱中缺氧处理3 h,然后于正常培养条件下培养,记为模型组,正常培养的细胞作为对照组。将LINC00265干扰质粒转染至H9C2细胞后进行缺氧处理,记为模型组+si-LINC00265组;将LINC00265干扰质粒阴性对照转染至H9C2细胞后进行缺氧处理,记为模型组+si-NC组;将miR-485-5p模拟物转染至H9C2细胞后进行缺氧处理,记为模型组+miR-485-5p组;将miR-485-5p模拟物阴性对照转染至H9C2细胞后进行缺氧处理,记为模型组+NC组。
1.3 实时荧光定量PCR(RT-qPCR)检测LINC00265和miR-485-5p的表达水平 提取细胞总RNA,将RNA反转录成cDNA,按照荧光定量试剂盒说明配制反应体系,进行PCR,循环条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。相对表达量用 2-△△Ct法计算。LINC00265和miR-485-5p分别以GAPDH和U6为内参,LINC00265上游引物序列:5"-GG AAGAGAGACTGACTGGGC-3",下游引物序列:5"-GTTTCGCTGTCACCCCTCTG-3";GAPDH上游引物序列:5"-GAAGAGAGAGACCCTCACGCTG-3",下游引物序列:5"-ACTGTGAGGAGGGGAGATTCA GT-3";miR-485-5p上游引物序列:5"-ACACTCC AGCTGGGAGAGGCTGGCCGTGATGAATTC-3",下游引物序列:5"-CTCGATTCGTCACTCACA-3";U6上游引物序列:5"-CGCTTCGGCAGCACATATACT A-3",下游引物序列:5"-CGCTTCACGAATTTGCG TGTCA-3"。
1.4 流式细胞仪检测细胞周期 收集细胞,用预冷的磷酸盐缓冲液(PBS)洗涤3次,离心沉淀细胞,弃上清;然后重悬细胞,加入预冷的80%乙醇,4℃固定过夜;用PBS洗涤细胞3次,加入核糖核酸酶A(RNase A),37℃孵育30 min,加入碘化啶(PI)染色液,4℃染色15 min,上机检测激发波长488 nm处红色荧光,用流式细胞仪和DNA细胞周期分析软件对细胞周期进行分析。
1.5 流式细胞仪检测细胞凋亡 取转染48 h后生长状态良好的细胞,PBS漂洗细胞2次,吸弃PBS液,加1~2 ml胰酶消化细胞使之脱壁,然后加入结合缓冲液终止消化,制成细胞悬液,分别加入Annexin V-FITC和PI各5 μl,轻摇混匀,常温避光孵育15 min,上流式细胞仪检测。
1.6 蛋白质印迹(Western blot)法检测Ki67、Caspase3蛋白表达 用放射免疫沉淀分析裂解液(RIPA)提取细胞总蛋白,BCA法测定蛋白浓度。按照40 μg/孔上样蛋白,进行SDS-PAGE,然后转膜、封闭,洗膜,加入稀释好的一抗(1:500),室温摇床孵育2 h,倒掉一抗,加入按照1:3000稀释的HRP标记的二抗,室温摇床孵育2 h,加入ECL发光液,暗室下显影、定影。Quantity-One软件分析蛋白条带灰度值。蛋白的相对表达量=目的蛋白灰度值/内参GAPDH灰度值。实验重复3次。
1.7 双荧光素酶报告实验验证LINC00265和miR-485-5p的靶向关系 使用PCR扩增包含miR-485-5p结合位点的LINC00265序列片段,并构建至荧光素酶表达载体中,获得LINC00265野生型载体(WT-LINC00265),将LINC00265序列 CAGCCTCT突变为GCCAAGAA,获得LINC00265突变型载体(MUT-LINC00265),将WTLINC00265、MUT-LINC00265分别与miR-NC、miR-485-5p用Lipofectamine 2000脂质体共转染至细胞中,转染48 h后,根据试剂盒说明书检测荧光素酶活性。
1.8 统计学分析 采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差χ2表示,两组比较行t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 RT-qPCR检测LINC00265和miR-485-5p的表达 与对照组比较,模型组LINC00265表达水平升高,miR-485-5p表达水平降低(P<0.05);与模型组+si-NC组比较,模型组+si-LINC00265组LINC00265表达水平降低,miR-485-5p表达水平升高(P<0.05);与模型组+miR-NC组比较,模型组+miR-485-5p组LINC00265表达水平降低,miR-485-5p表达水平升高(P<0.05)(表1)。
表1 LINC00265和miR-485-5p在缺氧诱导的H9C2中的表达(±s,n=3)
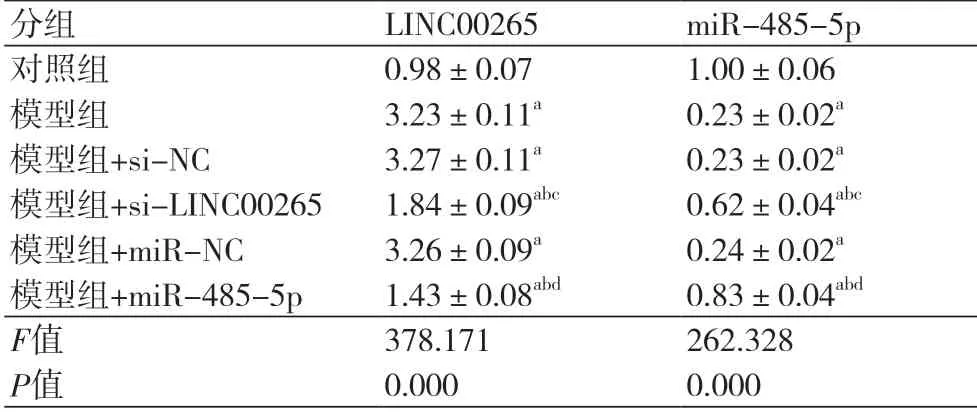
表1 LINC00265和miR-485-5p在缺氧诱导的H9C2中的表达(±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组+si-NC比较,cP<0.05;与模型组+miR-NC比较,dP<0.05
分组 LINC00265 miR-485-5p对照组 0.98±0.07 1.00±0.06模型组 3.23±0.11a 0.23±0.02a模型组+si-NC 3.27±0.11a 0.23±0.02a模型组+si-LINC00265 1.84±0.09abc 0.62±0.04abc模型组+miR-NC 3.26±0.09a 0.24±0.02a模型组+miR-485-5p 1.43±0.08abd 0.83±0.04abd F值 378.171 262.328 P值 0.000 0.000
2.2 细胞周期的检测 与对照组比较,模型组G0-G1期细胞所占比例升高,S期细胞所占比例降低(P<0.05);与模型组+si-NC组比较,模型组+si-LINC00265组G0-G1期细胞所占比例降低,S期细胞所占比例升高(P<0.05);与模型组+miR-NC组比较,模型组+miR-485-5p组G0-G1期细胞所占比例降低,S期细胞所占比例升高(P<0.05);各组间G2-M期细胞所占比例无显著变化(P>0.05)(表2)。
2.3 流式细胞术检测干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2凋亡的影响 与对照组比较,模型组G0-G1期细胞凋亡率升高(P<0.05);与模型组+si-NC组比较,模型组+si-LINC00265组细胞凋亡率降低(P<0.05);与模型组+miR-NC组比较,模型组+miR-485-5p组G0-G1期细胞细胞凋亡率降低(P<0.05)(图1,表3)。
2.4 Western Blotting检测干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2中Ki67、Caspase3的影响 与对照组比较,模型组G0-G1期Ki67表达水平降低,Caspase3表达水平升高(P<0.05);与模型组+si-NC组比较,模型组+si-LINC00265组Ki67表达水平升高,Caspase3表达水平降低(P<0.05);与模型组+miR-NC组比较,模型组+miR-485-5p组Ki67表达水平升高,Caspase3表达水平降低(P<0.05)(图2,表4)。
表2 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2细胞周期的影响(±s,n=3)
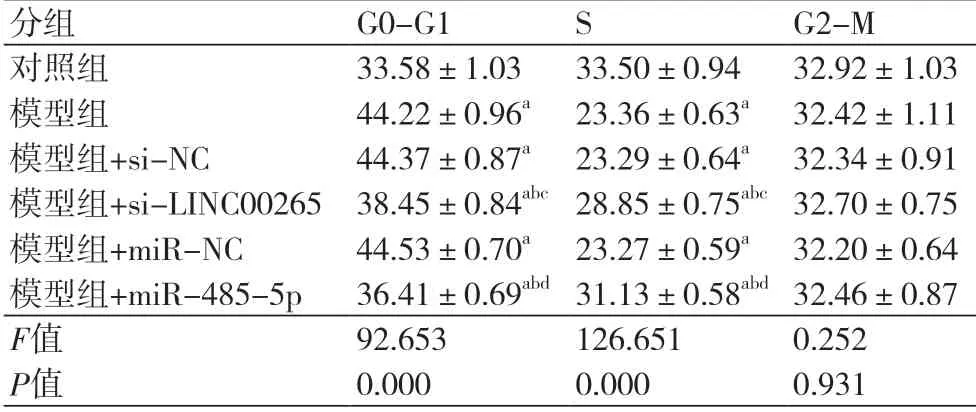
表2 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2细胞周期的影响(±s,n=3)
注: G1:DNA合成前期;S:DNA合成期;G2:DNA合成后期;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组+si-NC比较,cP<0.05;与模型组+miR-NC比较,dP<0.05
分组 G0-G1 S G2-M对照组 33.58±1.03 33.50±0.94 32.92±1.03模型组 44.22±0.96a 23.36±0.63a 32.42±1.11模型组+si-NC 44.37±0.87a 23.29±0.64a 32.34±0.91模型组+si-LINC00265 38.45±0.84abc28.85±0.75abc32.70±0.75模型组+miR-NC 44.53±0.70a 23.27±0.59a 32.20±0.64模型组+miR-485-5p 36.41±0.69abd31.13±0.58abd32.46±0.87 F值 92.653 126.651 0.252 P值 0.000 0.000 0.931
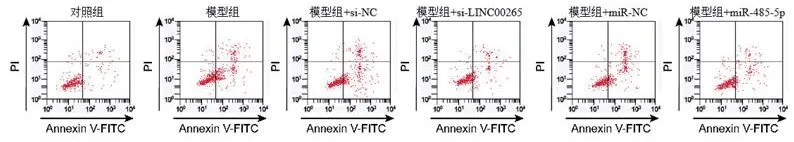
图1 流式细胞术检测H9C2凋亡率
表3 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2凋亡的影响( ±s,n=3)

表3 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2凋亡的影响( ±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组+si-NC比较,cP<0.05;与模型组+miR-NC比较,dP<0.05
分组 凋亡率(%)对照组 7.47±0.48模型组 22.53±1.03a模型组+si-NC 22.60±0.98a模型组+si-LINC00265 images/BZ_113_1690_1559_1690_1564.png16.16±0.70abc模型组+miR-NC 22.62±0.87a模型组+miR-485-5p 11.84±0.58abd F值 198.473 P值 0.000

图2 Western Blotting检测Ki67、Caspase3蛋白的表达
2.5 LINC00265靶向miR-485-5p Starbase数据库预测显示LINC00265与miR-485-5p存在互补的核苷酸序列(图3)。双荧光素酶报告实验结果显示,WT-LINC00265与miR-485-5p共转染后,与miR-NC共转染后相比,细胞荧光活性降低(P<0.05);MUT-LINC00265与miR-485-5p共转染后细胞荧光活性无显著变化(P>0.05)(表5)。
3 讨论
表4 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2中Ki67、Caspase3的影响(±s,n=3)
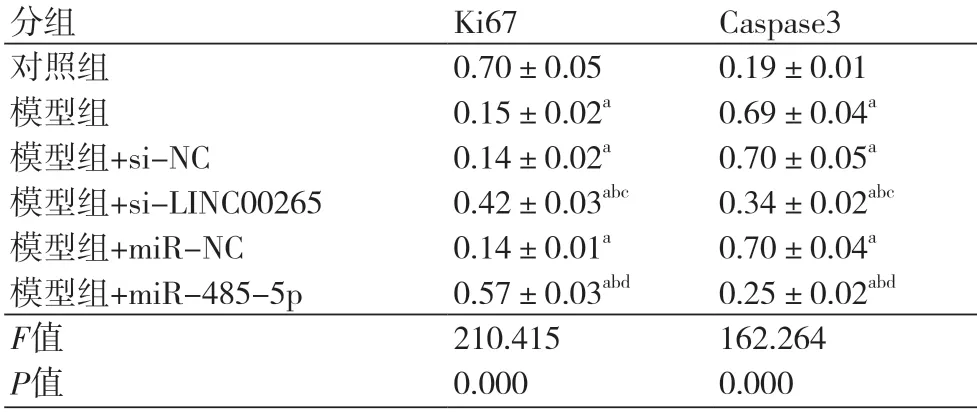
表4 干扰LINC00265和过表达miR-485-5p对缺氧诱导的H9C2中Ki67、Caspase3的影响(±s,n=3)
注:Ki67:核增殖抗原;Caspase3:半光酰天冬氨酸特异性蛋白酶3;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组+si-NC比较,cP<0.05;与模型组+miR-NC比较,dP<0.05
分组 Ki67 Caspase3对照组 0.70±0.05 0.19±0.01模型组 0.15±0.02a 0.69±0.04a模型组+si-NC 0.14±0.02a 0.70±0.05a模型组+si-LINC00265 0.42±0.03abc 0.34±0.02abc模型组+miR-NC 0.14±0.01a 0.70±0.04a模型组+miR-485-5p 0.57±0.03abd 0.25±0.02abd F值 210.415 162.264 P值 0.000 0.000

图3 LINC00265靶向miR-485-5p
表5 双荧光素酶报告实验(±s,n=3)
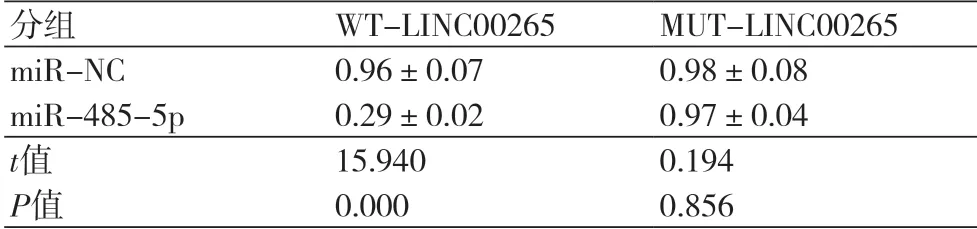
表5 双荧光素酶报告实验(±s,n=3)
注:WT-LINC00265:野生型LINC00265;MUT-LINC00265:突变型LINC00265
分组 WT-LINC00265 MUT-LINC00265 miR-NC 0.96±0.07 0.98±0.08 miR-485-5p 0.29±0.02 0.97±0.04 t值 15.940 0.194 P值 0.000 0.856
缺氧是造成心肌细胞凋亡的重要原因,而心肌细胞凋亡引起的心肌损伤是缺血性心肌病发生的重要机制;深入研究缺氧诱导心肌细胞凋亡的分子机制,对相关疾病的治疗具有一定参考意义[9,10]。研究表明lncRNA可参与调控缺血性心肌病的发生和发展,有望成为心血管疾病的新型诊断学标记物或药物治疗靶点[11]。已有研究表明,LINC00265与心肌梗死的发生有关,但具体机制尚不清楚[5]。本实验用缺氧诱导心肌细胞,结果显示,缺氧的确可诱导心肌细胞凋亡;且缺氧诱导的心肌细胞中LINC00265表达水平升高;干扰LINC00265表达后,G0-G1期细胞所占比例降低,S期细胞所占比例升高,细胞凋亡率降低,Ki67表达水平升高,Caspase3表达水平降低。Ki67是一种细胞增殖抗原,其可作为细胞增殖活性的检测指标[12]。Caspase3是细胞凋亡过程中的关键调控因子,其高表达可促进细胞凋亡[13]。本实验结果表明干扰LINC00265可促进细胞增殖,抑制细胞凋亡。
lncRNA与miRNA间存在着相互调控关系,两者间的相互作用参与了众多疾病的发生发展[14]。本实验通过Starbase数据库预测与LINC00265相关的miRNA,结果显示LINC00265与miR-485-5p存在互补的核苷酸序列,双荧光素酶报告实验进一步证实LINC00265靶向调控miR-485-5p。研究报道miR-485-5p通过靶向Rac1/Notch2信号传导保护了神经细胞免受脑缺血/再灌注损伤[15]。miR-485-5p通过调控肿瘤坏死因子受体1型相关的DEATH结构域蛋白(TRADD)保护神经元细胞免于肿瘤坏死因子(TNF-α)诱导的凋亡[16]。本实验结果显示,缺氧诱导的心肌细胞中miR-485-5p表达水平降低,过表达miR-485-5p可降低细胞凋亡率,提高Ki67表达水平,降低Caspase3表达水平。表明表达miR-485-5p可减弱缺氧诱导的心肌细胞凋亡。
综上所述,干扰LINC00265可能通过上调miR-485-5p的表达抑制缺氧诱导的心肌细胞凋亡、促进细胞增殖。
