美人鱼发光杆菌杀鱼亚种LAMP快速检测方法的建立与应用
2021-04-02姚学良蔡琰徐晓丽钟文慧包海岩
姚学良,蔡琰,徐晓丽,钟文慧,包海岩
美人鱼发光杆菌杀鱼亚种LAMP快速检测方法的建立与应用
姚学良,蔡琰,徐晓丽,钟文慧,包海岩*
天津市水产研究所, 天津 300221
建立了美人鱼发光杆菌杀鱼亚种的环介导等温扩增技术(Loop-Mediated Isothermal Amplification, LAMP)。针对基因保守序列的6个区域设计2对特异引物,利用链置换DNA聚合酶(Bst DNA polymerase)在恒温65 ℃下保温40 min。采用钙黄绿素作为显色剂,FTA卡采集病样肝组织中病原菌核酸。结果显示:以基因建立的LAMP方法能够特异性检测美人鱼发光杆菌杀鱼亚种,检测灵敏度为2.6×102cfu/mL。针对美人鱼发光杆菌杀鱼亚种基因建立的LAMP检测方法具有较好的特异性和稳定性,可用于美人鱼发光杆菌杀鱼亚种的野外现场快速检测。
豹纹鳃棘鲈; 美人鱼发光杆菌杀鱼亚种;; LAMP
豹纹鳃棘鲈(Lacépède)俗称东星斑、豹鲙、花斑刺鳃鮨,隶属鲈形目、鮨科、鳃棘鲈属。主要分布于西太平洋至印度洋海区,东至斐济,西到非洲东岸,红海等地,南到澳洲,北自日本南部。该鱼属高档食用鱼类,在国际市场上深受欢迎,市场前景广阔,同时具有较高的观赏价值。目前对豹纹鳃棘鲈的分子分类、仔鱼的行为、生态学、胚胎发育[1-4]、基础代谢[5],病害防治[6]等进行了详细而深入的研究。然而,随着养殖规模化集约化发展,豹纹鳃棘鲈病害凸显,有关豹纹鳃棘鲈疾病诊断与防治的研究鲜有报道,生产上亟需简便、快速的现场检测病害的方法。
Loop-mediated isothermal amplification,LAMP是2000年由Notomi等[7]发明的一种新型的体外等温扩增特异核酸片断的技术。LAMP是利用靶序列上6个关联区域设计的两对特异引物和1种高活性链置换DNA聚合酶(Bst DNA polymerase),在60 ℃~65 ℃等温条件下,30 min~60 min完成核酸扩增,通过钙黄绿素等颜色反应即时观察检测结果。LAMP技术的关键在于引物靶标基因的选择与引物的筛选。靶标基因要在种内不同菌株间高度保守,在种间变异性较高,一般选取靶基因约130~200 bp的保守序列。同时要注重引物之间的距离、引物退火温度值的高低、引物长度和GC/AT含量等综合因素。2002年,Nagamine等[8]将Loop引物加入到反应中间产物环状物F1、F2(或者B1c、B2c)之间的区域上,减少反应时间。2012年,Tanner等[9]同时进行多个靶基因的多重LAMP检测。自Notomi等[7]发明LAMP技术以来,在水产动物细菌、病毒、寄生虫病原的快速检测中被广泛研究与应用[10-13]。早期诊断对于水生动物疾病的预防具有重要作用,已有传统的检测方法检测时间较长,做不到及时快速,LAMP 法因其简便、快速、灵敏、特异,在水生动物疾病检测中得到广泛应用。在水产养殖细菌性疾病中,针对诺卡氏菌[14]、无乳链球菌[15],鲨鱼弧菌[16]等建立的LAMP,均证实LAMP是一种简单快速的诊断方法。
美人鱼发光杆菌()包括美人鱼发光杆菌美人鱼亚种(subsp)和美人鱼发光杆菌杀鱼亚种。本研究在工厂化养殖的豹纹鳃棘鲈中首次分离到美人鱼发光杆菌杀鱼亚种(subsp),经攻毒试验验证了该菌具有致病性。目前对于鱼类美人鱼发光杆菌杀鱼亚种的检测,主要采用传统的细菌分离鉴定、血清学反应和PCR检测技术等[17,18],前者费时且缺乏准确性,后者的应用大大提高了微生物的检测准确性,但需要昂贵的仪器及相关技术人员进行操作,在生产实践中尚未被广泛应用。养殖生产中急需一种能够应用于养殖现场的、操作简便、快速准确的美人鱼发光杆菌杀鱼亚种检测产品。LAMP技术利用链置换DNA聚合酶在等温条件下无需变性即可完成目标病原基因的扩增,在合成新链的同时置换出原链,为下一轮扩增制备模板,基于该原理的环介导等温扩增技术已广泛应用于病原检测,与常规PCR检测技术相比该技术因其对设备的要求低、检测时间短、结果判断简便等在现场操作中的优势突显。本研究旨在建立美人鱼发光杆菌杀鱼亚种的LAMP检测技术,为生产中该病的防治提供简便、快速的诊断方法。
1 材料方法
1.1 菌株
美人鱼发光杆菌杀鱼亚种标准株购自中国普通微生物菌种保藏管理中心。美人鱼发光杆菌杀鱼亚种、无乳链球菌()、柱状黄杆菌()、诺卡氏菌()、哈维氏弧菌()、嗜水气单胞菌()、创伤弧菌()、爱德华氏菌()、维氏气单胞菌(),鳗利斯顿氏菌()参考株为天津市水产研究所保藏。
1.2 主要试剂
DNA ploymerase large fragment购自New England Biolab公司,DL2000 DNA Marker购自大连宝生物工程有限公司,钙黄绿素购自Sigma公司,FTA卡购自GE公司。
1.3 LAMP引物设计合成
采用BLAST软件分析美人鱼发光杆菌杀鱼亚种基因序列,根据LAMP技术引物设计原则筛选出美人鱼发光杆菌杀鱼亚种subsp.(AJ535849.1)基因的核酸序列,针对该片段设计LAMP引物,引物序列见表1。

表 1 美人鱼发光杆菌杀鱼亚种IGS2基因LAMP检测的引物序列
1.4 LAMP反应建立及条件优化
1.4.1 LAMP反应的建立方法参照Notomi等[7],LAMP反应体系25 μL:包括10 mmol/L dNTP 1.5 μL 、10 x Thermo Polbuffer 2.5 μL、模板1 μL、5 μmol/L内引物各1 μL、40 μmol/L外引物各1 μL、8UDNA polymerase 1 μL、钙黄绿素1 μL、ddH2O 14 μL,反映体系于60 ℃孵育40 min,85 ℃终止反应10 min。摇匀反应产物可肉眼判读结果,本研究采用1.5%凝胶电泳分析结果。
1.4.2 条件优化实验优化美人鱼发光杆菌杀鱼亚种LAMP技术扩增条件,包括反应时间(20、30、40、50、60 min)、反应温度(53、56、59、62、65 ℃)、内外引物浓度(0.4, 0.05;0.8, 0.1;1.2L, 0.15;1.6, 0.2 μmol/L),反应产物进行凝胶电泳分析,根据电泳条带,筛选出最佳反应条件。
1.4.3 引物特异性检测根据1.4.1建立的LAMP检测方法分别对美人鱼发光杆菌杀鱼亚种、无乳链球菌、柱状黄杆菌、诺卡氏菌、哈维氏弧菌、嗜水气单胞菌、创伤弧菌、爱德华氏菌、维氏气单胞菌、鳗利斯顿氏菌进行扩增,根据电泳结果筛选出特异性较好的引物。
1.4.4 引物灵敏度验证将28 ℃过夜培养的菌液浓度调整至2.6×108cfu/mL,经10倍梯度稀释分别作模板,按照1.4.1进行LAMP检测灵敏度。同时取浓度2.6×108cfu/mL美人鱼发光杆菌杀鱼亚种培养液1.0 mL,按文献[19]的方法进行梯度稀释、倾注培养,进行细菌计数,验证引物灵敏度的准确性。
1.5 美人鱼发光杆菌杀鱼亚种LAMP技术在现场检测中的应用
对保存的携带美人鱼发光杆菌杀鱼亚种病原的豹纹鳃棘鲈病样进行LAMP检测,健康的豹纹鳃棘鲈作阴性对照。取豹纹鳃棘鲈的肝脏约0.1 g,置于采样管内研磨至浆状。吸取浆状的样品将FTA膜片充分润湿,静置5 min,吸取快速干燥液滴于FTA膜片上,将FTA膜片室温静置5 min后转移至漂洗管内,将漂洗管震荡3 min,再将漂洗管内的FTA膜片转移至扩增检测管内,同步取美人鱼发光杆菌杀鱼亚种标准株制成膜片,做阳性对照。反应体系于65 ℃孵育40 min,85 ℃终止反应10 min。同时取样品鱼肝脏组织接种,进行细菌分离、培养鉴定,用传统的细菌检测方法验证其准确性。
2 结果与分析
2.1 LAMP检测方法的建立
本研究建立了美人鱼发光杆菌杀鱼亚种LAMP检测技术(图1),该技术检测结果通过钙黄绿素显色肉眼可判读,对该技术的反应条件进行优化。试验结果表明,就本研究拟定的反应体系而言,反应温度60 ℃时效果最佳(图2)。反应时间40 min(图3)减少非特异性反应,内外引物浓度0.8 μmol/L,0.1 μmol/L(图4)为最佳。

图 1 美人鱼发光杆菌杀鱼亚种LAMP检测结果
注: M: 分子量标准; 1: 美人鱼发光杆菌杀鱼亚种; 2: 阴性对照
Note: M: Molecular weight standard; 1:subsp.; 2:Negative control
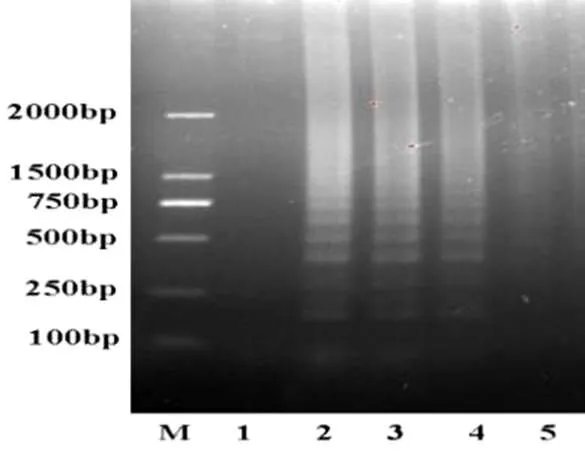
图 2 温度对美人鱼发光杆菌杀鱼亚种LAMP扩增的影响
注: M:分子量标准; 1:53 ℃; 2:56 ℃; 3:59 ℃; 4:62 ℃; 5:65 ℃
Note: M: Molecular weight standard; 1:53 ℃; 2:56 ℃; 3:59 ℃; 4:62 ℃; 5:65 ℃

图 3 时间对美人鱼发光杆菌杀鱼亚种LAMP扩增的影响
注: M:分子量标准; 1:20 min; 2:30 min; 3:40 min; 4:50 min; 5:60 min
Note: M: Molecular weight standard; 1:20 min; 2:30 min; 3:40 min; 4:50 min; 5:60 min

图 4 内外引物浓度对美人鱼发光杆菌杀鱼亚种LAMP的影响
注:M:分子量标准; 1: 0.4 μmol/L, 0.05 μmol/L; 2: 0.8 μmol/L, 0.1 μmol/L; 3: 1.2 μmol/L, 0.15 μmol/L; 4: 1.6 μmol/L, 0.2 μmol/L
Note: M:Molecular weight standard;1: 0.4 μmol/L,0.05 μmol/L; 2: 0.8 μmol/L,0.1 μmol/L; 3: 1.2 μmol/L,0.15 μmol/L; 4: 1.6 μmol/L,0.2 μmol/L
2.2 引物特异性检测
按照1.4.1建立的扩增方法,对海豚链球菌、柱状黄杆菌、哈维氏弧菌、维氏气单胞菌、诺卡氏菌、美人鱼发光杆菌杀鱼亚种扩增,除美人鱼发光杆菌杀鱼亚种外其他病原菌均呈阴性反应(图5)。
2.3 引物灵敏度检测
菌液浓度从2.6×108cfu/mL稀释至2.6×101cfu/mL,2.6×101cfu/mL浓度为模板进行LAMP扩增无产物。计数结果表明:1×106倍稀释的细菌培养液的菌浓度为2.6×102cfu/mL,即美人鱼发光杆菌杀鱼亚种LAMP检测技术的灵敏度为2.6×102cfu/mL(图6)。

图 5 美人鱼发光杆菌杀鱼亚种 LAMP特异性试验结果
注: M: 分子量标准; 1-8分别为美人鱼发光杆菌杀鱼亚种标准菌株、美人鱼发光杆菌杀鱼亚种、阴性对照、海豚链球菌、柱状黄杆菌、维氏气单胞菌、哈维氏弧菌、诺卡氏菌
Note:M: Molecular weight standard; 1-8 such assubsp.standard strain,subsp.Negative control,,

图 6 美人鱼发光杆菌杀鱼亚种LAMP灵敏度的检测结果
注: M: 分子量标准; 1: 2.6×101cfu/mL; 2: 2.6×102cfu/mL; 3: 2.6×103cfu/mL; 4: 2.6×104cfu/mL; 5: 2.6×105cfu/mL; 6: 2.6× 106cfu/mL; 7: 2.6×107cfu/mL; 8: 2.6×108cfu/mL
Note: M: Moelcular weight standard; 1: 2.6×101cfu/mL; 2: 2.6×102cfu/mL; 3: 2.6×103cfu/mL; 4: 2.6×104cfu/mL; 5: 2.6×105cfu/mL; 6: 2.6× 106cfu/mL; 7: 2.6×107cfu/mL; 8: 2.6×108cfu/mL
2.4 美人鱼发光杆菌杀鱼亚种LAMP检测技术的准确性验证
对取自美人鱼发光杆菌杀鱼亚种攻毒的豹纹鳃棘鲈的肝脏组织进行LAMP技术检测应用,结果表明:该技术检测结果与同步取样进行的细菌分离鉴定结果一致(图7),验证该技术的准确性,该技术比普通PCR灵敏度高10倍~100倍,可以在病害流行之前检测养殖鱼类携带病原菌的情况,有利于及时采取有效防控措施,做到早发现早治疗,减少经济损失。

图 7 采用FTA卡提取豹纹鳃棘鲈肝组织中美人鱼发光杆菌杀鱼亚种DNA进行LAMP检测
注:M:分子量标准; 1:阴性对照; 2: 阳性对照(带有美人鱼发光杆菌杀鱼亚种的FTA卡做模板); 3: FTA卡提取病鱼肝组织中美人鱼发光杆菌杀鱼亚种做模板
Note: M: molecular weight standard; 1: Negative control; 2: positive control(FTA card withsubsp.); 3: FTA card with liver of thesubsp.disease fish
3 讨论
美人鱼发光杆菌杀鱼亚种为一种具溶血性的革兰氏阴性短杆状或球杆菌,有荚膜,感染宿主无特异性,对多种养殖鱼类均有致病性。1963年,美人鱼发光杆菌杀鱼亚种被报道,曾命名为巴斯德氏菌()[20]、杀鱼巴斯德氏菌()[21],Nicolas等基于rRNA研究又将杀鱼巴斯德氏菌划分为美人鱼弧菌,后经Ruimy等[22-25]多位科学家先后研究将其命名为美人鱼发光杆菌杀鱼亚种(subsp)。后Truper将“”修正为“”,即subsp。美人鱼发光杆菌杀鱼亚种对多种养殖鱼类均有高致病性,最早在美洲狼鲈()和条纹狼鲈()[20]野生种群中分离到,命名为杀鱼巴斯德氏菌(),后陆续在黄尾鰤()[26]、黑鲷()[27]、杂交条纹鲈()[28]等发病,在国内,已从发病的半滑舌鳎()[29]、龙胆石斑鱼()[30]、大黄鱼[17]等分离到该菌,是养殖鱼类的重要致病菌之一,一旦发病,可造成较高的死亡率。为了更好地用于养殖现场疾病的快速检测,亟需美人鱼发光杆菌杀鱼亚种的快速检测技术。
LAMP技术是2000年Notomi等[7]建立的等温链置换扩增核酸的方法,近年来被广泛研究、应用于各领域。该技术具有检测速度快、灵敏度高、特异性强、产物检测简单、操作简单等优点。目前尚未有关于美人鱼发光杆菌杀鱼亚种LAMP检测技术的报道。
找到美人鱼发光杆菌杀鱼亚种的特异性基因片段是LAMP技术成功与否的关键。细菌rDNA基因的5'端到3'端分别是16S rDNA、间区、23S rDNA、间区和5S rDNA。没有特定功能的16S-23S rDNA间区(intergenic spaser)进化速率比16S rDNA大10倍之多。随着测序技术的快速发展,所有细菌的序列被越来越多地发掘出来,因此序列在细菌鉴定方面倍受关注。利用PCR技术扩增序列鉴别细菌不同种之间,甚至同一种内的差异[34-34]成为可能。在小麦叶锈菌中存在多态性[35],付华娥等利用细菌通用引物对细菌的16S-23SrDNA间区进行PCR扩增、测序,BLAST比对结果为嗜水气单胞菌[36]。因此,本研究利用美人鱼发光杆菌杀鱼亚种的序列设计了LAMP检测引物,并建立了该病原菌鉴定的方法。特异性检测结果显示:仅美人鱼发光杆菌杀鱼亚种扩增出特异性片段,而其他的致病菌株扩增不出该片段,证明基因作为美人鱼发光杆菌杀鱼亚种鉴定依据的可行性。
本研究针对美人鱼发光杆菌杀鱼亚种LAMP技术反应温度、内外引物浓度及反应时间等条件进行优化,确定了最佳检测条件,进而建立了较稳定且特异性较好的美人鱼发光杆菌杀鱼亚种LAMP检测体系。温度优化实验显示60 ℃电泳条带最清晰,而且温度高可以增加引物的特异性,故反应温度确定为60 ℃。反应时间在20 min和30 min无电泳条带,40 min时电泳条带清晰,50 min和60 min电泳条带并未明显增加亮度,LAMP技术反应时间越短,可以避免非特异性扩增条带的产生,因此检测时间定为40 min。内外引物浓度参照[7]采用内引物、外引物8:1的比例,在内外引物浓度比例不变情况下,以不同引物浓度梯度进行优化试验。根据反应结果将反应内外引物浓度为0.8 μmol/L,0.1 μmol/L时可以看到清晰的条带,为提高引物的特异性,选择该浓度作为反应引物浓度。本研究以钙黄绿素做为染料加入反应体系[37],自反应开始至结果判读无需再打开反应管,避免了因开盖形成气溶胶而导致的假阳性。现场应用采用FTA卡,FTA卡可以快速提取核酸,只需将样品组织涂在FTA卡上,再进行简单操作即可,大大缩短了样品的处理时间,进而保证从样本处理到结果判读仅需1 h。综上,本研究建立的豹纹鳃棘鲈美人鱼发光杆菌杀鱼亚种的快速检测技术,具有高效快速、判读简单、操作简便的特点,普通养殖人员经过简单培训可完成操作,因此该技术在野外现场检测方面具有很好的应用前景。
[1] Zhu ZY, Yue GH. The complete mitochondrial genome of red grouper Plectropomus leopardus and its applications in identification of grouper species [J]. Aquaculture, 2008,276(1-4):44-49
[2] Leis JM, Carson-ewart BM. In situ swimming and settlement behaviors of larvae of an Indo-Pacific coral-reef fish, the coral trout(Pisces:) [J]. Marine Biology, 1999,134(1):51-64
[3] Kenzo Y, Kazuhisa Y, Kimio A,. Influence of light intensity on feeding, growth, and early survival of leopard coral grouper () larvae under mass-scale rearing conditions [J]. Aquaculture, 2008,279(1-4):55-62
[4] 王永波,陈国华,林彬,等.豹纹鳃棘鲈胚胎发育的初步观察[J].海洋科学,2009,33(3):21-26
[5] 姚学良,蔡琰,张振奎,等.温度对豹纹鳃棘鲈幼鱼呼吸代谢的影响[J].天津农学院学报,2014,21(1):23-27
[6] 姚学良,徐晓丽,张振奎,等.豹纹鳃棘鲈病原鳗利斯顿氏菌的分离鉴定及生物学特性研究[J].中国海洋大学学报,2015,45(5):39-45
[7] Notomi T, Okayama H, Masubuchi H,. Loop-mediated isothermal amplification of DNA [J]. Nucleic Acids Research, 2000,28(12):e63
[8] Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplication using loop primer [J]. Molecular and Cellular Probes, 2002,16:223-229
[9] Tanner NA, Zhang Y, Evans TC. Simultaneous multiple target detection in real-time loop-mediated isothermal amplification [J]. Biotechniques, 2012,53(2):81–89
[10] Itano T, Kawakam IH, Kono T,. Detection of fish nocardiosis by loop mediated isothermal amplification [J]. J App Microbiol, 2006,100(6):1381-1387
[11] Cai SH, Lu YS, Wu ZH,. Loop-mediated isothermal amplification method for rapid detection of, the causative agent of vibriosis in mariculture fish [J]. Applied Mrcobiology, 2010,50(5):480-485
[12] He L, Xu HS. Development of a multiplex loop-mediated isothermal amplification (mLAMP) method for the simultaneous detection of white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus in penaeid shrimp [J]. Aquaculture, 2011,311:94-99
[13] Eimatboul IM, Soliman H. Rapid diagnosis of Tetracapsuloides bryosalmonae, the causative agent of proliferative kidney disease ( PKD) in salmonid fish by a novel DNA amplification method, loop mediated isothermal amplification (LAMP) [J]. Parasitol Res, 2005,96(4) :277-284
[14] 王国良,刘璐,徐益军.鱼类致病鰤鱼诺卡氏菌(Nocardia seriolae)的LAMP检测技术建立与应用[J].海洋与湖 沼,2011,42(1):27-31
[15] 姚学良,徐晓丽,李贺密,等.红尾皇冠鱼无乳链球菌病LAMP检测方法的建立与应用[J].大连海洋大学学报,2014,29(6):561-565
[16] 刘金叶,冯娟,刘广峰,等.鲨鱼弧菌LAMP检测方法的建立广东农业科学[J].2012,39(3):146-149
[17] 张飞,苏永全,王军,等.大黄鱼(Pseudosciaena crocea)源美人鱼发光杆菌杀鱼亚种()的分 离鉴定及致病性研究[J].海洋与湖沼,2012,43(6):1202-1208
[18] 王瑞旋,冯娟,苏友禄,等.卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国水产科学,2010,17(5):1020-1027
[19] 中华人民共和国卫生部.食品卫生微生物学检验菌落总数测定GB/T4789.2-2003[S].北京:中国标准出版社,2003
[20] Snieszko SF, Bullock GL, Hollis E,.sp. from an epizootic of white perch () in Chesapeake Bay tidewater areas [J]. Journal of Bacteriology, 1964,88:1814-1815
[21] Janssen WA, Surgalla MJ. Morphology, physiology, and serology of Pasteurella species pathogenic for white perch [J]. Journal of Bacteriology, 1968,96:1606-1610
[22] Gauthier G, Lafay B, Ruimy R,. Phylogenetic analysis and assessment of the genera,,, anddeduced from small-subunit rRNA sequences [J]. Internarional Journal of Systermatic Bacterology, 1994,44:416-426
[23] Gauthier G, Lafay B, Ruimy R,. Small-subunit rRNA sequences and whole DNA related ness concur for the reassignment of(Sniezsko.) Janssen and Surgalla to the genussubspcomb. nov [J]. Journal of Systermatic Bacterology, 1995,45:139-144
[24] Smith SK, Sutton DC, Fuerst JA,. Evaluation of the genusand reassignment of(Love.) MacDonell and Colwell to the genuscomb. nov. with an emended description [J]. Internarional Journal of Systermatic Bacterology, 1991,41:529-534
[25] Osorio CR, Collins MD, Toranzo AE,. 16S rRNA gene sequence analysis ofand nested PCR method for rapid detection of the causative agent of fish pasteurellosis [J]. Applied and Environmental Microbiology, 1999,65:2942-2946
[26] Kubota S, Kimura M, Egusa S. Studies of a bacterial tuberculoidosis of the yellowtail.I.Symptomatology and histopathology [J]. Fish Pathology, 1970,4:11-18
[27] Ohhi K, Watanabe K, Jo Y. Pasteurella infection in young black sea bream [J]. Fish Pathology, 1982,16:207-210
[28] Hawke JP. Pathogenesis and virulence ofin hybrid striped bass (×) [C]. Seattle Washington: International Symposium on Aquatic Animal Health, 1994:116
[29] Wang Y, Han Y, Li Y,. Isolation ofsubsp.from diseased tongue sole (Gunther) in China [J]. Acta Microbiologica Sinica, 2007,47(5):763-768
[30] 张晓君,秦国民,陈翠珍,等.龙胆石斑鱼源美人鱼发光杆菌杀鱼亚种的生物学特性与系统发育学分析[J].渔业科学 进展,2009,30(3):38-43
[31] Lee SKY, Wang HZ, Law SHW,. Analysis of the16S-23SrDNA Inter genic spacers (IGSs) of marine vibrios for species-specific signature DNA sequences [J]. Mairne Pollut Bull, 2002,44:412-420
[32] Luz SP, Rodrtguez-Valera F, Lan R,. Variation of the ribosomal operon 16S-23S gene spacer region in representatives ofsub species [J]. Journal of Bacteriology, 1998,180:2144-2151
[33] Chun J, Hu QA, Colwell R. Analysis of 16S-23SrDNA intergenic spacer regions ofand[J]. Applied Environmental Microbiology, 1998,65:2202-2208
[34] Gurtler V, Stanisich VA. New approached to typing and identification of bacteria using the 16S-23S rDNA spacer region [J]. Micorbiology, 1996,142:3-16
[35] 杜冬冬,张毓妹,张河山,等.IGS在小麦叶锈菌中的多态性分析初探[J].华北农学报,2015,30(5):51-56
[36] 付华娥,陈天林.一株病原菌的API生化鉴定及其16S-23SrDNA间区序列分析[J].职业与健康,2010,26(13):1478-1480
[37] 张琳,马利,丁雅苓,等.基于荧光显色的IBVLAMP检测方法研究[J].西北农林科技大学学报,2012,40(10):38-44
Establishment of the Rapid Detection Method by Loop-Mediated Isothermal Amplification forsubspand Its Application
YAO Xue-liang, CAI Yan, XU Xiao-li, ZHONG Wen-hui, BAO Hai-yan*
300221,
A Loop-mediated isothermal amplification (LAMP) assay was developed and validated for the specific detection of Photobacterium damselae subsp. piscicida of Plectropomus leopardus Lacépède. The IGS2 gene of P. damselae subsp. piscicida was amplified by a set of two pairs specially primers that recognize six distinct sequences of the target.The amplification can be amplified in 40 min by incubating all of the reagents in a single tube with Bst DNA polymerase in a constant temperature of 65 ℃.The resulting amplicons are visualized by adding calcein to the reaction tube. FTA cards was for collection and purification of nucleic acids from a liver with pathogenic bacteria in field applications.The sensitivity of LAMP with detection limits of 2.6×102 cfu/mL. Our results clearly demonstrate that the LAMP-based assay is a sensitive and reliable means for the detection of P. damselae subsp. piscicida,which show that the LAMP assay is suitable for on-site rapid diagnosis.
Lacépède;subsp.gene; Loop-mediated isothermal amplification (LAMP)
S941.42
A
1000-2324(2021)01-0007-06
10.3969/j.issn.1000-2324.2021.01.002
2018-12-20
2019-01-14
天津市科技支撑计划项目(12ZCZDNC00900)
姚学良(1982-),女,硕士,高级工程师,主要从事水产动物病害防治及技术研究与推广工作. E-mail:tjyaoxueliang@126.com
Author for correspondence. E-mail:sscstgk@tj.gov.cn
