多孢木霉HZ-31菌株侵染对野燕麦生理机制的影响
2021-04-01朱海霞马永强咸文荣
朱海霞,马永强,咸文荣
(青海大学农林科学院,青海大学省部共建三江源生态与高原农牧业国家重点实验室,农业农村部西宁作物有害生物科学观测实验站,青海省农业有害生物综合治理重点实验室,青海 西宁810016)
植物被各类病原物侵染后,体内发生一系列具有共同特点的生理变化[1]。植物细胞的细胞膜透性改变是侵染初期重要的生理病变,继而出现光合作用、蛋白质、酚类物质、生理方面的变化。研究植物的生理病变对了解寄主—病原物的相互关系具有重要意义。
与病原物长期协同进化过程中,植物形成了一系列复杂的防御机制抵御病原物的入侵。许多植病学者由此开始探讨病菌致病机制和寄主植物的抗病机制,其中许多与植物抗病性有关的酶类如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及抗病过程中的产物等是许多学者研究的重点方向[2]。这些酶类可以在植物与病原物互作的过程中参与植物抗病次生物质的合成,或参与植物体内活性氧自由基(ROS)代谢,或直接抑制杀死病原物,使植物获得抗性[3]。植物对病原物侵入的生理反应是通过酶的催化活动实现的,随着病原物的深度侵染,亦会导致抗菌酶类失活。病原真菌侵染能够打破寄主植物原有的激素平衡,致使寄主生长异常,通过破坏寄主细胞膜的正常结构和细胞的正常代谢,最终导致寄主细胞死亡。
本研究选用青海农田常见杂草野燕麦作为靶标受体,盆栽接种多孢木霉HZ-31菌株后测定对其各种生理指标的影响,分析寄主与病原菌相互作用的生理变化机制,以期明确除草机理。
1 材料与方法
1.1 供试菌株
多孢木霉HZ-31菌株由青海省农业有害生物综合治理重点实验室提供,并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.12867。
1.2 供试植物
野燕麦种子。
1.3 试剂药品
丙二醛(MDA)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、多酚氧化酶(PPO)活性、苯丙氨酸酶(PAL)活性、超氧化物歧化酶(SOD)活性、可溶性糖含量和叶绿素含量采用南京建成生物工程研究所研制的试剂盒进行测定。
1.4 HZ-31菌株接种野燕麦试验
野燕麦种子播种于直径15 cm的塑料盆中,土壤有机质含量17.04 g·kg-1,pH值8.18,每盆播种25粒,室内培养,株高8~10 cm进行盆栽接种试验。将HZ-31菌株于PDB培养液发酵培养7 d,稀释成浓度为1.0×108mL-1的孢子液,加入适量0.05% (V/V)吐温20作为润湿剂,喷雾接种到野燕麦植株上,接种量为每盆30 mL。接种后100%的相对湿度保持24 h,随后自然培养。以接种清水的植株作空白对照,分别在接种后1~7 d取样,剪取地上部分,速冻于-80 ℃冰箱。
1.5 HZ-31菌株对野燕麦植株生理机制的影响
按照试剂盒步骤,进行HZ-31菌株接种野燕麦后植株体内不同生理指标测定。包括处理组和对照组野燕麦叶片的丙二醛(MDA)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、多酚氧化酶(PPO)活性、苯丙氨酸酶(PAL)活性、超氧化物歧化酶(SOD)活性、可溶性糖含量和叶绿素含量。
1.6 数据处理
试验数据运用SPSS数据分析软件进行处理和分析,采用最小差数法(LSD)进行差异显著性分析。
2 结果与分析
2.1 多孢木霉HZ-31菌株侵染野燕麦变化
接种HZ-31菌株后3 d,野燕麦叶片发黄,出现萎蔫(图1-a);接种5 d后,萎蔫程度加重,叶片枯萎(图1-b),7 d后整株枯死(图1-c)。
2.2 野燕麦体内生理机制变化
2.2.1 丙二醛(MDA)含量测定分析
图2显示,处理组野燕麦丙二醛(MDA)含量整体呈先增长后降低趋势,含量大幅度变化;处理组燕麦MDA含量整体变化趋势较对照变化幅度小。侵染后1~3 d,对照组与处理组均呈先增长后降低趋势,第2天达到最高值,对照组的MDA含量大幅度增长,高于处理组。第5~7天,处理组MDA含量较大幅度降低,第7天为测量最低值,且趋近于0;对照组处于先平稳后增长状态。说明野燕麦受到HZ-31菌株侵染后,1~3 d植株体内丙二醛含量大幅度增长,处理组植株产生更多的MDA来抵御外界刺激。而在侵染3 d后,丙二醛含量降低,一定程度上反映活性氧损伤的加剧,植物细胞膜遭受破坏。
2.2.2 过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性测定分析
由图3-A可看出,接种后1~3 d,对照组CAT含量呈增长趋势,处理组出现急剧增长后下降。在4~7 d,处理组CAT含量稳步下降,而对照组CAT活性变化呈下降增长再下降的波动。对照组野燕麦CAT活性整体变化波动较大,比较活跃;处理组野燕麦CAT活性变化则波动较小,先大幅度上升然后一直下降。处理组野燕麦过氧化氢酶(CAT)活性整体处于降低状态,说明受HZ-31菌株侵染后,野燕麦体内保护酶CAT活性迅速下降,对外界不利因素的抵御能力迅速下降。
图3-B显示,对照组和处理组野燕麦的过氧化物酶(POD)活性趋势基本一致,处理组的POD活性始终高于对照组。处理组2~5 d、对照组3~6 d野燕麦体内POD活性保持平稳状态。说明HZ-31菌株侵染野燕麦对过氧化物酶(POD)有促进作用,活性增加。
图3-C显示,对照组野燕麦SOD活性呈“M”型变化,且1~5 d SOD活性低于处理组,处理组野燕麦超氧化物歧化酶(SOD)活性最高值出现在第2天。说明野燕麦受HZ-31菌株侵染刺激后SOD活性增加,以此帮助植物抵御菌株侵染,之后则受到菌株侵染的破坏,含量减少、活性降低。
2.2.3 多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性测定分析

图1 野燕麦接种HZ-31后3、5、7 d的生长表现Fig.1 Growth performance of Avena fatua L. 3, 5 ,7 days after HZ-31 inoculation
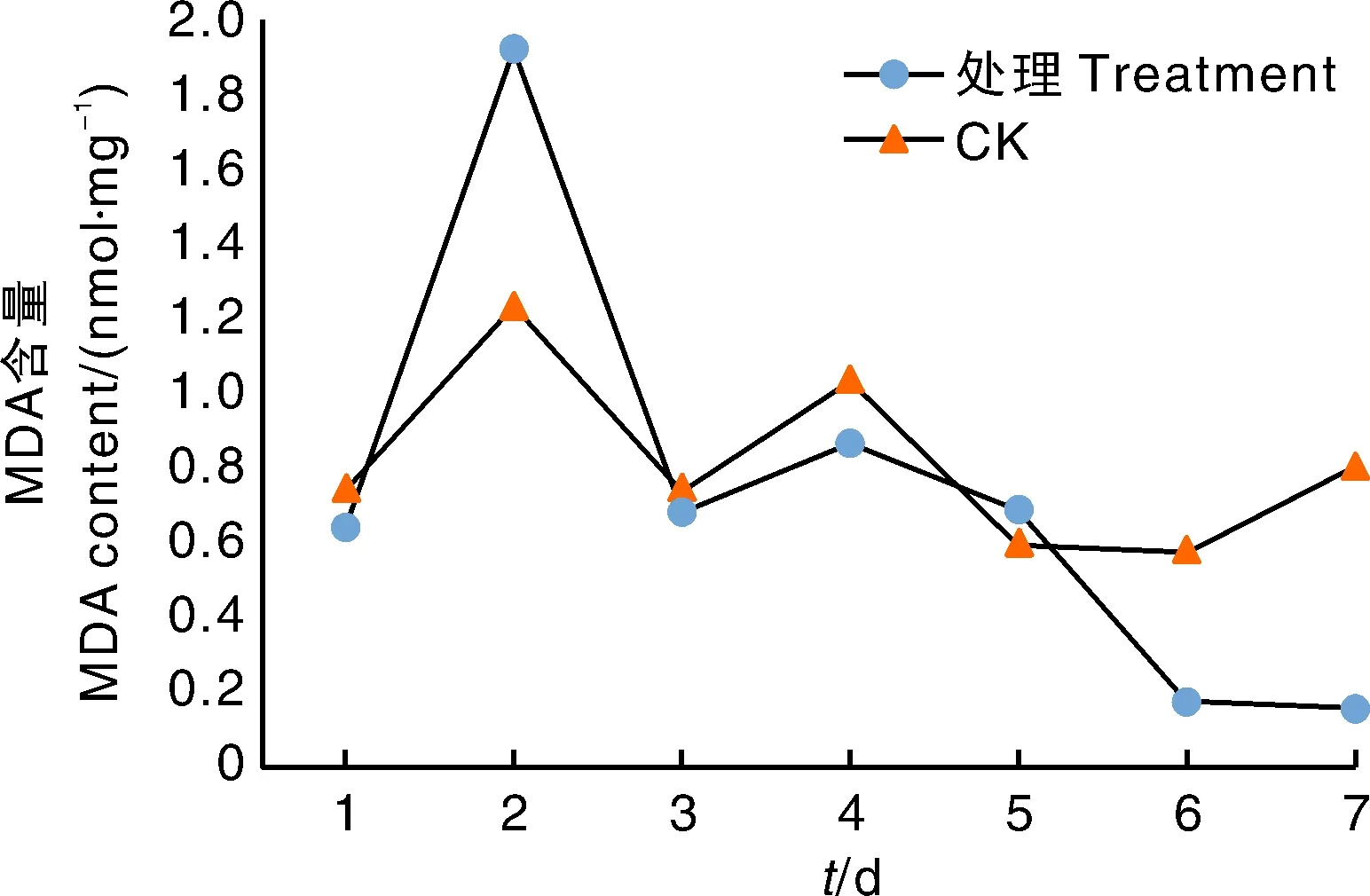
图2 接种HZ-31后野燕麦丙二醛(MDA)含量变化分析Fig.2 Analysis of the changes of MDA content in A. fatua after HZ-31 inoculation
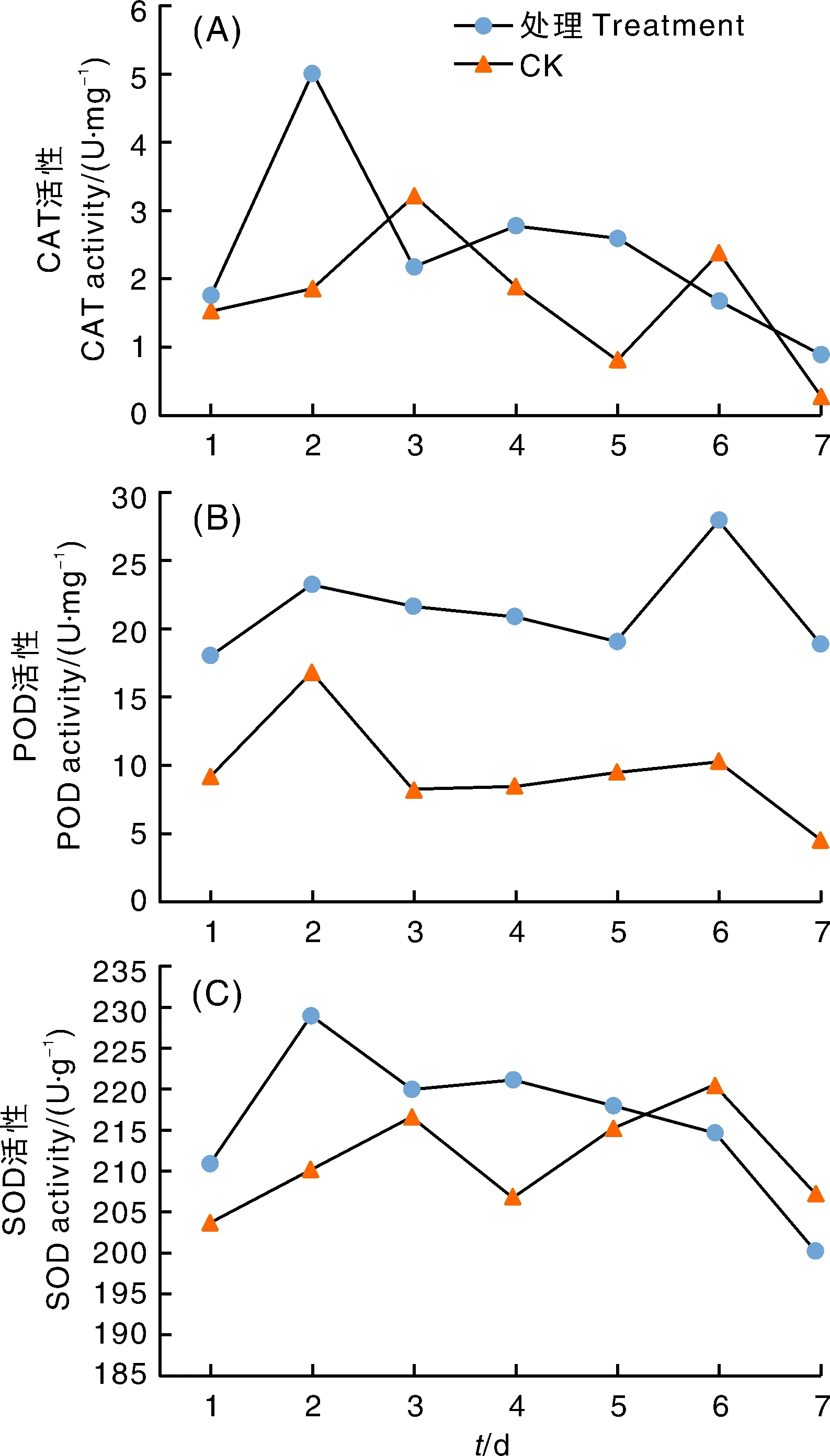
图3 接种HZ-31后野燕麦过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性变化分析Fig.3 Analysis of the changes of CAT, POD and SOD content in A. fatua after HZ-31 inoculation
图4-A显示,接种后1~6 d对照组野燕麦多酚过氧化物酶(PPO)活性变化幅度较小,6 d后迅速增长。处理组野燕麦PPO活性在第2天出现最高值。1~3 d处理组PPO活性高于对照组,说明HZ-31菌株侵染后野燕麦体内多酚氧化酶活性增强,保护酶浓度升高。3~4 d因抵御菌株侵染,PPO被消耗,活性降低。之后PPO活性逐渐增强,保护酶浓度变大。
图4-B显示,对照组与处理组野燕麦苯丙氨酸解氨酶(PAL)活性变化幅度较小,处理组PAL活性一直高于对照组。处理组PAL活性最高值在第1天,即野燕麦受多孢木霉HZ-31侵染后,机体内PAL迅速激活。对照组PAL活性最高值在第4天,最低值在第6天。说明野燕麦被HZ-31菌株侵染后,植株体内PAL活性增强,保护酶浓度升高。
2.2.4 可溶性蛋白含量测定分析
图5显示,对照组野燕麦可溶性蛋白含量呈现先增加后降低趋势;处理组野燕麦可溶性蛋白含量先增加后降低,第6天开始增加。接种2 d后处理组可溶性蛋白含量一直高于对照组,说明野燕麦受HZ-31菌株侵染后,植株体内可溶性蛋白含量增加。
2.2.5 叶绿素含量测定分析
图6显示,对照组野燕麦在1~7 d叶绿素含量变化幅度不大,最高值出现在第6天,整体维持在稳定状态;处理组野燕麦叶绿素含量呈现下降趋势,最低值出现在第7天,且处理组叶绿素平均含量明显低于对照组叶绿素含量。说明野燕麦受到多孢木霉HZ-31刺激后,叶绿素的合成减少,抑制了其光合作用,出现叶片褪绿、黄化或花叶等症状。
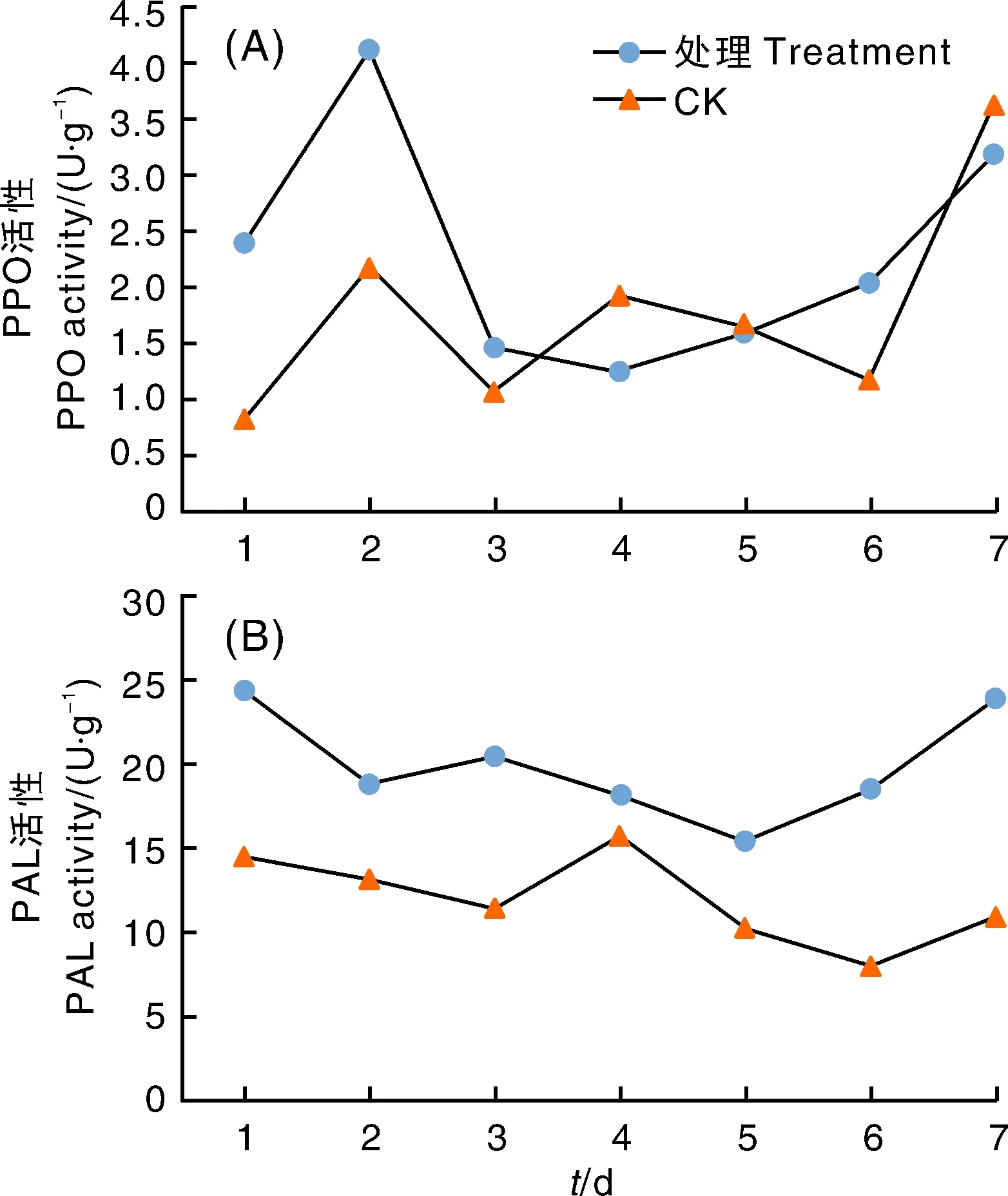
图4 接种HZ-31后野燕麦多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性变化分析Fig.4 Analysis of the changes of PPO and PAL activity in A. fatua after HZ-31 inoculation
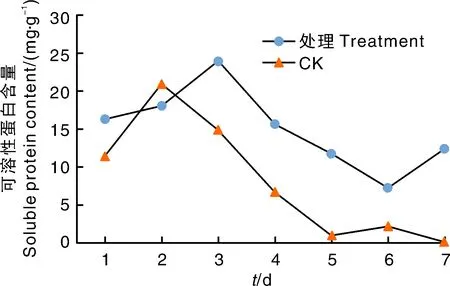
图5 接种HZ-31后野燕麦可溶性蛋白含量变化分析Fig.5 Analysis of the changes of soluble protein content in A. fatua after HZ-31 inoculation

图6 接种HZ-31后野燕麦叶绿素含量变化分析Fig.6 Analysis of the changes of chlorophyll content in A. fatua after HZ-31 inoculation
3 讨论
选用青海农田常见杂草野燕麦作为靶标受体,接种HZ-31菌株后1~7 d连续取样,通过测定植株体内丙二醛(MDA)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、多酚氧化酶(PPO)活性、苯丙氨酸酶(PAL)活性、超氧化物歧化酶(SOD)活性、可溶性蛋白含量和叶绿素含量的变化,明确多孢木霉活性物质对野燕麦生理生化指标的影响。
丙二醛(MDA)含量的变化可反映活性物质作用后对细胞膜的破坏作用,影响植物细胞膜透性[4]。植物细胞膜损伤,透性改变和电解质外渗几乎是各种敏感植物对毒素的普通反应[5]。本研究中,多孢木霉HZ-31菌株侵染野燕麦后,植株体内丙二醛(MDA)含量先升高后下降,受病原物侵染后野燕麦体内MDA迅速激活,随着侵染程度加剧,MDA含量在缓慢降低,膜系统逐渐在被破坏,细胞损伤程度在加重。
叶绿素含量测定反映了活性物质作用后对叶绿素合成的影响[6-7]。植物受病原物侵染后,对光合作用产生了多方面的影响。破坏了绿色组织,减少了植物进行正常光合作用的面积,光合作用减弱[8-9]。由于叶绿素被破坏、叶绿素的合成受抑制,也导致光合能力下降[10]。多孢木霉HZ-31菌株侵染野燕麦后,植株体内叶绿素含量减少,叶绿素合成受阻,导致发病严重,出现叶片褪绿、黄化、萎蔫等症状。
可溶性蛋白含量测定反映了活性物质作用后对靶标杂草植株体内蛋白质合成的影响[11]。植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,可溶性蛋白含量是一个重要的生理生化指标,测其含量是了解植物体总代谢的一个重要指标[12]。可溶性蛋白参与植物多种生理生化代谢过程的调控,本研究中野燕麦接种HZ-31菌株后,在外界环境胁迫的条件下,可溶性蛋白含量先升高以增强对不利因素的抵御性,后呈下降趋势,但接种后可溶性蛋白含量整体高于对照,说明可溶性蛋白含量增加,植物适应性增强。
过氧化氢酶(CAT)、过氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)等的变化反映了活性物质胁迫下对植物防御系统的影响[13]。酚类化合物是植物体内重要的次生代谢物质,植物受病原菌侵染后,酚类物质和一系列酚类氧化酶都发生了明显变化[14-15]。HZ-31菌株的侵染,引起与酚类代谢相关酶的活性增强,包括苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)。野燕麦病株内PAL活性升高,对外界刺激防御能力增强,有利于植物抗病性表达[16]。过氧化物酶(POD)在植物细胞壁木质素合成中起重要作用[17],野燕麦细胞内POD活性上升,加剧了植物细胞中毒坏死。这些变化与植物的抗病机制有密切关系。HZ-31菌株的侵染导致野燕麦体内过氧化氢酶(CAT)活性先升高后降低,反映出侵染前期防御酶被激活以增强对外界的抵御性,随着侵染程度加剧,CAT活性降低,对外界抵御能力削弱[18-19]。超氧化物歧化酶(SOD)活性在野燕麦体内呈现先升高后下降的趋势,反映出对外界抵御能力先增加后减弱的趋势[20]。
综上,多孢木霉HZ-31菌株侵染野燕麦后,对植株生理机制防御酶的影响是多方面的,苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性增加,以此帮助植物抵御菌株侵染,而大部分生理防御指标包括丙二醛(MDA)含量、过氧化氢酶(CAT)活性、多酚氧化酶(PPO)活性、超氧化物歧化酶(SOD)活性、可溶性蛋白含量和叶绿素含量则受到菌株侵染的破坏,含量减少、活性降低,总的来说,被抑制的防御酶作用效应大于被促进的防御酶。HZ-31菌株的侵染钝化或抑制了野燕麦体内主要酶类,中断相应的酶促反应,引起植物广泛的代谢变化,包括细胞膜透性改变、干扰光合作用、蛋白质合成、酚类物质代谢等生理方面的变化。
