艾地苯醌及其在疾病治疗中的应用
2021-04-01徐亚婷王淑珍
徐亚婷,王淑珍
(中国药科大学生命科学与技术学院,江苏 南京211198)
艾地苯醌(idebenone,IDE,1)是19世纪80年代由日本科学家合成的一种智能促进药,它可以通过激活线粒体的功能来提高脑内葡萄糖的利用率促进腺苷三磷酸(adenosine triphosphate,ATP)生成,进而改善脑部功能障碍,也可以通过改善脑内神经递质5-羟色胺的代谢,发挥较强抗氧化和清除自由基的作用[1]。作为辅酶Q10[(coenzyme Q10,CoQ10),2]的合成类似物,IDE已成为目前临床上应用最有效的抗氧化剂之一,主要用于治疗与氧化压迫有关的中枢神经系统退化疾病和与线粒体功能异常相关的疾病[2]。本文对IDE的化学结构、药理作用及其在疾病治疗中的应用进行综述。

1 艾地苯醌的化学结构和药理作用
1.1 艾地苯醌的化学结构及理化性质
IDE化学名为6-(10-羟基癸基)-2,3-二甲氧基-5-甲基-1,4-苯醌,相对分子质量为338,熔点为53 ~ 55℃,是一种黄色结晶或结晶性粉末,极难溶于水而易溶解于有机溶剂[3]。IDE是CoQ10的结构类似物,具有和CoQ10相同的1,4-二取代苯醌环,但与CoQ10具有10个异戊二烯结构的长侧链(50个碳原子)不同的是其2位碳上的侧链是羟癸基(10个碳原子)。尽管侧链结构上的差异使IDE的亲脂性不如CoQ10,但由于两者具有相同的母核结构,IDE的水溶性仍然很低,阻碍了其在水性介质中的给药。与CoQ10相比,由于IDE的侧链较短,可以更好地分配到线粒体膜中,因此具有更好的血脑屏障渗透性[4]。
1.2 艾地苯醌的药理作用
CoQ是所有细胞线粒体膜中的亲脂性电子载体和内源性抗氧化剂,不仅可在呼吸链中被线粒体复合物Ⅰ和复合物Ⅱ还原,还可以从3-磷酸甘油脱氢酶和黄素蛋白脱氢酶接收电子[5]。作为CoQ10的结构类似物,IDE也可以在线粒体电子传递链中发挥电子载体的作用,从而促进ATP的产生。在电子传递链中,IDE可抑制线粒体复合物Ⅰ即还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH) 脱氢酶的活性,使电子不能从线粒体复合物Ⅰ转移到线粒体复合物Ⅲ,但它可以将电子从线粒体复合物Ⅱ(琥珀酸脱氢酶)转移到线粒体复合物Ⅲ,从而发挥抗氧化作用(见图1)[6]。

图1 艾地苯醌和CoQ10在线粒体电子传递链中的作用Figure 1 The role of idebenone and CoQ10 in mitochondrial electron transport chain
1.3 艾地苯醌的代谢
IDE在体内可通过多种细胞色素P450酶的氧化作用缩短侧链而代谢,半衰期随着年龄的增长呈缩短趋势,成人为(12.7±2)h,青少年为(10.4±1)h,儿童为(9.4±0.5)h,产生的主要代谢物是QS4,QS6,QS8和QS10(2)[7]。研究表明,在线粒体呼吸链抑制剂(如鱼藤酮或寡霉素)存在下,QS4和QS6在促进电子转移中没有发挥活性,而QS10可以为鱼藤酮处理过的细胞或线粒体复合物I有缺陷的细胞提供一条有效的呼吸缺陷旁路,因此IDE的药理作用实际上是由QS10介导的[8]。QS10比母体IDE更稳定,其血浆浓度介于QS4(最高)和QS6(最低)之间[8]。虽然IDE不能代替内源性CoQ,但QS10对NADH脱氢酶没有抑制作用,能够在体内部分恢复缺乏内源性CoQ的细胞的呼吸作用。因此QS10在治疗由NADH脱氢酶缺陷引起的疾病方面可能比IDE更具活性,它还可以被用于治疗遗传和后天遗传性CoQ缺乏症。
2 艾地苯醌在疾病治疗中的应用
2.1 艾地苯醌在弗里德赖希共济失调症治疗中的应用
弗里德赖希共济失调症(Friedreich’s ataxia,FRDA)是一种常染色体隐性遗传性疾病,是由线粒体中共济蛋白表达量减少引起的。共济蛋白是一种参与铁代谢和氧化还原稳态的蛋白,其表达降低是由其首个内含子中GAA重复扩增导致的[9]。FRDA通常始于儿童期,影响多种系统,临床表现主要包括中枢神经系统的退行性病变,并伴有心肌增厚和糖尿病。早期临床研究表明,IDE在较低剂量(5 ~ 10 mg · kg-1· d-1)持续给药就能够有效控制FRDA患者的心肌肥厚症状[10]。然而,后来的长期临床跟踪研究表明,只有当初始给药剂量增加到20 mg · kg-1· d-1时才能有效抑制FRDA患者心肌病的发展,而且只对部分儿科患者的神经功能障碍具有改善作用[11]。为了考察IDE的安全性和耐受性,研究人员采用高剂量IDE在78和15例FRDA患者中分别进行了Ⅰa期剂量递增试验和Ⅰb期试验。在Ⅰa期临床试验中,IDE在最高剂量为75 mg · kg-1· d-1时仍未观察到剂量限制性毒性。在为期1个月的Ⅰb期临床试验中,IDE的口服剂量为60 mg · kg-1· d-1,FRDA患者的耐受性也很好[12]。这为研究大剂量IDE对FRDA患者的安全性和有效性的临床试验奠定了基础。但是,一项70例FRDA门诊儿科患者参与的Ⅲ期双盲、安慰剂对照临床试验显示,高剂量IDE(体质量小于45 kg的患者剂量为1 350 mg · d-1,体质量大于45 kg的患者剂量为2 250 mg · d-1)并不能显著改善患者的神经功能[13]。另一项232例成人FRDA患者参与的临床试验也同样未发现IDE治疗组与安慰剂组之间在神经功能方面存在显著性差异[7]。因此,尽管IDE(商品名为Catena®)最初在加拿大被批准用于治疗FRDA,但由于缺乏疗效已于2013年退出市场[6]。
2.2 艾地苯醌在阿尔茨海默病治疗中的应用
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,主要由细胞外淀粉样β蛋白(amyloid β-peptide,Aβ)沉积、细胞内神经原纤维缠结以及线粒体功能障碍引起[14]。在偶发性AD(sporadic AD,sAD)、家族性AD(familial AD,fAD)以及毒素诱导的AD模型中均发现线粒体功能障碍[15]。Yamada等[16]通过向大鼠脑内注射Aβ1 ~Aβ42建立AD大鼠模型,以Y-型迷宫实验和水迷宫实验检测大鼠的学习记忆行为,考察了IDE对Aβ诱导神经毒性的保护作用[16]。其研究结果表明,IDE连续经口给药(高剂量与低剂量分别为20与10 mg · kg-1· d-1)可有效预防由连续注射Aβ造成的学习和记忆功能障碍。Gutzmann等[17]报道了一项IDE治疗AD疗效及安全性的2年随机、双盲、多中心临床研究,450例患者随机分为3组:153例安慰剂治疗12个月后,再口服给药IDE 90 mg(tid)治疗12个月;148例口服给药IDE 90 mg(tid)治疗24个月;149例口服给药IDE 120 mg(tid)治疗24个月。采用AD评估量表(Alzheimer’s disease assessment scale,ADAS)总分作为评价疗效的主要指标,研究发现经过1年治疗后各实验组ADAS总分间有明显的统计学差异,IDE可以剂量依赖性改善AD患者的临床症状;第2年时,各实验组AD患者的临床症状获得了进一步改善,仍然存在明确的药效剂量关系,表明IDE可通过减慢病程在AD治疗中发挥有益作用[17]。在随后开展的另一项为期1年的随机、双盲、安慰剂对照、多中心临床研究中,招募的536例AD患者被随机分为安慰剂和IDE剂量分别为120、240及360 mg(tid)4组,采用ADAS认知亚量表(ADAS-cog)和临床总体印象-变化量表评价了IDE治疗AD的效果。但是,该研究显示IDE并不能改善AD患者的认知功能下降[18]。因此,IDE目前尚未获得批准用于治疗AD或其他认知功能障碍疾病。
2.3 艾地苯醌在莱伯氏遗传性视神经病变治疗中的应用
莱伯氏遗传性视神经病变(Leber’s hereditary optic neuropathy,LHON)是一种罕见的母体遗传性线粒体疾病,由线粒体ND1和ND6基因突变引起,可导致青少年和成人快速和进行性的双侧视力丧失[19]。IDE是唯一一种被欧洲药品管理局批准用于治疗LHON的药物,商品名为Raxone®[20]。IDE治疗LHON的作用机制主要涉及其抗氧化性能和充当线粒体电子载体的能力[20]。IDE将电子绕过NADH脱氢酶直接转移至线粒体复合物Ⅲ,弥补了LHON患者呼吸链中NADH脱氢酶的不足,恢复细胞能量供应并重新激活无活性的视网膜神经节细胞,防止患者视力的进一步丧失并促进患者视力恢复[20]。
IDE被批准用于治疗LHON主要是基于一项随机临床试验及其跟踪研究。该试验对82例含有线粒体基因突变的LHON患者进行了为期24周的随机、双盲、安慰剂对照的多中心临床研究,IDE口服给药剂量为900 mg · d-1,根据从基线到第24周患者的视力变化评价IDE的治疗效果[21]。结果表明,IDE治疗组所有视力观察指标显示出一致的趋势,可有效保护患者免受视力进一步下降。另外,还发现IDE对携带线粒体DNAG3460A或G11778A突变的患者的疗效比对携带T14484C突变患者的疗效更显著。对该项试验的跟踪研究表明,IDE治疗24周可以产生持久的治疗效果,即使中断治疗30个月后,IDE的治疗效果仍然明显[22]。随后的临床实际应用数据也支持了前期的临床研究结果。这些研究提供了令人信服的证据,表明口服给药IDE 900 mg · d-1持续24周在防止LHON患者进一步视力损害和促进LHON患者视力恢复方面具有持续的有益效果[20]。
2.4 艾地苯醌在杜氏肌营养不良治疗中的应用
杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)是肌营养不良蛋白的表达不足引起的,该蛋白质的作用是与F-肌动蛋白和肌膜蛋白结合,使质膜在肌肉收缩过程中具有弹性并保持纤维结构[23]。DMD的症状是进行性肌无力,患者运动功能会慢慢丧失,进而引发心肌病、进行性脊柱异常,最终导致呼吸功能下降甚至死亡[24]。目前DMD尚无治愈的办法,在所有的治疗方法中,糖皮质激素被认为是唯一能够改变病程的药物,其他药物如CoQ10能在不引起不良反应的情况下对某些功能有效[23]。Buyse等[25]采用随机、双盲、安慰剂对照、多中心Ⅲ期临床试验研究了IDE对DMD患者呼吸功能的治疗效果,首次报道了非甾体类药物治疗DMD的有效性。IDE治疗组和安慰剂组分别有31和33例患者参与,平均年龄为10 ~ 18岁,给药剂量为900 mg · d-1。从基线到第52周,IDE显著降低了呼气峰流量占预计值的百分比(PEF%p)。此外,IDE对其他呼吸功能参数(如用力第1s呼气量和用力肺活量)也有显著改善。这些数据表明,IDE的治疗使DMD患者肺部肌肉功能得到了一定程度的保护。最近,一项为期6年的队列研究也证明了IDE改善DMD患者呼吸功能的有效性[24]。因此,从长期效果来看,IDE能显著改善DMD患者的呼吸功能。
2.5 艾地苯醌在其他疾病治疗中的潜在应用
线粒体脑肌病伴高乳酸血症和脑卒中样发作(mitochondrial encephalopathy,lactic acidosis and stroke-like episodes,MELAS)是母体遗传的多系统疾病。Lekoubou等[26]报道了1例38岁MELAS女性患者口服L-精氨酸和IDE治疗27个月的病例。除了在2次未服药期间发病外,在整个治疗期间均未再发病,也没有出现任何不良反应,提示长期口服L-精氨酸和IDE可以预防成人MELAS患者脑卒中样发作,且有较好安全性。Lin等[27]考察了IDE在氧化低密度脂蛋白对血管内皮细胞损伤中的保护作用,发现IDE可以通过糖原合成酶激酶(glycogen synthase kinase,GSK)3β/β-catenin信号通路抑制线粒体功能紊乱,提示IDE是一种很有前途的治疗或预防动脉粥样硬化的药物。鉴于线粒体功能紊乱在系统性红斑狼疮发病机制中的重要作用,Blanco等[28]研究了IDE在狼疮小鼠模型中的作用,发现IDE可以通过改善线粒体能量代谢和减少炎症反应,减轻小鼠狼疮的活动性及器官损害程度,提示调节线粒体生物过程的药物可能对人系统性红斑狼疮具有治疗作用。IDE也可以作为局部补充抗氧化剂用于皮肤疾病的治疗。一项41例女性参与完成的临床试验表明,在使用6周含1% 或0.5% IDE的商用水-油-水乳液后,受试者的光损伤皮肤都获得了不同程度的改善,皮肤粗糙度降低、细纹减少,保湿效果明显,提示IDE具有开发成为抗衰老化妆品的巨大潜力[29]。此外,还有学者报道了IDE的抗纤维化和抗肿瘤作用[30-31]。表1总结了IDE在各种疾病临床治疗中的应用。
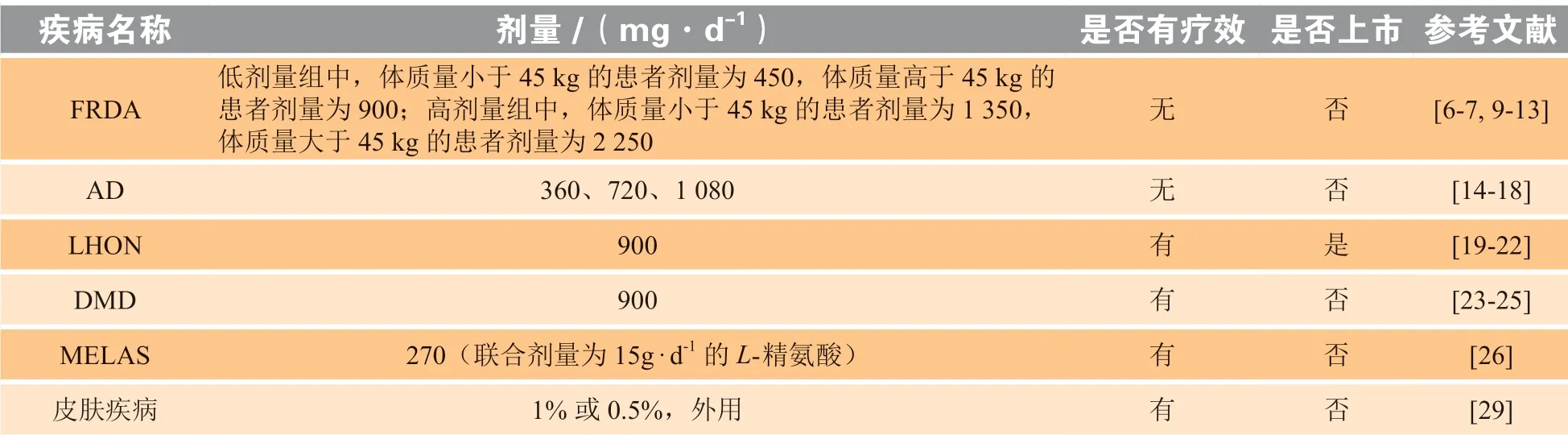
表1 艾地苯醌在临床治疗中的应用Table 1 Application of idebenone in clinical treatment
3 艾地苯醌在疾病治疗应用中的限制与解决 方法
迄今为止,IDE在线粒体疾病和神经肌肉疾病中功效的众多临床试验都是采用口服给药的方式进行的。在健康人中口服给药后,胃肠道对IDE的吸收很快,但由于肝脏和肠黏膜的首过效应,只有不到1%剂量的IDE能够到达全身循环[4]。因此,尽管IDE能够穿越血脑屏障,但即使口服大剂量IDE,在大脑中也很难达到有效的治疗浓度。同时由于IDE水溶性差,口服或局部应用IDE的生物利用度低,因此研究人员尝试了许多不同策略来提高IDE的药效。
3.1 负载艾地苯醌的药物输送系统
近年来,研究人员开发了许多创新性的药物输送系统来增强药物的生物利用度和稳定性,还可以达到药物缓释、降低其毒副作用和增加药物靶向性的作用。体外研究表明,脂质体包裹的IDE可以保护星形胶质细胞免受乙醇诱导的细胞损伤,提示将IDE包封于脂质双分子层中,有望可以制成肠外给药的水溶性IDE剂型,避免口服给药的首过效应[32]。Lauro等[33]报道了一种利用可溶性的β-环糊精-环氧氯丙烷高聚物与羧甲基纤维素制备喷雾干燥微粒作为IDE口服给药载体的方法,这种策略可以提高IDE的水溶性、润湿性和溶出度,为口服给药后增加IDE的吸收和生物利用度提供了一种有效工具。高分子纳米颗粒被认为是纳米医学领域最有希望的策略之一,与常规制剂相比,纳米颗粒具有多种优势,例如使药物释放可控、增加靶点部位的药物浓度、可生物降解、具有良好的稳定性和耐受性等[34]。Amorim等[35]将壳聚糖和N-羧甲基壳聚糖用于制备IDE纳米粒,结果显示,与游离IDE相比IDE纳米粒稳定性增强,黏膜刺激性降低,而且在储存90 d后,IDE纳米粒依然具有抗氧化活性。这些方法为IDE的临床应用开辟了新的前景。
3.2 艾地苯醌的化学修饰
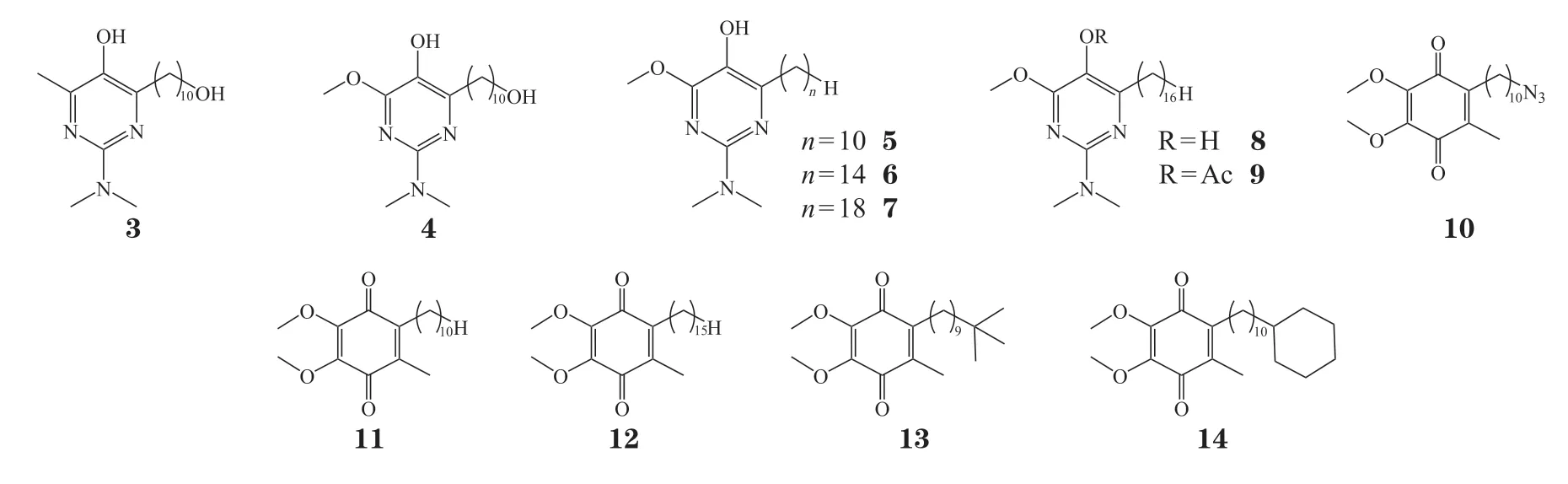
研究人员通过对IDE的苯醌母核结构和侧链结构进行化学修饰获得了理化性质改善或活性提高的IDE衍生物。为了降低呼吸链活性氧(radical oxygen species,ROS)的产生,Arce等[36]将IDE的1,4-苯醌环替换成嘧啶醇,得到了IDE的氮杂环衍生物。该化合物在降低脂质过氧化方面比IDE、艾地苯酚和α-生育酚更有效,它可以通过抑制硫代巴比妥酸活性物质的产生来保护小鼠的线粒体膜。用马来酸二乙酯(diethyl maleate,DEM)处理白血病CEM细胞,可通过去除细胞内的谷胱甘肽诱导氧化应激。化合物3在浓度为5 μmol · L-1就能够抑制DEM处理的CEM细胞中ROS的产生,它对细胞的保护作用比IDE和艾地苯酚高3倍。在保护FRDA成纤维细胞免受由谷胱甘肽合成抑制剂L-丁硫氨酸(S,R)-亚磺酰亚胺引起的氧化应激方面,化合物3也比IDE和艾地苯酚更有效。为了提高IDE的抗氧化活性,该研究团队对化合物3又进一步化学修饰获得了能够有效减少脂质过氧化的IDE氮杂环衍生物4 ~ 10,发现侧链长度为14 ~ 16个原子化合物的抗氧化活性高于侧链长度为18个原子的化合物[37]。Fash等[38]将IDE的侧链末端羟基进行不同取代后合成了衍生物7、10 ~ 14。在DEM处理后的CEM细胞中,化合物11 ~ 14在抑制ROS和维持CEM线粒体膜电位的能力方面都优于IDE,产生的细胞保护作用也比IDE更强。因此,对IDE化学结构的改造有可能为今后治疗应用提供更多更有效的化合物。
4 结语
IDE是一种线粒体靶向的抗氧化剂,可以通过激活线粒体促进ATP生成,也可以通过改善脑内神经递质5-羟色胺的代谢,发挥抗氧化和清除自由基的作用,主要用于治疗与氧化压迫有关的中枢神经系统退化疾病和与线粒体功能异常相关的疾病。已有大量动物实验和临床研究证明了它的抗氧化作用,但缺乏更多的动物实验及临床依据证实其神经保护作用。
由于IDE口服给药生物利用度低,阻碍了其在线粒体疾病和神经肌肉疾病治疗中的应用。随着研究的进展,对IDE的功能会了解的更加透彻。研究者发现可以通过创新性的药物输送系统来增强药物的生物利用度和稳定性,也通过对IDE的苯醌母核结构和侧链结构进行化学修饰增加其生物利用度,使之能够更好地发挥作用。
此外,基于IDE出色的抗氧化性能和线粒体电子载体的作用以及较高安全性,也可以尝试将其与其他药物联合应用为其他相关疾病的预防和治疗提供更多选择。
