降压治疗中低血压的成因及处理
2021-03-31王艳军
王艳军,崔 炜
(河北医科大学第二医院 河北省心脑血管病研究所 心内一科,河北 石家庄 050000)
2017年美国心脏病学会/美国心脏学会(ACC/AHA)指南建议血压≥140/90 mmHg(1 mmHg=0.133 kPa)的高血压患者及血压≥130/80 mmHg的高危患者使用药物治疗高血压[1]。目前尚无研究证据支持高血压1级低危患者需药物降压,有研究表明这样做会增加患者发生低血压,晕厥,电解质紊乱及急性肾损伤的风险[2]。本文将归纳总结降压治疗中低血压的成因及处理方法,旨在协助临床医生治疗高血压时,降低患者发生低血压的风险,使高血压患者长期获益。
1 降压过度所致的低血压
体位性低血压在非选择性社区人群发生率为6.0%~34.0%,在住院患者可达41%,在老年机构中则可达50%。体位性低血压可见于约10%的药物治疗后高血压患者[3-4]。本部分从降压过快、降压药物过强及降压目标不合理3个方面分析低血压的成因。
1.1降压过快导致低血压 在治疗高血压的过程中,为满足患者更快更有效的降压诉求,临床医师在指南允许的范畴内,倾向于一开始就加大降压药物的剂量或联合其他降压药物,从而忽视降压药物的延迟效应,出现降压过度引起的低血压。Lasserson等[5]荟萃分析表明,降压治疗开始第1周,血压下降值约达到最大降压效果的50%;并在第4周约达到最大降压效果。同样,DISTINCT试验[6]结果表明单一药物治疗组(硝苯地平/坎地沙坦酯)和双联药物治疗组出现最大降压效果的时间均在4周左右,且治疗1周降压幅度可达到最大值的50%。由此临床医生可在开始降压治疗1周,初步判断降压药物是否有疗效及是否能达到降压目标,从而避免降压过度或降压无效。由于降压药物存在延迟效应,降压治疗4周左右才会出现最大降压效果,因此不建议临床医生过早过快调整降压药物的剂量或种类。在治疗过程中,由于达到最佳降压效果的时间较长,患者可能会产生焦虑等情绪,从而对医患关系产生不良影响,因此建议临床医生及时向其作出合理解释。
1.2降压药物过强 目前关于使用单一药物还是双联小剂量药物起始治疗高血压的意见不一致。中国高血压防治指南(2018年修订版)[7]建议根据患者治疗前血压与目标血压的差值是否大于20/10 mmHg及高血压患者心血管危险分层等情况,使用不同的起始方案治疗高血压。2020ISH国际高血压实践指南[8]则建议第1步即采用双联小剂量降压药物(ACEI/ARB+CCB)治疗高血压。综上高血压指南均建议血压≥160/100 mmHg的高血压患者起始使用双联药物治疗高血压。EARLY试验[9]研究结果表明即使不改变硝苯地平控释剂的用药剂量(30 mg/d),在治疗4周左右时约83%的患者血压降幅最大,且结合EARLY试验所示的不同治疗时间下血压下降幅度与基线血压关系,结论为在不改变硝苯地平控释剂的用药剂量(30 mg/d)的情况下,基线血压为154/97 mmHg时,治疗4周血压平均下降18.48/10.54 mmHg,24周约为19.40/11.71 mmHg。同样基线血压均为154/97 mmHg时,Chiang 等[10]研究得出单一药物降压只能使血压下降10/5 mmHg,联合药物降压才能使血压下降20/10 mmHg的结论。以上两种结论是有出入的。且有研究表明培哚普利/吲达帕胺/氨氯地平联合治疗高血压时,三药联合治疗要比两药联合治疗时不良事件发生率高[11]。初始联合双药甚至三种药物进行降压治疗可能会增加患者发生低血压等不良事件的风险,因此要督促患者进行家庭血压监测,以预防不良事件的发生。综上,对于部分患者来说,维持单药降压治疗4周左右,即使不增加剂量,也有可能达到理想的降压效果,并能降低由联合药物治疗所引起的不良事件发生率。
降压幅度只与降压药物的种类及剂量有关吗?其实并不是,降压幅度与患者的血压基线值也有关。对血压基线值不同的高血压患者使用相同的降压药物,血压下降幅度与血压基线的大小值呈正相关。
DISTINCT试验[6]研究显示不论是使用单药降压(硝苯地平/坎地沙坦酯)还是使用双药联合降压,血压基线值≥160 mmHg的高血压患者都要比<160 mmHg的患者血压下降幅度大。AdADOSE试验[12]发现随着患者血压基线值的增加,血压下降幅度也随之增加。Hu等[9]通过使用硝苯地平控释剂(30 mg/d或60 mg/d)治疗138例原发性高血压患者来实施EARLY试验,结果同样发现血压下降值受基线血压值的影响(图1[9])。
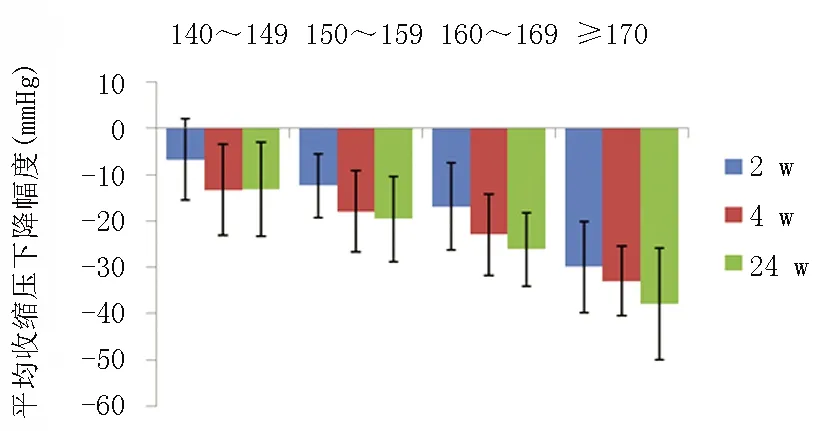
图1 随着收缩压基线值越大血压下降幅度随之增加[9]
临床医生在治疗高血压时,对于血压基线值较高的患者往往选择加大降压药物剂量或使用多种降压药物联合治疗以尽快达到降压目标。但上述各研究结果在一定程度上反映基础血压值较高的患者,由于血压下降幅度也增大,其使用单一降压药或双联小剂量降压药也有可能达到降压目标。当降压疗程达1周,且预估降压效果不理想,可再增加药物剂量或选择双药联合降压。这样虽和当前学界主流观点及相关指南的推荐建议不一致,但也值得进一步试验与研究。
1.3降压目标值对低血压的影响 制定科学合理的降压目标在诊治高血压时非常重要,强化降压可能会导致跌倒、晕厥及体位性低血压等不良事件的发生,但降压不足又不能使高血压患者获得最大的心血管获益。2019JSH指南[13]推荐大多数伴有并发症的高血压患者的血压目标值为<130/80 mmHg,而对于年龄≥75岁的老年人,其目标值为<140/90 mmHg。中国高血压防治指南(2018年修订版)[7]推荐降压目标值为<140/90 mmHg,对于能耐受的和部分高危及以上的高血压患者可降压至<130/80 mmHg。在临床诊治高血压的过程中,临床医生需综合患者年龄、心血管事件危险因素、并发症及对降压药物的耐受等情况,为患者设立合理的降压目标,从而最大限度地减少高血压患者心脑肾及血管并发症。
SPRINT试验[14]表明对不伴有糖尿病的高血压患者而言,强化降压(目标收缩压值≤120 mmHg)可使心肌梗死、卒中、心力衰竭等主要结局的患病率和全因病死率均下降,但同时强化降压会使严重不良事件的发生率随之增加。为评估SPRINT研究中收缩压累积效应和严重不良事件对强化降压治疗效果的影响,Rueda-Ochoa等[15]对SPRINT研究结果进行二次分析,结果显示尽管一开始强化降压治疗降低了主要结局的风险,患者心血管获益非常明显,但随着时间推移,强化降压的最初效益可能被后续出现的严重不良事件所抵消,如低血压、电解质紊乱、急性肾损伤或急性肾衰竭。强化降压虽然能在治疗初期为高血压患者带来益处,但在后续治疗中由于低血压、电解质紊乱等不良事件的出现,患者的心血管获益被削弱,甚至被抵消。因此,降压治疗目标值的设定需要综合考虑患者的长期效益及耐受性,尽可能避免强化降压对患者的不良影响,以达到效益最大化。
2 药物所致体位性低血压
2.1体位性低血压的危害 可以作用于终末期心脏病发生发展过程中的每一个环节,大大增加患者心血管事件死亡风险。因此,降压治疗过程中临床医生应尽可能地避免造成患者体位性低血压,这对于心血管疾病风险较高的高血压患者尤为重要。临床医生应在指南的指导下,结合患者基线血压等自身情况,科学、合理地选择降压药物,设定合理的降压目标,规律监测血压变化,及时发现体位性低血压并及早处理。此外,体位性低血压使患者发生老年痴呆与认知能力下降的风险增大[16]。但一些研究也表明其与认知能力下降及脑部小血管病无关[17]。在临床工作中,临床医生应当对体位性低血压提高警惕,避免体位性低血压的发生,从而在一定程度上减轻多种慢性疾病。体位性低血压定义、流行及危害 体位性低血压是指由卧位转为直立位时(或头部倾斜60°以上)收缩压(SBP)下降≥20 mmHg和(或)舒张压下降≥10 mmHg。对仰卧位高血压患者来说,以SBP下降超过30 mmHg来定义体位性低血压更为适宜[18]。45~64岁成人中,约5%患体位性低血压[19]。体位性低血压与摔倒有关[20-21],是晕厥、卒中[22]、心血管事件[23]及全因死亡[24-25]的危险因素。体位性低血压常与多种慢性疾病有关,包括:帕金森[26]、高血压、心力衰竭、糖尿病及肾衰竭等,并可使患者心血管风险[27-28]增加(图2[27])。
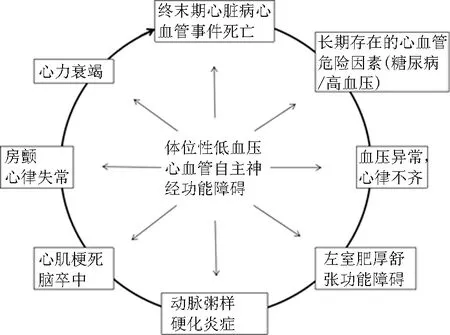
图2 自主神经功能障碍与心血管疾病级联反应[27] 自主神经功能障碍、体位性低血压参与心血管事件发生的不同机制,既是心血管疾病的危险因素,又是导致心血管疾病的死亡风险增加的亚临床改变
2.2体位性低血压的分类及病因 按照发生的速度,体位性低血压可分为早期型:≤15 s,经典型:3 min内 和迟发型:>3 min[29]。不同类型的体位性低血压在人群分布、症状及原因等方面有所不同[30],据此临床医生可以根据发生体位性低血压的速度结合患者的年龄、体质及使用的药物找到体位性低血压的病因,并采取相应的措施或治疗。
按照发生的机制,体位性低血压可分为神经源性与非神经源性[31]。不同的发生机制对应的病因不同(表1[32])。当人突然站立,会有大约500~1 000 ml的血液存在于下肢及脾脏的容量血管中,使得有效循环血容量下降,静脉回流减少,从而心输出量减少。位于颈动脉窦及主动脉弓的压力感受器接受刺激后,将电信号传导到位于延髓的心血管中枢,而后通过交感神经及副交感神经传出,使得交感活性增加,副交感活性减低,作用于心脏、血管及肾,使血压在回心血量减少的情况下维持稳定[33]。神经源性体位性低血压就是由于压力感受器传导通路在任一环节受损引起的[34]。临床可通过体位性低血压患者的心率初步鉴别神经源性和非神经源性体位性低血压。非神经源性病因常导致心率代偿性增快(增加大约15次/min);神经源性病因一般心率不会代偿性增快[3]。非神经源性体位性低血压的病因之一为药物(表1)。那么哪些药物会引起体位性低血压呢?常见的引起体位性低血压的药物(表2[32])。由于多种药物可导致体位性低血压,尤其是降压治疗过程中所应用的α受体阻断剂。因此,为了使高血压患者的心血管获益最大化,临床医师需要科学合理地使用上述药物,尽量避免体位性低血压的发生。

表1 体位性低血压的分类[32]
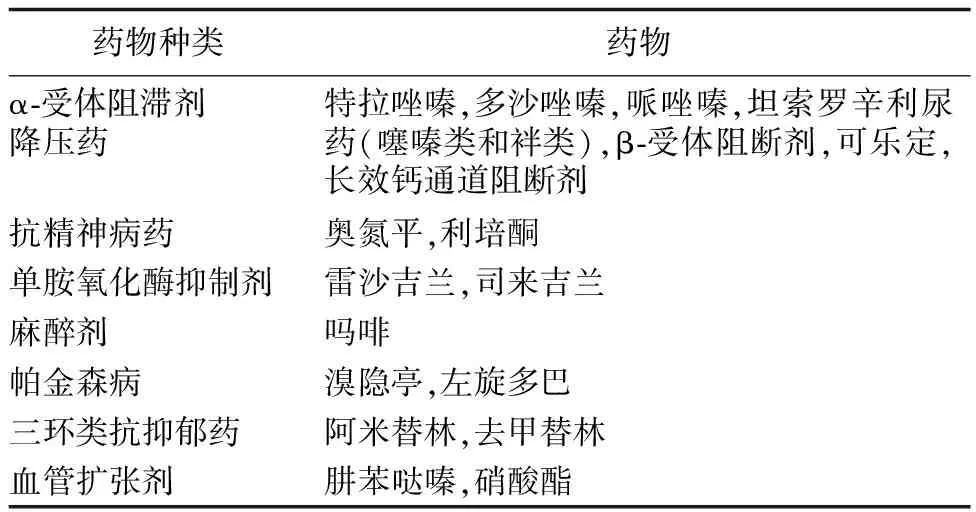
表2 引起体位性低血压的常见药物[32]
2.3体位性低血压的诊断策略 病因学诊断[3]在体位性低血压的治疗中十分重要,首先排查患者服用的药物,如果体位性低血压与药物相关,则应停药;后根据心率是否代偿性加快,初步鉴别是神经源性还是非神经源性病因导致的体位性低血压。其中神经源性病因需要进一步考虑中枢神经系统是否受累。上述病因学诊断策略囊括了体位性低血压的常见病因。需要注意的是在诊断过程中,体格检查,实验室化验结果及影像学检查十分重要。临床医生需要综合临床资料进行诊断,以指导下一步的治疗[35]。
在临床工作中接诊了一位体位性低血压患者,需要尽快判断引起体位性低血压的原因,及时采取非药物及药物治疗措施,以减少体位性低血压对心血管等不良影响。病因学诊断在此时就凸显出了其重要性,策略见图3[3]。
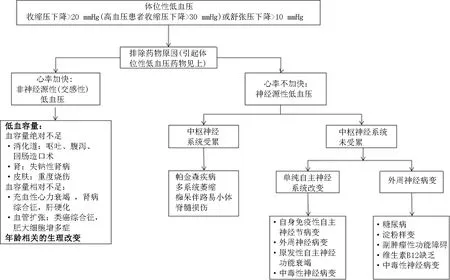
图3 体位性低血压的诊断流程[3]
2.4体位性低血压的治疗 体位性低血压的治疗目标主要是改善低血压,且不造成仰卧位高血压,改善直立症状,延长站立时间[36]。治疗高血压患者的体位性低血压十分具有挑战性,明确患者发生体位性低血压的病理生理机制,可以提高治疗效果[37]。见图4。
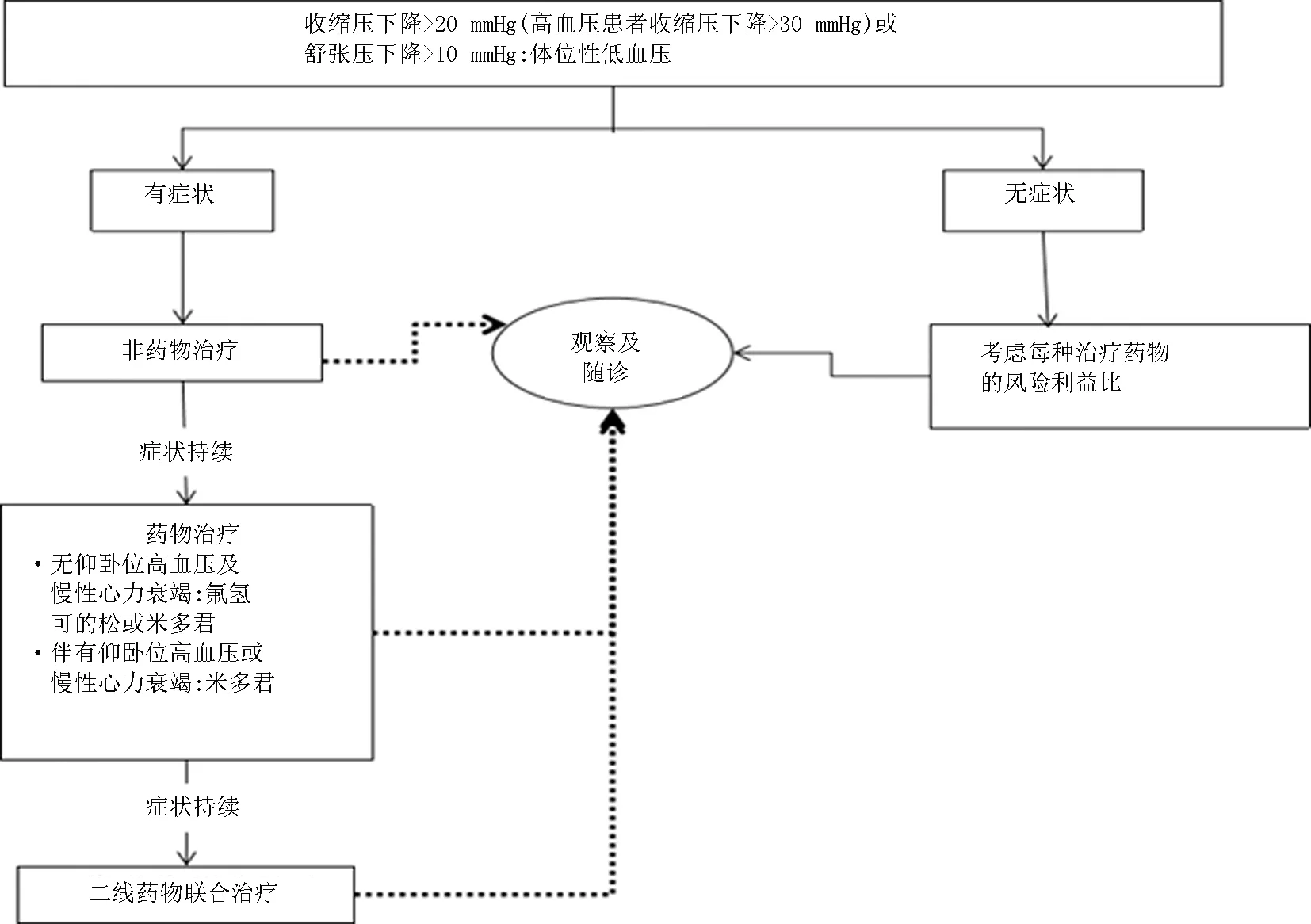
图4 体位性低血压的治疗流程[3]
体位性低血压首选非药物治疗,如避免降压过度和降压过快;在降压治疗时优先选择可改善血压调节或改善脑血流量的药物,如ACEI或ARB,避免使用α-受体阻断剂,利尿剂及β-受体阻断剂[38],尽量避免使用短效降压药物;尽量避免各种可导致血容量不足/外周血管扩张/回心血量减少的情况;保证饮水量2~2.5 L/d, 盐摄入 6~10 g/d[39]。
若体位性低血压症状仍持续存在可以考虑药物治疗[40]。其中米多君是治疗体位性低血压的一线用药,其他药物还包括屈昔多巴[41-42]、氟氢可的松等[4]。研究表明无论是米多君还是屈昔多巴都会使患者获益[43]。研究表明米多君较屈昔多巴提高收缩压的效果更大[44]。若患者无仰卧位高血压及慢性心力衰竭,可选择氟氢可的松或米多君;伴有仰卧位高血压或慢性心力衰竭的体位性低血压患者则优先考虑米多君。但临床医生在使用药物治疗体位性低血压时,应注意米多君和氟氢可的松的不良反应很多,这两种药物均可诱发或加重仰卧位高血压。除此之外,米多君还有头皮感觉异常和瘙痒,皮肤竖毛反应,尿失禁及尿潴留等不良反应,而氟氢可的松可使患者出现头痛、恶心、眩晕及低血钾的症状[45]。因此,在治疗体位性低血压时,应首先尝试非药物治疗,当药物干预措施无效,且体位性低血压症状很严重时,再选择性地加用米多君或氢化可的松等药物治疗。
仰卧位高血压是指仰卧位时收缩压≥140 mmHg和(或)舒张压≥90 mmHg。约50%的神经源性体位性低血压患者会出现仰卧位高血压[46],与单纯性自主神经功能衰竭有关[47],且常作为治疗的并发症出现。仰卧位高血压的出现不仅会使体位性低血压加重,而且会增加患者心血管疾病及肾脏疾病的风险[48]。仰卧位高血压的非药物处理包括避免白天平躺;夜间睡觉时把头抬高;睡觉时吃一些碳水含量丰富的零食;睡前1小时不要饮水[47]。
综上,临床治疗体位性低血压的关键在于辨别体位性低血压是否可逆,在采取药物治疗之前优先使用非药物治疗措施,及时发现仰卧位高血压及症状的反复[40]。
3 餐后低血压
餐后低血压是指餐后2小时内收缩压较餐前下降20 mmHg以上,或餐前收缩压≥100 mmHg,而餐后收缩压<90 mmHg;或餐后血压下降虽未达到以上标准,但出现餐后心脑缺血症状。餐后血压下降始于餐后15 min,餐后30~60 min达到最低,可持续至餐后2小时。Schoevaerdts等[49]研究了76例急性老年病房的住院患者,约46%的患者出现餐后低血压,其中出现症状的患者占比33%。餐后低血压的发生可能与压力反射功能障碍有关[50],研究发现餐后低血压与新发冠心病独立相关[51],与全因病死率增加有关,因此严密监测餐后血压非常必要。鉴于餐后低血压的最大血压下降通常发生于餐后的第35 min~1 h 内(但也有个别报道称其可发生于餐后2 h),故诊断性监测应至少涵盖症状最严重一餐的餐后2 h内的血压情况。患者可通过餐前饮水(喝汤)[52];餐后20~30 min间断进行低强度运动[53];少食多餐,减少碳水化合物摄入;避免进食过热的饮食等非药物治疗方式治疗餐后低血压。由于基础血压值越高,发生餐后低血压的风险越大[54],所以控制血压尤为重要。研究表明α-糖苷酶抑制剂(阿卡波糖)可有效降低餐后胃肠道血流量,预防餐后低血压[55]。
4 治疗错误所致的低血压(如阵发性高血压的治疗)
由于高血压受环境、患者情绪等影响,因此有些患者的血压升高并非持续性的,而是阵发性的,如白大衣性高血压指诊室血压≥140/90 mmHg,但诊室外血压不高。其分布还是比较普遍的,Bhattarai等[56]研究发现三级护理中心中约1/6的高血压患者存在白大衣性高血压。较高的受教育程度及肥胖是白大衣性高血压的阳性预测因子[57]。对于新诊断的高血压患者,动态血压监测是避免白大衣性高血压的有效手段。临床治疗高血压需要鉴别阵发性与持续性高血压,但不应忽视阵发性高血压,需要完善心血管危险因素评估及定期随访。
5 环境/季节的改变对血压的影响
Varlamova等[58]测量了25~59岁血压正常的女性的血压值,研究血压在一年中的变化及其与天气改变的相关性,结果显示收缩压及舒张压均在冬季尤其是1、2月份最高,在夏季出现最低值。并且血压值与测量环境的温度、湿度、大气压等有关。对于糖尿病患者来说,其血压变化也存在季节性规律,收缩压和(或)舒张压在冬天出现最大值,在夏天出现最小值[59]。因此,临床医生在为患者测量血压时,需考虑到上述影响血压值的因素,重复测量血压值,以尽可能地了解患者血压波动情况,从而对患者血压的情况得到更好的掌握,为下一步治疗打下基础。
综上所述,降压治疗过程中低血压的发生原因多种多样,可单独或合并存在,可由降压治疗直接所致,亦可由降压治疗加重患者固有状况(如治疗错误所致的低血压)所致。临床医生在诊治高血压患者时需要综合考虑多方面因素,鉴别阵发性与持续性高血压;根据指南及患者的实际情况为患者制定合适的降压目标及初始治疗方案;在获得心血管效益最大化的同时降低不良事件的发生率,尽可能避免体位性低血压的发生。临床上患者出现低血压的情况还应该考虑到餐后低血压,环境/季节改变对血压的影响等情况。当出现体位性低血压时,要鉴别其病因,针对性地采取治疗措施,首选非药物治疗。
