加减薯蓣丸对APP/PS1 小鼠海马区AMPK/eEF2K/eEF2 信号通路的影响∗
2021-03-31程宇航鄢文静张雨婷汪怡萍谭子虎
程宇航,邱 静,鄢文静,张雨婷,汪怡萍,谭子虎
湖北中医药大学,湖北 武汉430065
阿尔茨海默病(alzheimer’s disease,AD)是一种以认知功能障碍为核心、伴有日常生活能力及社会功能损害为特点的神经退行性疾病,占痴呆总数的50%~70%,远高于其他类型痴呆[1]。目前AD 发病机制复杂,尚缺乏有效预防和治疗药物,积极寻求新的治疗方法显得尤为重要。本课题组以健脾补肾、祛瘀化痰为法拟定加减薯蓣丸,前期临床研究[2]发现其能提高轻、中度AD 患者简易智能量表、日常生活功能量表评分,因此有必要对加减薯蓣丸对AD 的作用机制进行深入研究,本研究应用APP/PS1 双转基因小鼠探讨加减薯蓣丸治疗AD的可能机制,为药物的临床应用提供依据。
1 材料与方法
1.1 实验动物SPF 级5 月龄APP/PS1 雄性双转基因小鼠,购于南京大学模式动物研究所,实验动物合格证号:SCXK(苏)20180008,体质量(33.7±3.2)g。饲养于湖北省中医院SPF 级实验动物中心。温度(21±3)℃,相对湿度(60±5)%,自由饮食饮水,12 h明暗交替。
1.2 实验药物加减薯蓣丸浓缩剂(薯蓣健脾益智合剂,湖北省中医院制剂中心制备,鄂药制字Z20150027,批号:20190101)。药物组成:山药30 g,制何首乌24 g,熟地黄24g,党参20 g,麸炒白术18 g,茯苓18 g,白芍20 g,当归20 g,川芎10 g,杜仲15 g,炙远志12 g,石菖蒲14 g,枸杞子18 g,五味子10 g。加水煎煮3 次,每次1 h,过滤合并,经物理方法浓缩提纯,制成口服液,含生药1 g/mL,真空包装,250 mL/袋,4℃冷藏备用。
1.3 实验试剂和仪器RIPA 裂解液(批号:P0013B)、BCA蛋白浓度测定试剂盒购于碧云天(批号:P0010);ECL 底物液(Thermo,批号:NCI5079)、兔多抗p-AMPKα1(thr172,批号:2535S)、兔多抗p-eEF2(thr56,批号:A00830-2)、兔多抗eEF2K(批号:A02277-1)购于武汉博士德生物工程有限公司;鼠单抗p-eEF2K(ser366,批号:3691S)购于santa cruz;SYN-1(批号:5297S、111-005-003)及PSD-95(批号:36233s、115-005-003)检验所用一抗、二抗均由湖北中医药大学提供。mulISKANMK3型酶标仪(美国Thermo公司);HI650型离心机(湖南湘仪实验室仪器开发有限公司);微量移液器(Eppendorf);CPA 电子天平(北京赛多利斯仪器系统有限公司);DYCZ-24DN 垂直电泳槽、DYCZ-40转膜仪、DYCZ-24K电泳仪(北京六一仪器厂);三套自制新物体识别实验工具(每套包含1 个40 cm×40 cm×40 cm 空箱,2 个相同物体及1 个大小与前者相同、但颜色形状不同的新物体)。
1.4 分组与给药20 只雄性5 月龄APP/PS1 小鼠,按随机数字表法分为模型组、中药组各10 只;另取10 只同窝野生型小鼠作为空白组,中药组按14 g/(kg·d)灌胃(根据大鼠有效灌胃剂量进行换算)加减薯蓣丸浓缩剂,每日1次,连续28天;模型组和空白组灌胃同体积生理盐水。
1.5 新物体识别实验空箱均安置于安静环境中,实验分为3 个部分:适应期,将小鼠放置于空箱中,每天上下午各1 次,10 min/次,持续3 天;熟悉期,将两个相同物体放入同一空箱内对称位置,让小鼠自由探索10 min;测试期24 h后,将测试箱中的1 个物体替换为另一种大小相近、颜色和形状不同的新物体,位置不变,记录小鼠探索新物体的时间A(s)和探索原物体的时间B(s)。每次将小鼠放入空箱内的位置和方向相同,不同小鼠之间测试时需清理测试箱,测试完成后计算各组小鼠的相对分辨指数(A-B)/(A+B)。
1.6 蛋白免疫印迹法(Western Blot)检测蛋白水平小鼠水合氯醛麻醉后断头取脑,冰上分离海马,根据实验步骤进行海马蛋白提取。采用BCA 试剂盒对蛋白样品进行浓度测定,每孔蛋白上样量30µg,电泳、转膜、5%脱脂奶粉或5%BSA室温封闭2 h,按不同比例稀释一抗(AMPKα1 1∶2000,eEF2 1∶400,p-AMPKα1、p-eEF2、eEF2K、p-eEF2K均为1∶1000,SYN-1 为1∶500,PSD-95 为1∶1000)4℃过夜;1×TBST 液洗3×5 min;二抗(羊抗兔1∶1万,兔抗鼠1∶1万)室温摇床1 h;1×TBST液洗3×10 min。ECL 发光液使条带可视化,Image J 1.41软件测量条带灰度值,以目的蛋白灰度值除以内参蛋白β-actin 灰度值,进行归一化处理,将蛋白质水平的相对变化标准化为对照样品。
1.7 统计学方法采用SPSS19.0 统计软件分析数据,计量资料以±s表示,采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 APP/PS1 小鼠分辨指数小鼠相对分辨指数空白组为0.598±0.179,模型组为0.109±0.072,中药组为0.299±0.172。模型组小鼠的新物体识别能力较空白组下降,中药组小鼠新物体识别能力较模型组提高,差异均有统计学意义(P<0.05)。
2.2 APP/PS1 小 鼠 海 马 区p-AMPKα1/AMPK α1、p-eEF2K/eEF2K及p-eEF2/eEF2相对水平与空白组比较,模型组小鼠海马区p-AMPKα1/AMPKα1、p-eEF2K/eEF2K 及p-eEF2/eEF2 相对表达水平升高(P<0.01);与模型组比较,中药组p-AMPKα1/AMPKα1、p-eEF2K/eEF2K 及p-eEF2/eEF2 相对表达水平降低(P<0.01)。见表1及图1—3。
表1 各组小鼠海马蛋白相对表达水平比较(±s)
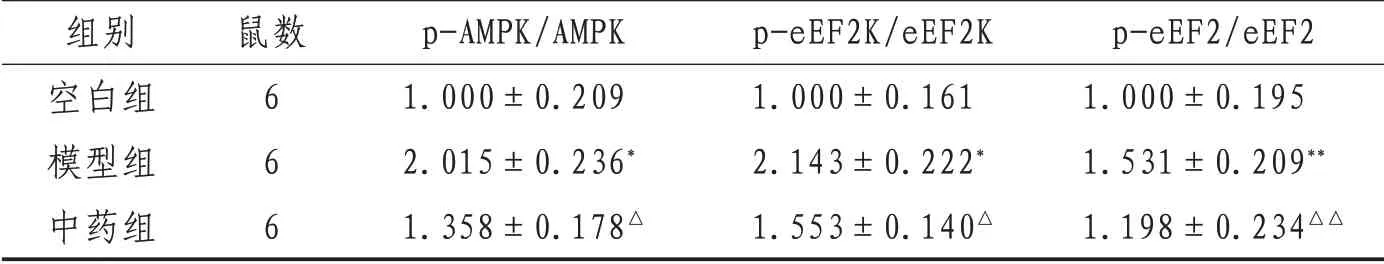
表1 各组小鼠海马蛋白相对表达水平比较(±s)
注:与空白组相比,**表示P<0.01,*表示P<0.05;与模型组相比,△△表示P<0.01,△表示P<0.05

图1 小鼠海马区AMPKα1电泳图

图2 小鼠海马区eEF2K电泳图

图3 小鼠海马区eEF2电泳图
2.3 加减薯蓣丸对海马突触蛋白SYN 和PSD-95的影响与空白组相比,模型组小鼠SYP、PSD-95相对表达水平降低(P<0.01);与模型组比较,中药组小鼠SYN、PSD-95相对表达水平增加(P<0.01)。见表2及图4。
表2 各组小鼠海马突触相关蛋白表达水平比较(±s)

表2 各组小鼠海马突触相关蛋白表达水平比较(±s)
注:**表示与空白组比较,P<0.01;△△表示与模型组比较,P<0.01
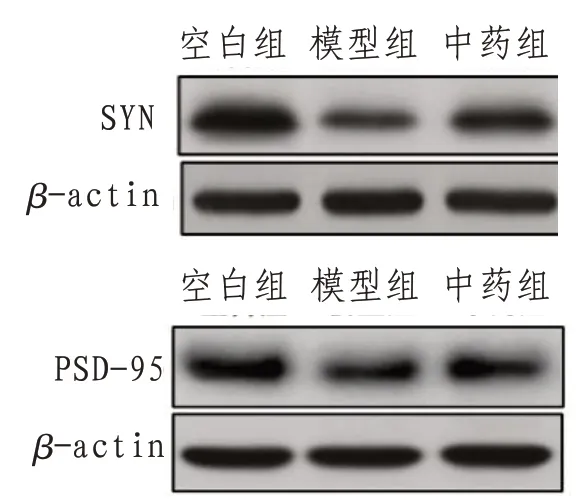
图4 小鼠海马区SYN-1、PSD-95电泳图
3 讨论
加减薯蓣丸是已故名老中医吕继端教授根据《金匮要略》中薯蓣丸化裁而成,全方以补肾填精、化痰开窍为法,前期基于频数分析及关联规则对古代治疗痴呆的方剂进行数据挖掘发现,加减薯蓣丸符合中医对呆病“肾虚髓减为本、痰瘀互结为标”的病机认识[3]。前期研究发现,加减薯蓣丸可调节慢性脑低灌注模型小鼠海马区AMPK 水平,降低自噬水平[4],而加减薯蓣丸是否参与AD 模型AMPK 表达水平的调节尚不清楚。因此本实验通过APP/PS1双转基因小鼠研究加减薯蓣丸对AMPK、eEF2K/eEF2 蛋白水平的影响,探讨加减薯蓣丸参与改善AD学习记忆功能的可能调节机制。
突触可塑性是指突触之间通过连接方式的改变以响应特定刺激,是长期记忆形成的基础。突触内的核糖体、mRNA、翻译因子对突触蛋白质合成有重要帮助,这一过程需要消耗大量能量。大脑因为其能量储备少的特性,几乎所有能量消耗都来自于线粒体分解葡萄糖产生,而AD 患者脑内葡萄糖代谢下降,且这种下降与认知功能障碍程度密切相关[5],因此脑内葡萄糖代谢障碍是突触可塑性受损的关键因素之一。AMPK 作为调节人体能量代谢的关键因子,可以在任何导致ADP/ATP、AMP/ATP 比例升高的情况下激活、增强AMPK 的磷酸化水平以抑制蛋白质的合成、减少能量消耗,短时间内恢复能量代谢稳态,这是一种生理条件下细胞应对压力的保护策略。AMPK由α、β、γ3种亚基构成,其中α-催化亚基包含两种亚型α1、α2,AMPK 的激活依赖于α-亚基的苏氨酸172 位点磷酸化[6]。在病理状态下AMPK 长时间激活会使mRNA 翻译、合成蛋白质这一过程受阻,导致突触可塑性破坏和记忆形成障碍[7],尤其是AD 患者存在糖、脂质代谢紊乱、氧化应激增加等多种病理变化[8],AMPK 磷酸化以抑制蛋白质合成的不利影响将被进一步扩大,加速细胞应激造成的损害。本研究结果显示,与空白组相比,模型组p-AMPKα1/AMPKα1 相对表达水平增加,表明APP/PS1 小鼠脑内存在合成代谢障碍,同时存在AMPK 高磷酸化状态,加减薯蓣丸干预后p-AMPKα1/AMPKα1 相对表达水平下调,说明加减薯蓣丸可参与AD 能量调节,改善AMPK的过度磷酸化状态。
eEF2K 属于α-激酶的非典型蛋白激酶小家族,可被AMPK 磷酸化其丝氨酸366 位点而激活[9]。eEF2 是eEF2K 目前已知的唯一底物,也是蛋白质合成延伸期间肽异位所必需的翻译因子,eEF2 通过三磷酸鸟苷(Guanosinetriphosphate,GTP)水解促进tRNA 从核糖体的A 位点转移到P 位点,进一步介导核糖体沿mRNA 运动,以完成肽链的延伸。eEF2K 能够磷酸化eEF2 的苏氨酸56 位点,使其失去与核糖体结合的能力,不能参与肽链的延长,降低蛋白质合成水平,导致突触重塑受阻,影响学习和记忆功能[10]。有研究者通过敲除TG19959小鼠的eEF2K 基因,eEF2 的磷酸化水平降低,且eEF2K 的减少不影响双转基因小鼠的海马体积与eEF2总水平,其蛋白质合成增加,同时因脑内eEF2K被抑制,认知功能得到改善[11]。eEF2磷酸化引起的翻译控制异常,会破坏细胞稳定性,导致神经细胞死亡[12]。eEF2的磷酸化水平与树突内脑神经营养因子(Brain-derived neurotrophic factor,BDNF)合成密切相关,其可通过调节BDNF 表达改变树突棘的形态和结构,进而影响突触可塑性[13]。本实验结果显示模型组小鼠海马区eEF2K、eEF2 磷酸化水平高于空白组,加减薯蓣丸干预后APP/PS1 小鼠海马区eEF2K、eEF2 磷酸化水平下调,提示加减薯蓣丸可通过调节AMPK,影响eEF2K/eEF2信号。
SYN 是突触囊泡膜上的特定蛋白,参与突触囊泡的转运、神经递质的释放,且SYN 的表达与突触的形成有密切关系。SYN-1 作为SYN 蛋白家族中的一员,具有调控突触发育、神经递质释放等作用,其含量可作为检测突触可塑性的指标。PSD-95 是一种位于突触后膜胞质一侧的蛋白,包含PDZ-95/DLG-A/ZO-1(PDZ)结构域、膜结合岛苷酸激酶(GK)结构域和Src(SH)同源结构域[14],其中PDZ 结构域介导的蛋白与蛋白的相互作用在调节AMPA 受体转运以及突触可塑性中有重要作用[15]。PSD-95 对突触可塑性的影响主要表现在调节树突的发育过程和树突棘的稳定性,此外其还参与突触内部以及突触之间的信号传导[16]。本实验中中药组小鼠海马细胞的SYN-1、PSD-95 相对表达水平均升高,说明加减薯蓣丸能够改善APP/PS1小鼠海马区突触的可塑性。
AMPK 的异常磷酸化导致eEF2K/eEF2 信号激活,参与破坏突触可塑性以及认知功能的病理过程,与中医脾肾亏虚、髓海失养的病机认识相符。另有研究[17]表明,加减薯蓣丸方中制首乌、熟地黄、枸杞、党参、茯苓、白术等健脾补肾药物均可参与人体的能量代谢调节。
综上所述,加减薯蓣丸可通过抑制AMPK 的过度磷酸化,影响下游eEF2K/eEF2 信号,增加突触蛋白质合成,调节突触可塑性而发挥抗AD作用。
