粤紫萁离体再生技术研究
2021-03-30陈朋杨蕾蕾彭杨张苏州徐桂红杨建芬张寿洲
陈朋 杨蕾蕾 彭杨 张苏州 徐桂红 杨建芬 张寿洲

摘要:粤紫萁(Osmunda mildei)为新近形成的自然杂交种,其分布区狭窄、种群个体数量少、有性繁殖能力极低。该文以孢子为外植体, 以MS、3/4MS、1/2MS和1/4MS为基本培养基,探讨不同生长调节剂对粤紫萁孢子萌发、原叶体增殖和孢子体形成的影响。结果表明:粤紫萁孢子中极少的可育孢子在植物生长调节剂的作用下,能够萌发并发育形成原叶体;原叶体生长及增殖的最适组合为1/2MS +1.0 mg·L1 6BA+0.05 mg·L1 NAA和1/2MS +1.0 mg·L1 6BA+0.5 mg·L1 IBA;在1/4MS基本培养基中,原叶体增殖的同时生长发育完善,形成正常的幼孢子体,形成率达83.49%;孢子体最佳生根配方为MS+0.5 mg·L1 IBA;组培苗在河沙∶黄土∶腐殖质=1∶1∶3的栽培基质中成活率在98%以上,且生长旺盛。综上结果,该研究为粤紫萁的人工繁育及其资源保护以及其他濒危蕨类植物的人工保育提供了参考。
关键词: 粤紫萁, 孢子, 原叶体, 孢子体, 杂交种
中图分类号:Q813.1
文献标识码:A
文章编号:10003142(2021)02030107
Abstract:Osmunda mildea is a recently formed natural hybrid species with a narrow distribution area. The number of the population is very small, and its sexual reproduction is extremely low.Using spores as explants, we investigated the effects of basic media (MS, 3/4 MS, 1/2 MS and 1/4 MS) and different plant growth regulators (PGRs) on spores germination, prothallium proliferation and sporophyte formation. The results were as follows: Extremely few fertile spores of O. mildea could germinate and develop into prothallus in effect of plant growth regulators; The optimal PGRs combinations of prothallus growth and proliferation were 1/2MS +1.0 mg·L1 6BA+0.05 mg·L1 NAA and 1/2MS +1.0 mg·L1 6BA+
0.5 mg·L1 IBA; In the 1/4MS with no PGR medium, prothallus were well developed with the proliferation, and the young sporophyte seedling formatted, the formation of scale was 83.49%; The best rooting PGR concentration for young sporophyte was MS+0.5 mg·L1 IBA; In loess∶river sand∶humus=1∶1∶3 cultivation matrix was the best, the survival rate was more than 98%, and the seedlings thrived. This study is great significance to the artificial breeding and conservation of O. mildea, and also provides reference to the artificial conservation of other endangered fern species.
Key words: Osmunda mildei, spore, prothallus, sporophyte, hybrid species
粤紫萁(Osmunda mildei)为紫萁科(Osmundaceae)紫萁属(Osmunda)植物,分布范围极其狭窄,最早仅在香港发现有分布(秦仁昌,1959;李添进等,2003),后多年在野外难觅其踪影。20世纪90年代末,陆续在广东省深圳市东部的笔架山、七娘山和田心山,江西省崇义县和湖南省通道县发现有粤紫萁分布(蒋日红等,2010;严岳鸿等,2011),虽然粤紫萁在多地被重新发现,但野外记录数量极少,到目前为止仅十多株。粤紫萁体细胞染色体核型的研究发现其具有明显的杂种特性(张寿洲等,2008),孢子母细胞减数分裂构型研究(何子燦等,2006)也证实了该种可能为属内组间远缘杂交种,基于rbcL 和trnLrnF序列构建的系统发育树支持粤紫萁是以华南紫萁(O. vachellii)为母本、紫萁(O. japonica)为父本的杂交种(勾彩云等,2008)。粤紫萁为种间杂交种在Tsutsumi et al.(2012)的研究中进一步得到确证。
自然杂交是物种自然演化过程中非常重要的一部分。在生态系统中,自然杂交通过影响遗传多样性和物种多样性进而影响生态系统的稳定性和可恢复性(商辉和严岳鸿,2017)。尽管目前针对自然杂交对于物种演化的影响与意义已有大量的研究,但对于亲缘关系较远的不同物种间的自然远缘杂交发生条件及扩散机理缺少足够的认识。作为异域多地独立发生的自然杂交种(王莹等,2015),粤紫萁为研究自然远缘杂交形成机理与演化提供了重要的研究材料。自然条件下,由于粤紫萁仅产生极少的可育孢子,通过孢子自然繁殖非常困难,因此粤紫萁野外数量极少(商辉和严岳鸿,2017)。植物组织培养为濒危物种的保育及深入研究提供了重要的途径,本研究以粤紫萁孢子为外植体,通过不同基本培养基及生长调节剂种类与浓度配比摸索,成功建立了孢子萌发、原叶体增殖及生根培养的完善组培再生体系。本研究不仅为远缘自然杂交机理的深入研究提供重要的技术保障,而且也为其他濒危蕨类植物的人工保育提供参考。
1材料与方法
1.1 材料
外植体采自栽种在深圳市中科院仙湖植物园迁地保护的一株粤紫萁(图1:F)。3—5月粤紫萁孢子开始形成,待孢子叶完全展开,孢子囊开始由深绿色向淡绿转变时,将孢子叶摘下,带回实验室预处理。
1.2 方法
1.2.1 外植体消毒采集回来的孢子叶立即用清水冲去表面浮尘,待孢子叶表面的水分晾干后,置于铺有硫酸纸的培养皿中,放在干燥器中干燥处理12~24 h。第2天收集硫酸纸上的孢子,在超净工作台上,先将其放入小试管中,无菌水浸泡5~10 min,然后用低速离心机3 000 g离心后倒去上清液,再加入0.1%的HgCl2溶液浸泡2~6 min,无菌水冲洗6次,最后加适量无菌水混匀制成悬浮液,每吸管吸取约200 μL悬浮液接种于不同的培养基中。
1.2.2 原叶体的获得以1/2MS为基本培养基,按6苄氨基腺嘌呤(6BA, 1.0、1.5、2.0、2.5、3.0)mg·L1和萘乙酸(NAA, 0.05)mg·L1设置5个培养基的植物生长调节剂组合和不添加植物生长调节剂的1/2MS为基本培养基作为空白对照,接种后观察孢子萌发情况,以肉眼可清晰看到绿色为启动开始时间。
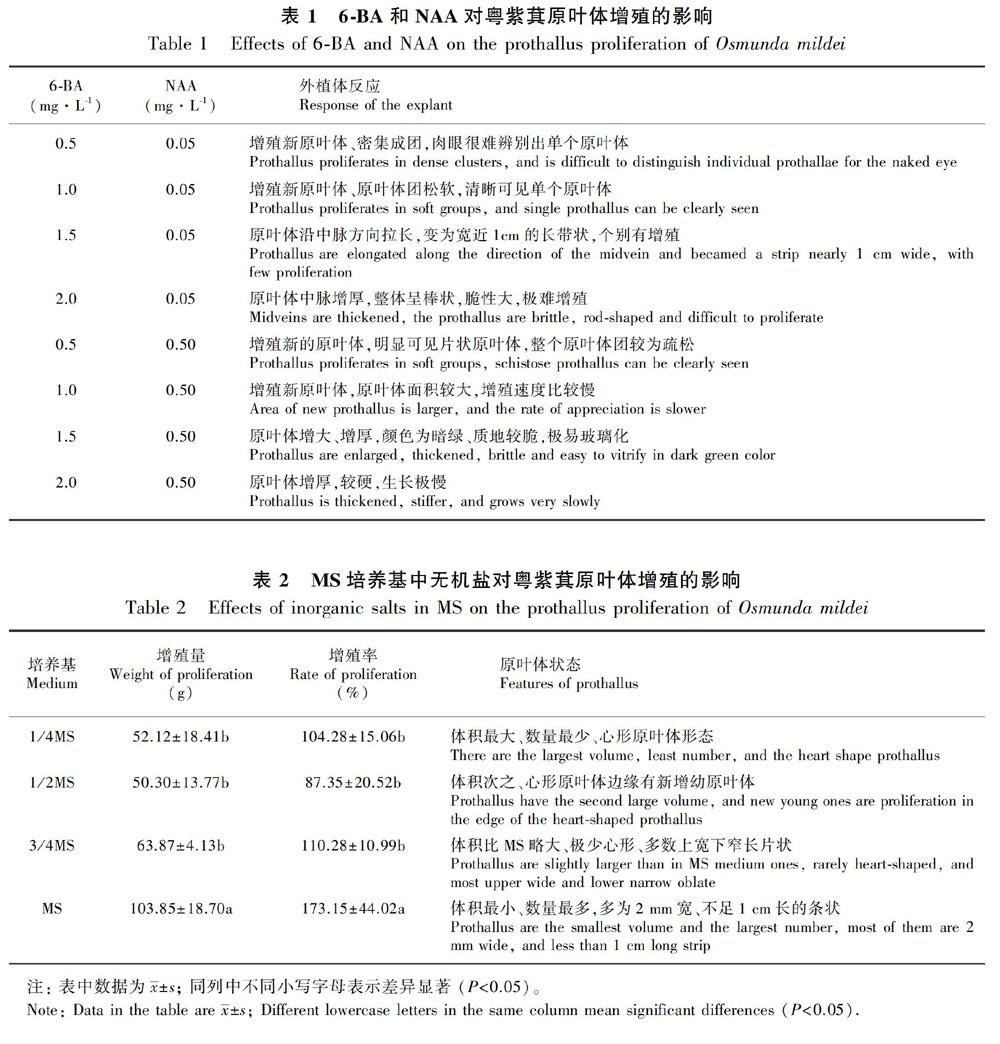
1.2.3 原叶体的继代增殖培养植物生长调节剂对原叶体继代增殖的影响:以MS为基本培养基,设置6BA(0.5、1.0、1.5、2.0)mg·L1与NAA(0.05、0.50)mg·L1 8个培养基组合(表1),研究6BA和NAA对原叶体继代增殖的影响。
无机盐浓度对原叶体继代增殖的影响:设置MS、3/4MS、1/2MS和1/4MS 4种基本培养基配方(表2,配方中只改变MS基本培养基配方的大量元素浓度分别为原来的1、3/4、1/2和1/4),进行继代增殖培养试验。
增殖原叶体量=培养后原叶体重量-接种原叶体重量;增殖率(%)=增殖原叶体重量/接种原叶体重量×100。
以上试验每瓶均接入2 cm2左右的原叶体团5个,每组处理接种10瓶,重复5次,45 d左右统计结果。
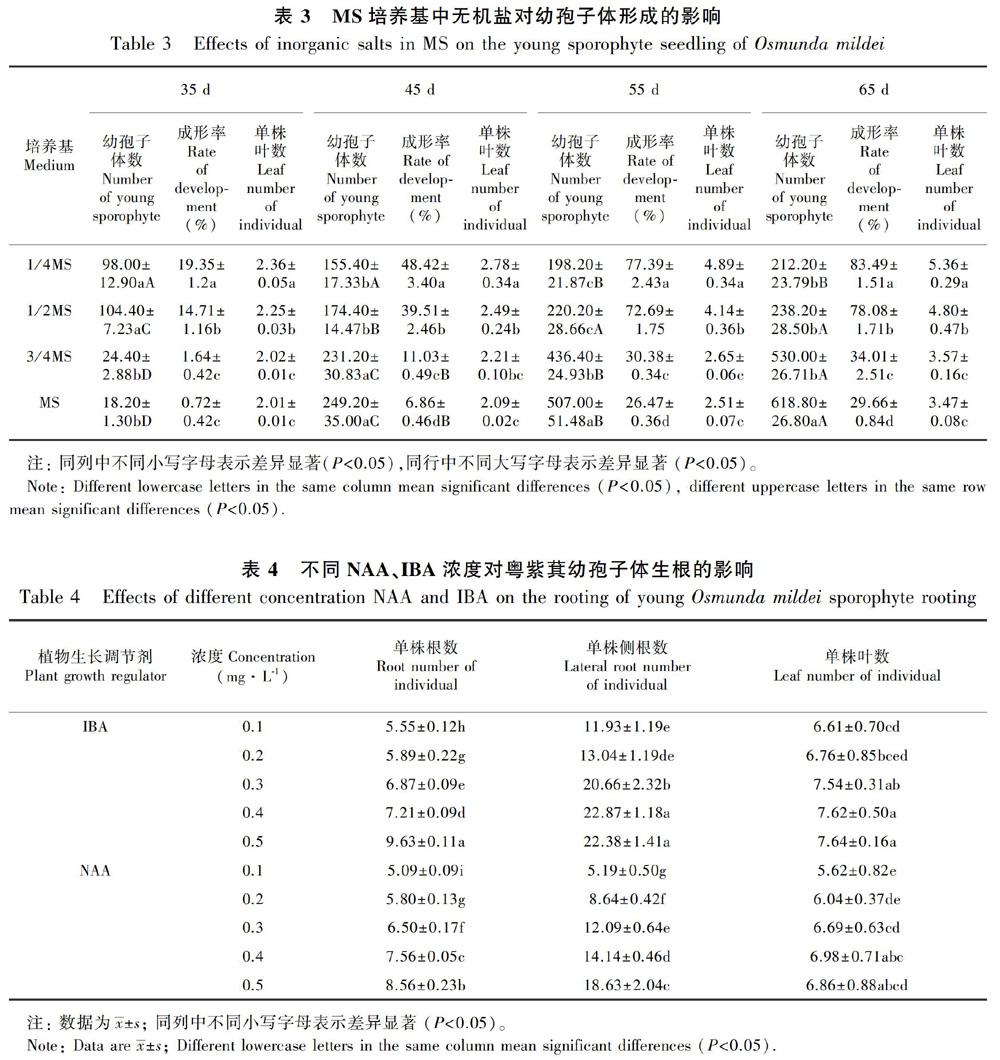
1.2.4 原叶体中幼孢子体的形成设置MS、3/4MS、1/2MS和1/4MS 4种基本培养基配方(表3),以瓶为统计单位,每个培养基接种50瓶,每瓶接种5个2 cm2左右的原叶体团;为了有利于幼孢子体的形成,接种的同时在固体培养基表面,添加高约1 mm的无菌水。接种后分别于35、45、55、65 d时随机取出10瓶,统计幼孢子体的形成情况。重复5次,幼孢子体观察与统计以肉眼清楚可见幼叶为准。幼孢子体数每10瓶为1个统计单位。
成形率(%)=(1瓶培养基中具3片及以上幼叶的单苗棵数/总苗数)×100。
1.2.5 生根培养以MS为基本培养基分别设置吲哚丁酸(IBA, 0.1、0.2、0.3、0.4、0.5)mg·L1 和NAA(0.1、0.2、0.3、0.4、0.5)mg·L1 共10个配方(表4),将原叶体中成形的幼孢子体转入生根培养基中进行生根培养,45 d后进行统计。试验重复5次。
以上各试验的培养基中均加入30 g·L1蔗糖、6.5 g·L1琼脂,pH 5.8~6.0,培养室的培养温度为(25 ± 2)℃,光照时间16 h·d1,光照强度37~40 μmol·m2·s1。
1.3 数据处理
数据采用SPSS 21.0数据统计软件进行方差分析和多重比较分析(Duncans)。
2结果与分析
2.1 原叶体获得
粤紫萁孢子经过消毒处理后,接种到不同的萌发培养基中,在相同的培养条件下进行培养。65 d后在6BA浓度低于1.5 mg·L1的培养基中首先观察到有绿色点状物出现(图1:A),继续培养发现原叶体在生长的同时开始增殖,并彼此相连成簇状(图1:B, C),几乎没有单个原叶体;75 d后才陆续在6BA浓度高于1.5 mg·L1以上的培养基中,观察到有绿色点状物出现,继续培养原叶体长大并在中脉部分增厚,很难见原叶体增殖。未添加植物生长调节剂的1/2MS培养基中始终未见到有绿色点状物出现。
2.2 原叶体的增殖培养
2.2.1 植物生长调节剂对原叶体增殖的影响
将成簇状的原叶体分开后转接入增殖培养基中培养,观察到6BA与NAA的不同浓度组合,对粤紫萁原叶体继代增殖影响的效果差异显著。当6BA浓度为0.5~1.0 mg·L1时,与NAA组合有利于原叶体的增殖;当6BA浓度大于1.5 mg·L1时,与NAA組合既不利于原叶体增殖,还使原叶体的生长状态发生了改变,其中脉明显增厚增大、细胞脆性加大,发生变化的原叶体很难在培养基中继续增殖。
2.2.2 MS中无机盐对原叶体增殖的影响不同无机盐浓度MS培养基对原叶体的生长和增殖影响差异显著(表2)。在MS培养基中,原叶体的增殖速度最快,整个原叶体团很难用肉眼辨出单个的原叶体;在3/4MS培养基中,原叶体增殖速度没有在MS培养基中快,可看到原叶体呈密集的长条状;在1/2MS培养基中的原叶体,增殖速度没有前两者快,但是原叶体的体积和表面积明显增大,团块边缘的原叶体因空间足够,可形成正常的心形;在1/4MS培养基中,原叶体增殖速度最慢,但表面积最大。由此可见,随着培养基中大量元素的浓度由1/4MS→1/2MS→3/4MS→MS 递增,原叶体增殖的速度表现为正相关,但在1/4MS和1/2MS培养基中原叶体能够生长发育完善,而在3/4MS和MS培养中原叶体主要以营养增殖为主。
2.3 孢子体的诱导
试验表明,培养基中添加了植物生长调节剂的原叶体,只能不断进行增殖,很难形成孢子体幼苗,必须将原叶体转移到不添加任何植物生长调节剂的基本培养基中,才能促使原叶体转化成孢
一周后增加通风时间,20 d以后可以完全去除塑料薄膜。在3种栽培基质中的幼苗均可以成活,成活率均在98%以上,经观察,栽培基质(2)河沙∶黄土∶腐殖质=1∶1∶3中的幼苗长势最旺(图1:E)。
3讨论与结论
孢子繁殖是蕨类植物自然状态下的主要繁殖方式,但蕨类植物的孢子萌发时间各不相同,有一些蕨类植物的孢子还具有休眠期,借助一些外源生长调节剂则可达到打破休眠,诱导萌发的作用(张春萌等,2019)。6BA和NAA是植物组织培养中常用的生长调节剂,NAA属于植物生长素,而6BA属于细胞分裂素,二者通常搭配使用。研究表明,6BA和NAA不同浓度的组合可以有效地促进孢子萌发,提高孢子萌发率。在蕨类的配子体生长发育过程中, NAA也能起到促进侧向分生组织发育的作用,并且倾向产生雄性配子体(Kosakivska et al., 2016),进而由雄性配子体向雌雄同体转变(Somer et al., 2010);6BA则是蕨类植物进行组织培养的必要成分,它能够消除脱落酸(ABA)带来的负面作用,低浓度也能改变细胞生长、分裂、伸长和分化的速度,较高的浓度能够诱导根尖分生组织下的根状体胚胎的形成(Kosakivska et al., 2016)。本研究通过使用不同浓度6BA与NAA的配比试验发现,粤紫萁绿色成熟孢子在植物生长调节剂的作用下可以明显提高萌发率。6BA浓度低于1.5 mg·L1时,粤紫萁孢子的萌发时间缩短,萌发率显著提高,在后续的增殖培养阶段,原叶体能够持续增殖,但不能形成孢子体幼苗;在6BA(1.5和2.0) mg·L1与NAA 0.05 mg·L1的浓度组合时,萌发率没有显著差异;6BA浓度超过2.0 mg·L1时,孢子萌发时间推迟,萌发率也降低。由此推测,生长调节剂对蕨类植物的孢子萌发及增殖具有重要影响,而不同的蕨类植物合适的生长浓度存在一定差异。
除生长调节剂外,MS培养基中大量元素的浓度在蕨类植物孢子体的形成中有重要的影响(Mikua et al., 2015)。在对Osmunda regalis孢子体形成的试验中证实,1/8MS是其最佳的培养基(Makowski et al., 2016)。本研究也发现,1/2MS、1/4MS有利于促进粤紫萁原叶体生长发育,同时配子体授精形成幼孢子体成形率高达78.08%和83.49%,在3/4MS和全量MS中的原叶体在培养初期由于大量营养性增殖而发育不完善,配子体很难通过受精作用而形成孢子体幼苗。粤紫萁孢子体形成试验中,3/4MS和MS培养基产生的孢子体幼苗,推测应属于特殊环境下的无配子生殖。粤紫萁属于杂合二倍体种(何子灿等,2006),通过无配子生殖產生的孢子体幼苗,在第3片叶后很难形成正常叶,其后长出的所有叶片依然与第1片叶相同,具体机理还有待于后续的研究。1/4MS和1/2MS培养基中形成的粤紫萁幼孢子体,有早熟现象,与Yatabe et al.(2011)在人工条件下研究Osmunda × intermedia后代生殖力时,报道其F2有早熟现象的结果相同,其早熟有可能来自特别组合的结果,是一种适应特殊环境的现象。
参考文献:
GOU CY, ZHANG SZ, GENG SL, 2008. Phylogenetic position and genetic relationship of Osmunda mildei (Osmundaceae): Evidence from rbcL gene and trnLtrnF region [J]. Acta Bot BorealOccident Sin, 28(11): 2178-2183.[勾彩云, 张寿洲, 耿世磊, 2008. 基于rbcL和trnLtrnF序列探讨粤紫萁的系统位置及遗传关系 [J]. 西北植物学报, 28(11):2178-2183.]
HE ZC,LI Y, YAN B, et al., 2006. Karyotype analysis of five species in Osmunda(Osmundaceae)[J]. Acta Phytotax Sin, 44(6): 617-626.[何子灿, 李勇, 闫斌, 等, 2006. 五种紫萁属植物的核型分析 [J]. 植物分类学报, 44(6): 617-626.]
JIANG RH, WU L, NONG DX,et al., 2010. Supplements to checklist of vascular plants of Guangxi, China (Ⅰ)[J]. J Guangxi Norm Univ (Nat Sci Ed), 28 (3): 66-69.[蒋日红, 吴磊, 农东新, 等, 2010. 广西植物名录补遗(Ⅰ) [J]. 广西师范大学学报(自然科学版), 28(3): 66-69. ]
KOSAKIVSKA IV, BABENKO LM, SHCHERBATIUK MM, et al., 2016. Phytohormones during growth and development of polypodiophyta [J]. Adv Biol Earth Sci, 1(1): 26-44.
LEE TC, CHAU KC, WU SH, 2003. Flora of Hong Kong: Pteridophyta [M]. Hong Kong: Kadoorie Farm & Botanic Garden: 54-55.[李添进, 周锦超, 吴兆洪, 2003. 香港植物志: 蕨类植物门 [M]. 香港: 嘉道理植物园: 54-55.]
MAKOWSKI D, TOMICZAK K, RYBCZY SKI JJ, et al., 2016. Integration of tissue culture and cryopreservation methods for propagation and conservation of the fern Osmunda regalis L. [J]. Acta physiol plant, 38(1): 19.
MIKUA A, POOAG M, TOMICZAK K, et al., 2015. Somatic embryogenesis in ferns: A new experimental system [J]. Plant Cell Rep, 34(5): 783-794.
QIN RC, 1959. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 2: 79-80.[秦仁昌, 1959. 中国植物志 [M]. 北京: 科学出版社, 2: 79-80.]
SHANG H, YAN YH, 2017. Natural hybridization and biodiversity conservation [J]. Biodivers Sci, 25(6): 683-688.[商辉, 严岳鸿, 2017. 自然杂交与生物多样性保护 [J]. 生物多样性, 25(6): 683-688.]
SOMER M, ARBES R, MENNDEZ V, et al., 2010. Sporophyte induction studies in ferns in vitro [J]. Euphytica, 171(2): 203.
TSUTSUMI C, HIRAYAMA Y, KATO M, et al., 2012. Molecular evidence on the origin of Osmunda × mildei (Osmundaceae) [J]. Am Fern J, 102(1): 55-68.
WANG Y, SHANG H, GU YF, et al., 2015. A new cryptic hybrid species of Adiantum L.(Pteridaceae) identified by nuclear and chloroplast DNA sequences[J]. Chin Sci Bull, 60(10): 922-932.[王瑩, 商辉, 顾钰峰, 等, 2015. 用核DNA和叶绿体DNA序列鉴别铁线蕨属(凤尾蕨科)新的隐性杂交种 [J]. 科学通报, 60(10): 922-932.]
YAN YH, YUAN H, HE ZX, et al., 2011. New records of ferns from Jiangxi, China[J]. Guihaia, 31 (1): 5-8.[严岳鸿, 苑虎, 何祖霞, 等, 2011. 江西蕨类植物新记录 [J]. 广西植物, 31(1): 5-8.]
YATABE Y, YAMAMOTO K, TSUTSUMI C, et al., 2011. Fertility and precocity of Osmunda × intermedia offspring in culture [J]. J Plant Res, 124(2): 265-268.
ZHANG CM, WANG CX, ZHANG YX, et al., 2019. Study on the induction of regenerated plants by Lepisorus ussuriensis (Regel et Maack) Ching Sporophyte[J]. Mol Plant Breed, 18(7): 2326-2330.[张春萌, 王朝兴, 张义秀, 等, 2019. 乌苏里瓦韦孢子诱导再生植株的研究 [J]. 分子植物育种, 18(7): 2326-2330.]
ZHANG SZ, HE ZC,FAN CR, et al., 2008. A cytogenetic study of five species in the genus Osmunda[J]. J Syst Evol, 46(4): 490-498.[张寿洲, 何子灿, 范晨瑞, 等, 2008. 五种紫萁属植物的细胞遗传学研究(英文) [J]. 植物分类学报(英文版), 46(4): 490-498.]
(责任编辑周翠鸣)
