木荷皂苷对稻瘟病病原细胞的致毒作用
2017-04-15陈绪涛柴兆元霍光华彭玉萌陈明辉
陈绪涛+柴兆元++霍光华+彭玉萌+陈明辉+黄建平+李时贵


摘要:为了探索木荷皂苷抗稻瘟病菌的作用方式,通过显微观察、血球计数板计数、活体侵染等方法,测定木荷5种皂苷对稻瘟病菌孢子和附着胞的致毒作用。结果显示,木荷皂苷对稻瘟病菌孢子及附着胞的抑制作用均强于阳性对照稻瘟灵,R2-A、R2-1、R2-2、R2-3、R3-4、稻瘟灵对稻瘟病病菌的孢子萌发抑制EC50分别为2.73、2.27、0.61、0.95、4.68、13.94 μg/mL;在浓度为10 μg/mL时,它们对孢子产附着胞的抑制率分别为78.68%、93.27%、97.23%、91.93%、36.34%、9.11%;抑制稻瘟病病菌附着胞产黑色素的MIC分别为7.0、6.0、4.0、6.5、17.0、18.0 μg/mL。受处理的稻瘟病病菌孢子侵染活体水稻叶片能力会不同程度下降,同时抑制附着胞黑色素的积聚成为空胞,难以形成高压渗透钉,阻断了稻瘟病病菌的侵染传播。研究表明,木荷皂苷抗稻瘟病病菌对稻瘟病病原不同类型细胞不具选择性,除了作用于菌丝细胞膜外,还可通过抑制孢子萌发、附着胞黑色素积累等方式产生作用;R2-1、R2-2、R2-3是木荷抗稻瘟病病菌的主要活性先导物。
关键词:木荷皂苷;稻瘟病病菌;孢子;附着胞;作用方式
中图分类号: S435.111.4+1文献标志码: A
文章编号:1002-1302(2017)05-0086-05
木荷(Schima superba Gardn. et Champ)为茶科木荷属植物,是我国中部到南部常绿阔叶林、常绿阔叶-落叶混交林的优势树种或群落上层的共建树种,在我国除自然分布外,还被广泛种植。木荷可作为优质用材、美丽观赏树、防火植被带树种,根皮和叶还可入药,具攻毒消肿、杀虫催吐的作用,主治疔疮、无名肿毒等,树皮甲醇提取物对小菜蛾、菜青虫均具有极强的拒食活性[1]。
在记载的木荷属(Schima Reinw.)植物(世界上约有30余种,我国分布21种)中,木荷和红木荷(Schima wallichii)被认为是有毒植物。已报道的木荷属植物皂苷有5种,它们均属齐墩果烷型三萜皂苷,其苷元有玉蕊醇(barrigenol)、高根二醇(erythrodiol)、山茶皂苷元A(camelliagenin A)。某些皂苷在3位连接1个由鼠李糖、半乳糖、葡萄糖和葡萄糖醛酸组成的糖基侧链,在22位连接1个当归酰酯基[2-5]。某些皂苷显示出较强的肿瘤细胞生长抑制活性[2,5-6]。
笔者所在课题组以稻瘟病病菌为靶标生物,筛选并分离出具有强杀稻瘟病菌活性的木荷皂苷混合物M2IGR5(EC50=16.41 μg/mL),其有效浓度与生产上使用的化学品富士1号防治稻瘟病中使用的有效浓度相当[7]。用它处理稻瘟病病菌,导致菌丝断裂、细胞肿胀、去壁的原生质体变形黏连、细胞膜通透性增大、完整性丧失,从而引起内含物大量渗漏,甚至还间接引起细胞壁降解,加速了稻瘟病病菌细胞的凋亡[8]。从其级分M2IGR5R1中分离鉴定报道了2种新的齐墩果烷型三萜皂苷:母核属于含有5个六元环的玉蕊醇,环上有7个甲基,3个羟基,2个当归酰酯基取代,12、13位有1个双键,3位通过氧原子连接1个寡糖基(由鼠李糖、半乳糖、葡萄糖和葡萄糖醛酸基组成或由鼠李糖、木糖、葡萄糖和葡萄糖醛酸基组成),但抗稻瘟病病菌活性不及混合物[9]。进一步对其级分M2IGR5R2、M2IGR5R3分离又获得7种活性皂苷,其中5种活性较强[10]。本研究从稻瘟病原细胞水平上,研究5种木荷皂苷对稻瘟病病菌孢子及附着胞的致毒作用及方式,确定抗稻瘟病病菌活性皂苷先导物,为开发新型木荷皂苷杀稻瘟剂提供了分子设计思路。
1材料与方法
1.1材料
供试菌株及水稻:稻瘟病菌(Magnaporthe oryzae)10Z3-5,由江西省农业科学院植物保护研究所提供;汕B稻(Oryza Sativa L.),由江西农业大学作物生理和栽培江西省重点实验室提供。木荷皂苷R2-A、R2-1、R2-2、R2-3、R3-4,由江西省南昌市生物资源保护和利用重点实验室分离制得[10](表1)。
药剂及培养基:用0.1%二甲基亚砜(DMSO)溶液溶解各个皂苷,配制木荷皂苷母液终浓度为100 μg/mL。以市售30%稻瘟灵(isoprothiolane)乳油为阳性对照(四川省川东农药化工有限公司)。马铃薯葡萄糖琼脂(potato dextrose agar,简称PDA)培养基配方:去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,加蒸馏水至 1 L,121 ℃湿热灭菌30 min;稻秆汁玉米粉(straw juice corn flour agar)培养基配方:水稻秆40 g,玉米粉20 g,琼脂20 g,加稻秆浸泡液至1 L,121 ℃湿热灭菌30 min。
1.2方法
1.2.1稻瘟病病菌培养及孢子制备
将稻瘟病病菌菌种接于PDA培养基中,28 ℃黑暗活化培养7 d,转接于稻秆汁玉米粉培养基中,28 ℃黑暗培养5 d后,交替光照(光—暗周期12 h—12 h)培养2~3 d促其产孢,每皿加灭菌水 10 mL,灭菌毛笔刷洗菌落表面孢子,4层纱布过滤除菌丝,将孢子悬浮液用无菌水调整至浓度为1万个/mL备用[11-12]。
1.2.2孢子萌发率的测定
取无菌的96孔板,转移50 μL上述孢子悬浮液至每个孔,分别吸取50 μL R2-A、R2-1、R2-2、R2-3、R3-4等5種木荷皂苷母液加入第1个孔中,混匀后移50 μL至第2孔,依次进行2倍稀释,制成50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39 μg/mL浓度梯度的带药孢子悬液,用0.1% DMSO无菌水溶液作空白对照(CK)。28 ℃黑暗保湿培养,血球计数板显微镜观察孢子萌发情况,以芽管长度≥孢子短径视为萌发,待空白组大部分孢子萌发后,随机选取视野,观察约200个分生孢子,统计孢子萌发数量,计算抑制率,相关公式如下:
[JZ]孢子萌发率=萌发的孢子数/镜检的孢子总数×100%;
抑制率=(对照孢子萌发率-药剂处理孢子萌发率)/对照孢子萌发率×100%。
1.2.3孢子产附着胞能力测定
取洋葱内表皮(从外向内第3、4层),剪为18 mm×18 mm方块,三氯甲烷中浸泡 20 min,其间轻轻摆动表皮,无菌水冲洗3遍,黏附于无菌载玻片上(2 mol/L 硫酸溶液浸泡30 min,无菌水冲洗至中性),风干。在洋葱表皮上滴加含10 μg/mL带药的孢子悬液 50 μL,用0.1% DMSO无菌水溶液作空白对照(CK)。28 ℃保湿培养,显微镜观察孢子产生附着胞情况,待空白组大部分孢子产生附着胞时,随机选取视野,观察约200个分生孢子,统计孢子产生附着胞数量,计算抑制率[13],相关公式如下:
附着胞形成率=产生的附着胞数/镜检的孢子总数×100%;
附着胞抑制率=(对照附着胞形成率-药剂处理附着胞形成率)/对照附着胞形成率×100%。
1.2.4附着胞产黑色素的测定
用乙醇擦拭赛璐玢薄膜,无菌水漂洗晾干,在膜上滴加20 μL浓度为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0 μg/mL的带药孢子悬液,28 ℃保湿培养2 d,在显微镜下观察附着胞色素产生情况,不产黑色素或呈现浅黄色的最低浓度即为抑制附着胞黑色素化的MIC。在上述梯度浓度范围内变色不明显的,用同样方法放大浓度进一步测定[14-15]。
1.2.5孢子侵染活体水稻能力测定
将水稻种子用75%乙醇消毒,无菌水冲洗后,平铺于垫有滤纸片的培養皿(内径为11 cm)中,加无菌水保湿,28 ℃恒温培养至发芽,待芽长5 cm左右,移栽至盛有泥土的瓷盆(内径20 cm)中,自然条件培养,待水稻长至2~3叶期时施少量尿素保绿、钾肥增宽叶面。用含1%吐温-40的无菌水配制含各皂苷终浓度为 10 μg/mL 的稻瘟病病菌孢子悬浮液(5×103个/mL),选取水稻叶片长势基本一致的叶片,在叶片上滴加20 μL上述带药孢子悬浮液和对照孢子悬浮液。保湿培养6 d后,观察发病病情,并拍照。
1.3数据分析
数据处理采用DPS 7.5软件进行统计分析[16]。
2结果与分析
[HTK]2.1对稻瘟病病菌孢子萌发的致毒作用[HT]
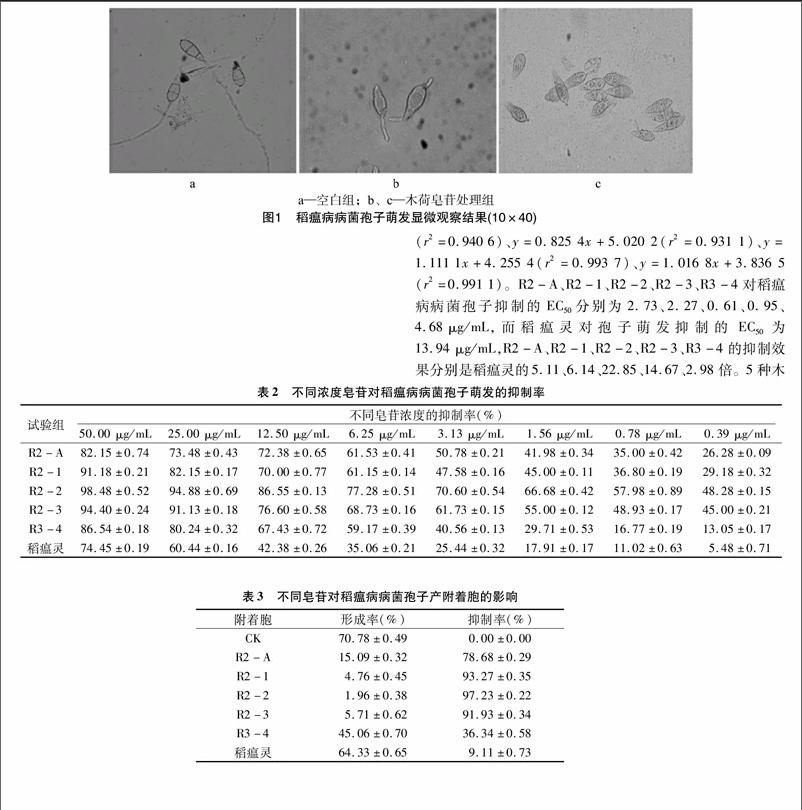
健康的稻瘟病病菌孢子饱满完整,双层隔膜明显,大部分孢子从顶端萌发出芽管(图1-a)。受木荷皂苷作用后,孢子受到一定程度的损伤,隔膜不明显,甚至有从隔膜处断裂成为单隔膜孢子现象,极少数会从2端或侧面萌发出芽管(图1-b),甚至芽管不萌发(图1-c)。[FL)]
空白组孢子产生的附着胞圆润饱满,黑色素积累量多,成熟的附着胞会从附着胞小孔产生粗壮的侵染栓(图2-a);皂苷作用后的附着胞形态有所不同,孢子尖端只产生芽管或略膨大,但不能正常形成附着胞(图2-b);图2-c所示为受皂苷作用后稻瘟病病菌孢子产生中空附着胞,且附着胞内没有黑色素;受药后孢子产生的附着胞不能积聚黑色素,且相比正
2.4对孢子侵染活体水稻叶片的致病力影响
各处理组浓度为10 μg/mL,经过6 d的发病培养后,对孢子侵染水稻叶片组织的抑制效果不同。CK组孢子侵染力强,发病严重,单位面积上菌斑数量多,病斑连接成片;稻瘟灵处理组出现6个明显的病斑,病斑扩大趋势明显;R2-A组见4个小的侵染斑点,R2-1组仅有2个明显病斑出现,R2-2 对稻瘟病病菌的孢子有强烈的抑制作用,叶面上完全没有病斑出现,R2-3对稻瘟病病菌孢子也具有很强的抑制作用,只出现1个病斑,R3-4组发病严重,抗病效果较弱,对稻瘟病病菌孢子在活体水稻叶片上的侵染能力影响较小。5种木荷皂苷抗稻瘟病病菌侵染水稻能力大小排序为R2-2>R2-3>R2-1>R2-A>R3-4>稻瘟灵。
3结论与讨论
水稻是我国乃至世界的主要粮食作物之一,稻瘟病是引起水稻减产的主要病害。稻瘟病是由稻瘟病原(Magnaporthe oryzae)引起的分布广、发病部位多、潜伏期长、危害严重的全球性病害,一般可导致水稻减产11%~30%[17]。稻瘟病病菌主要以分生孢子在适宜条件下对水稻进行侵染和病害传播,其侵染过程有以下几步[18]:(1)稻瘟病病菌孢子接触寄主表皮后,孢子尖端释放黏胶使孢子紧密黏附于细胞表面;(2)孢子萌发出芽管后继而分化为附着胞;(3)附着胞产生侵染钉穿透角质层及表皮细胞壁;(4)病菌分化为次生菌丝在寄主细胞中生长并继续侵染邻近细胞,且能深入叶肉细胞;(5)5~7 d开始出现发病症状,分生孢子梗上分化出大量的新孢子并脱落释放出来;(6)新形成的分生孢子可重新侵染寄主细胞,后期以菌丝体和分生孢子在病稻草、病稻谷等上越冬,完成侵染循环。由此可见,孢子及附着胞在整个侵染过程中起着关键作用。稻瘟病病菌附着胞的形成不仅受遗传因子调控,还受外界因素的诱导[19-20]。
R2-A、R2-1、R2-2、R2-3、R3-4的EC50分别为 2.73、2.27、0.61、0.95、4.68 μg/mL,而阳性对照药物稻瘟灵对抑制稻瘟病病菌孢子萌发的EC50为13.94 μg/mL。5种皂苷的抑菌活性分别是稻瘟灵的5.11、6.14、22.85、14.67、298倍;各皂苷浓度为10 μg/mL时,抑制稻瘟病病菌孢子产附着胞率分别为 78.68%、93.27%、97.23%、91.93%、36.34%,而稻瘟灵的仅为9.11%,各皂苷对抑制稻瘟病病菌孢子产附着胞的能力分别是稻瘟灵的8.64、10.24、10.67、10.09、3.99倍;各皂苷对附着胞黑色素化的MIC分别是7.0、6.0、4.0、65、17.0 μg/mL,稻瘟灵的MIC为18.0 μg/mL,其抑制附着胞黑色素化能力分别是稻瘟灵的2.57、3.00、4.50、2.77、106倍;5种木荷皂苷在稻瘟病病菌孢子侵染活体水稻叶片试验中表现不同,其抗稻瘟病病菌侵染能力大小排序为 R2-2>R2-3>R2-1>R2-A>R3-4>稻瘟灵。其中 R2-1、R2-2、R2-3等3种皂苷对稻瘟病病菌细胞的致毒作用强烈,受药后大部分孢子萌发活力下降;少数孢子尖端只产生芽管而不能进一步萌发为附着胞,且附着胞数量明显减少、直径缩小,附着胞内的色素积累减少,有的甚至萎缩、中空、透明,从而使附着胞难以形成高压渗透钉,不能产生足够的膨压侵染穿透组织。由此可见,R2-1、R2-2、R2-3是木荷抗稻瘟病病菌的主要活性先导物。
目前,对稻瘟病病菌的防治药物多种多样,不同药物对稻瘟病病菌的抑菌机制各不相同。茶多酚对稻瘟病菌作用机制主要是破坏菌体的细胞膜结构,抑制过氧化氢酶(CAT)、过氧化物酶(POD)活性,使其丧失细胞膜的屏障和酶系的保护功能,最终导致菌体生长受到抑制或死亡[21]。皂苷抗真菌的主要活性机制是与病原菌生物膜上的甾醇形成复合物,导致微孔形成,使生物膜失去完整性[22]。茶皂素属三萜类皂苷,对稻瘟菌的菌丝生长和孢子萌发有明显的抑制作用,对三环唑防治稻瘟病具有明显的增效作用[23]。细胞自噬在稻瘟病病菌的孢子萌发和附着胞形成过程中起着很重要的作用,自噬缺陷的稻瘟病病菌菌株缺乏足够的膨压而不能侵入水稻表皮,而自噬缺陷菌株的单个孢子中萌发的细胞数和形成的附着胞数与野生型没有差异[24-26]。稻瘟病病菌侵入主要是靠机械作用,但酶或其他作用也可能辅助或加速这一过程的进行。三环唑等农药可以抑制[WTBX][STBX]BUF1[WTBZ][STBZ]基因所编码的酶活性,从而能够有效阻断黑色素的合成,令稻瘟病病菌附着胞难以形成高压渗透钉而失去侵染性[18],但在受伤的水稻表面,稻瘟病病菌菌丝可直接侵染而失去防治效果。木荷皂苷对稻瘟病病菌的致毒作用,主要作用于病原细胞膜上,不仅导致菌丝细胞完整性和通透性损伤、内含物外泄[8],而且还可抑制孢子萌发、孢子产附着胞及附着胞积聚黑色素等多个环节,阻断稻瘟病病菌侵染过程,有效控制稻瘟病病菌的发生和传播,不像三环唑、木荷皂苷对不同类型稻瘟病病原细胞不具备选择性。
参考文献:
[1]邓志勇,鄧业成,刘艳华. 木荷提取物对小菜蛾和菜青虫的拒食活性[J]. 农药,2007,46(12):854-856.
[2]Ohtsuki T,Miyagawa T,Koyano T,et al. Acylated triterpenoid saponins from Schima noronhae and their cell growth inhibitory activity[J]. Journal of Natural Products,2008,71(5):918-921.
[3]陈昌祥,叶海亚,申永乐,等. 红木荷树皮的化学成分[J]. 云南植物研究,1997,19(2):201-206.
[4]陈维新,吴大刚. 银木荷苷元研究[J]. 化学学报,1978,36(3):229-232.
[5]徐文,周光雄,戴毅,等. 木荷茎的化学成分研究[J]. 中草药,2010,41(6):863-866.
[6]Takashi O,Masaaki S,Takashi K,et al. Steroidal saponins from Calamus insignis and their cell growth and cell cycle inhibitory activities[J]. Bioorganic & Medicinal Chemistry,2006,14(3):659-665.
[7]冯华根,张长伶,霍光华. 木荷活性成分的分离及其对稻瘟病菌的室内毒力[J]. 江苏农业科学,2012,40(4):114-117.
[8]易磊,霍光华,韩启灿,等. 木荷皂甙对稻瘟病菌细胞形态及生理生化指标的影响[J]. 植物保护学报,2013,40(5):450-456.
[9]Huo G H,Zhang C L,Zhang Y J. Structure elucidation of two Triterpenoid saponins from leaves of Schima superba Gardn. et Champ[J]. Lecture Notes in Electrical Engineering,2014,250(2):915-922.[ZK)]
[10]彭玉萌,霍光华,韩启灿,等. 抗稻瘟病菌活性木荷皂甙类似物的分离条件及其分离[J]. 分析化学,2014,42(1):59-64.
[11]殷丽青,陈全庆. 培养基和光照对稻瘟病菌产孢量的影响[J]. 上海农业科技,1991(5):43-48.
[12]王国平,罗宽. 稻瘟病菌产孢培养基的筛选[J]. 湖南农学院学报,1989(2):58-62.
[13]廖乾生. 抗稻瘟病菌附着胞形成研究[D]. 杭州:浙江大学,2002.
[14]张欣,靳学慧,张亚玲. 三环唑抑制稻瘟病菌MIC的测定及菌株产黑色素能力比较[J]. 黑龙江八一农垦大学学报,2010,22(2):20-24.[HJ1.73mm]
[15]张传清,周明国,薛娜. 稻瘟病菌对三环唑的敏感性检测枝术与抗药性风险评估[J]. 中国水稻科学,2005,19(1):79-84.
[16]唐启义. DPS数据处理系统[M]. 北京:科学出版社,2007.
[17]Daw B D,Zhang L H,Wang Z Z. Salicylic acid enhances antifungal resistance to Magnaporthe grisea in rice plants[J]. Australasian Plant Pathology,2008,37(6):637-644.
[18]林福呈. 稻瘟病菌附着胞形成的细胞生物学[J]. 植物病理学报,2001,31(2):97-101.
[19]Jelitto T C,Page H A,Read N D. Role of external signals in regulating the prepenetration phase of infection by the rice blast fungus,Magnaporthe grisea[J]. Planta,1994,194(4):471-477.
[20]Lee Y H,Dean R A. Hydrophobicity of contact surface induces appressorium formation in Magnaporthe grisea[J]. FEMS Microbiology Letters,1994,115(1):71-75.
[21]汪金蓮,邱业先,扶教龙,等. 茶多酚对稻瘟病菌的抑制作用及抑菌机理[J]. 天然产物研究与开发,2011,23(5):918-922.
[22]Charles G,Jean L,Karl G L,et al. Haemolytic activity,cytotoxicity and membrane cell permeabilization of semi-synthetic and natural lupane- and oleanane-type saponins[J]. Bioorganic & Medicinal Chemistry,2009,17(5):2002-2008.
[23]盛书强. 茶皂素对杀菌剂的增效作用及机理[D]. 长沙:湖南农业大学,2003.
[24]Claire V F,Madhumita B,Martin E,et al. Autophagic fungal cell death is necessary for infection by the rice blast fungus[J]. Science,2006,312(5773):580-583.
[25]Liu X H,Lu J P,Zhang L,et al. Involvement of a Magnaporthe grisea serine/threonine kinase gene,[WTBX][STBX]MgATG1[WTBZ][STBZ],in appressorium turgor and pathogenesis[J]. Eukaryot Cell,2007,6(6):997-1005.
[26]Lu J P,Liu X H,Feng X X,et al. An autophagy gene,[WTBX][STBX]MgATG5[WTBZ][STBZ],is required for cell differentiation and pathogenesis in Magnaporthe oryzae[J].
