蒙古黄芪病程相关蛋白AmPR-10于大肠杆菌不同载体的可溶性表达策略研究
2021-03-30王珏胡丽丽李桂兰吴娜张育敏
王珏, 胡丽丽, 李桂兰, 吴娜, 张育敏
山西中医药大学基础医学院, 山西 晋中 030600
植物病程相关蛋白(pathogenesis-related proteins, PR)是植物体被病原体侵害及受到外界压力时产生的[1]。这些PR蛋白主要被划分为17个家族,具有广泛的功能[2],其中PR-10不仅仅参与植物的抗病机制反应,同时在其自身发育中也起作用[3]。有文献指出蒙古黄芪病程相关蛋白AmPR-10由158个氨基酸组成,理论大小为16.8 kD,且具有核酸酶活性[4-5]。并有研究证明,PR-10类蛋白的核酸酶活性可能在植物防御病原体感染中起作用,和其抗RNA类病毒相关[6]。因此体外研究AmPR-10的性能对深入探讨黄芪抗病机制具有重要意义,然而从天然黄芪中提取蛋白质的传统方法成本较高,蛋白得率较少,后续研究不便。
大肠杆菌表达体系遗传背景清楚、操作简便,对外源基因表达研究是一条高效、经济的途径[7],但因其缺少蛋白质表达后的修饰体系,使来源于真核生物的外源基因表达后不能正确折叠,常以不溶的包涵体形式存在[8]。针对这一现象,目前有多种方式可提高外源基因的可溶性表达量,如与标签融合表达[9-10]、分子伴侣修饰表达[11-13]、提高周质蛋白表达[14]或更换宿主菌等[15-16]。本研究试图建立AmPR-10基因在大肠杆菌内的可溶性表达体系,选择融合标签以及分子伴侣修饰的方法以期高效表达具有活性的蒙古黄芪病程相关蛋白,为进一步探索AmPR-10核酸酶活性机制,研究蒙古黄芪生长发育抗病过程提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验材料 蒙古黄芪叶片(山西中医药大学种植);大肠杆菌k12购于中国普通微生物菌种保藏管理中心;感受态大肠杆菌EscherichiacoliBL21购于生工生物工程(上海)有限公司;克隆表达载体pET-28a、pET-30a由山西中医药大学基础医学院实验中心提供。
1.1.2实验试剂TaqDNA聚合酶、限制性内切酶NcoⅠ、EcoRⅠ、XhoⅠ、T4 DNA连接酶、细菌基因组提取试剂盒、RT-PCR试剂盒、质粒提取试剂盒、凝胶纯化试剂盒、Ni2+纯化蛋白试剂盒、酵母tRNA等均购于生工生物工程(上海)有限公司。
1.1.3实验仪器 PCR仪购自杭州科学仪器有限公司;凝胶成像系统购自北京六一生物科技有限公司;高速冷冻离心机购自湖南湘立科学仪器有限公司;恒温摇床购自上海博讯实业有限公司;超声破碎仪购自宁波新芝生物科技股份有限公司。
1.2 重组子构建
1.2.1蒙古黄芪总RNA提取 称取蒙古黄芪叶片0.2 g,在冰上研磨,转移至离心管。加入Trizol试剂室温放置5 min。加入氯仿和异丙醇离心抽提,室温晾干加入缓冲液溶解RNA。
1.2.2目的基因PCR 以蒙古黄芪总RNA为模板,利用RT-PCR试剂盒,得到AmPR-10的扩增产物。反应体系(共50 μL)为:模板RNA 15.5 μL,缓冲液5 μL,上、下游引物各2 μL,反转录酶混合物0.5 μL, RNA酶抑制剂0.5 μL,TaqDNA聚合酶0.5 μL,ddH2O 24 μL。反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸40 s,共30个循环;72 ℃充分延伸5 min。提取大肠杆菌k12基因组,以其为模板,通过PCR得到skp的扩增产物,反应体系(共50 μL)为:模板2 μL,上、下游引物各2.5 μL,TaqDNA Mix 25 μL, ddH2O 18 μL。反应程序同上。引物设计以NCBI公布的基因序列为模板(AmPR-10 Gene ID: KY419098.1,skpGene ID: 000913.3),见表1所示。
1.2.3目的基因克隆 使用限制性内切酶EcoRⅠ和XhoⅠ对AmPR-10基因扩增产物酶切,将得到的酶切产物割胶纯化后,与使用相同限制性内切酶酶切的载体pET28a与pET30a分别连接,转化宿主BL21(DE3),得到重组子pET28a-AmPR-10和pET30a-AmPR-10;使用限制性内切酶NcoⅠ和EcoRⅠ对重组子pET30a-AmPR-10质粒酶切,将产物与经相同限制性内切酶处理后的分子伴侣skp相连接,转化宿主BL21(DE3),得到重组子pET30a-skp-AmPR-10(分子伴侣skp位于目的基因AmPR-10上游)。
1.3 目的蛋白表达和纯化
将重组子于LB液体培养基中培养,转速为200 r·min-1,至菌体浓度OD600达到0.5~0.6时加入IPTG诱导(IPTG终浓度达0.1 mmol·L-1),于37 ℃培养4 h及16 ℃培养12~16 h诱导蛋白表达。通过超声破碎获得目标蛋白的粗蛋白液(溶于Tris-HCl缓冲液中),然后通过Ni2+蛋白纯化试剂盒纯化目标蛋白,并用SDS-PAGE检测纯化前后的蛋白样品,确定正确表达。通过考马斯亮蓝法测定纯蛋白的浓度。

表1 用于目的基因PCR的引物序列Table 1 The primers for gene cloning
1.4 目的蛋白活性检测
称取2 mg酵母tRNA溶于1 mL缓冲液( 100 mmol·L-1MES,pH 6.0)中,加入100 μL含有目标蛋白AmPR-10的上清液,50 ℃保温30 min。反应完成后立即加入1 mL预冷的氯化锂终止反应,冰浴3 h,12 000 r·min-1,4 ℃离心15 min,取上清液于260 nm处测定其吸光度,以未加酶液的样品为对照。酶活定义为在50 ℃、pH 6.0反应条件,2 mL反应体系中,在30 min内使A260吸收值变化1.0的酶量定义为一个活性单位U(活性定义参照上海翊圣生物科技有限公司Benzonase Nuclease全能核酸酶使用说明书)。
1.5 目的蛋白结构模拟分析
对目的蛋白AmPR-10(单独表达)、S-tag+AmPR-10(与标签融合表达)、skp+S-tag+AmPR-10(标签基础上,通过分子伴侣修饰表达)分别进行SWISS-MODE建模(http://swissmodel.expasy.org/),获得PDB文件。使用软件SOPMA对目的蛋白进行二级结构分析,使用软件Chimera对目的蛋白空间三级结构进行局部分析。
2 结果与分析
2.1 重组子的克隆
本研究选择利用表达载体pET-28a与pET-30a构建重组子pET28a-AmPR-10与pET30a-AmPR-10;选择利用分子伴侣skp对重组子pET30a-AmPR-10中的外源基因进行修饰,构建重组子pET30a-skp-AmPR-10,以建立AmPR-10在大肠杆菌中的可溶性表达体系。
2.1.1目的基因PCR 如图1所示,以大肠杆菌k12基因组为模板,通过PCR得到分子伴侣skp,长度为483 bp(条带1、条带2),符合预期大小;以蒙古黄芪叶片总RNA为模板,通过RT-PCR得到目的基因AmPR-10,长度为474 bp(条带3、条带4),符合预期大小。
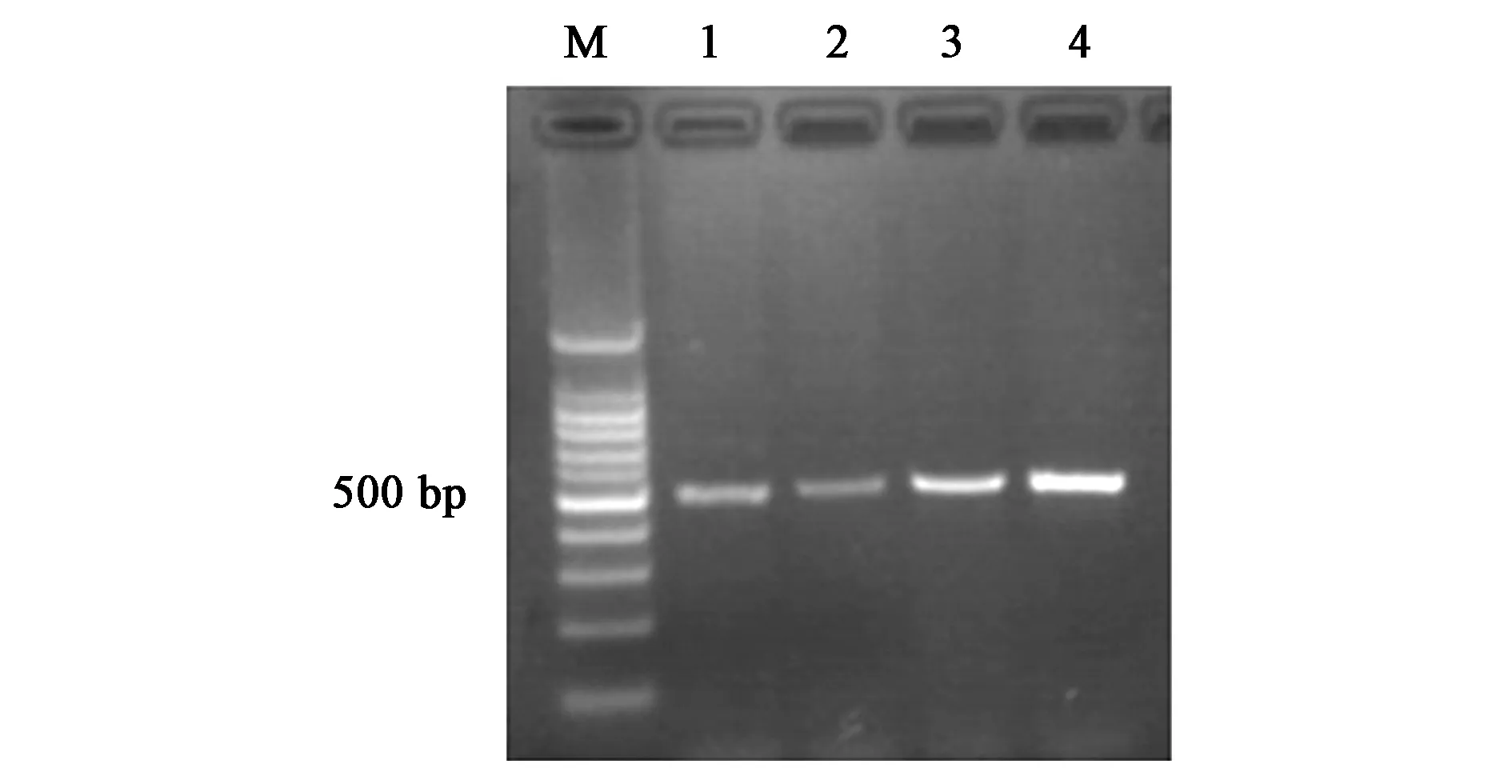
注:M—Marker;1、2—分子伴侣skp扩增结果;3、4—目的基因AmPR-10扩增结果。图1 目的基因AmPR-10和分子伴侣skp的PCR结果Fig.1 The PCR result for target gene AmPR-10 and molecular chaperone skp
2.1.2重组子鉴定 图2A为重组子pET28a-AmPR-10的鉴定结果,重组子经EcoRⅠ、XhoⅠ酶切后电泳有2条条带,分别与对照位置相同,确定得到阳性克隆;图2B为重组子pET30a-AmPR-10的鉴定结果,重组子经EcoRⅠ、XhoⅠ双酶切后电泳有2条条带,分别与对照位置相同,确定得到阳性克隆。

注:A:重组子pET28a-AmPR-10鉴定结果,M—Marker;1—AmPR-10的PCR结果;2—质粒pET28a鉴定结果;3—重组子pET28a-AmPR-10双酶切鉴定结果;B:重组子pET30a-AmPR-10鉴定结果,1—AmPR-10的PCR结果;2—质粒pET30a鉴定结果;3—重组子pET30a-AmPR-10双酶切鉴定结果。图2 重组子鉴定结果Fig.2 Identification of the recombinants
如图3所示,以重组质粒pET30a-skp-AmPR-10为模板,对目的基因进行PCR扩增。条带1、2为平行样品,是对skp和AmPR-10构成的全基因进行PCR的鉴定结果,全长为957 bp,条带位置符合预期大小;另将重组基因进行测序,成功鉴定重组子。
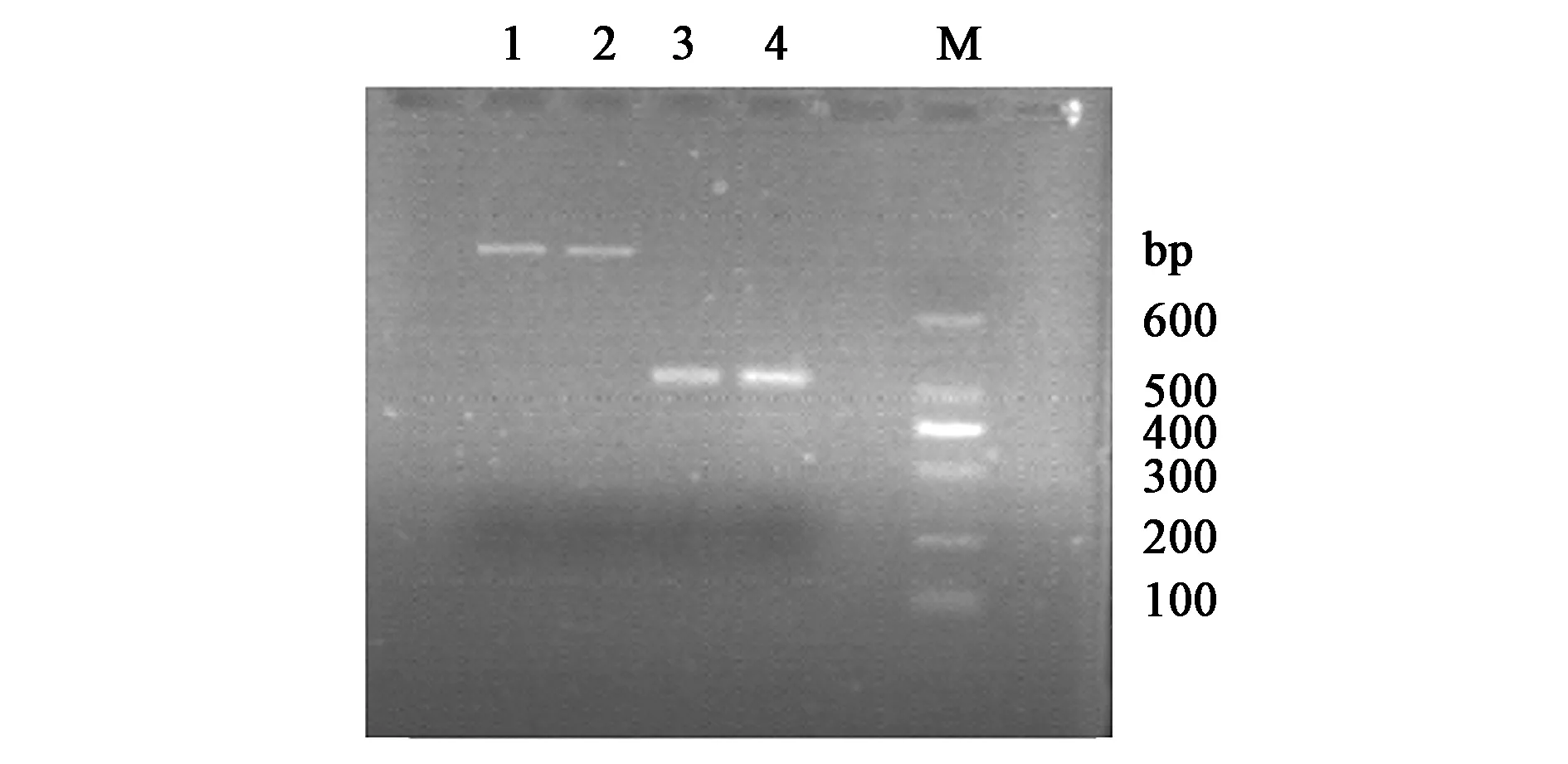
注:M—Marker;1、2—skp与AmPR-10全基因PCR鉴定结果;3—skp PCR鉴定结果;4—AmPR-10 PCR鉴定结果。图3 重组子pET30a-skp-AmPR-10鉴定结果Fig.3 Identification of the recombinant pET30a-skp-AmPR-10
2.2 目的蛋白表达
通过比较重组子pET28a-AmPR-10和pET30a-AmPR-10的目的基因表达量,可分析标签S-tag在外源基因表达中的作用;根据重组子pET30a-skp-AmPR-10中目的基因可溶性表达量的变化,探讨分子伴侣skp在外源基因表达中的作用。
图4中,条带1、2、3为pET28a-AmPR-10 蛋白表达情况,位置在17 kD附近,与文献报道AmPR-10蛋白大小一致(16.8 kD)[5],但可溶性表达量并不乐观,大部分蛋白质以包涵体形式存在(条带3);条带4、5、6为pET30a-AmPR-10的表达情况,与前者相比,在相同条件下目的蛋白可溶性表达量有所提高,同时包涵体蛋白减少(条带6),因载体pET30a有S-tag标签修饰,故蛋白条带位置高于前者,大小约为19 kD。
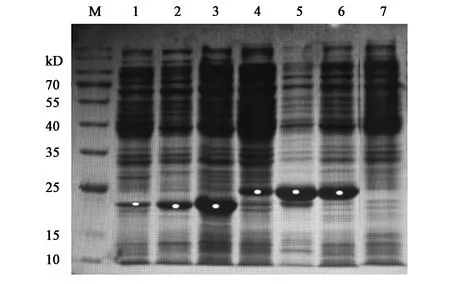
注:M—Marker;1、2—重组子pET28a-AmPR-10于37、16 ℃诱导可溶性蛋白表达结果;3—重组子pET28a-AmPR-10于16 ℃诱导包涵体蛋白表达结果;4、5—重组子pET30a-AmPR-10于37、16 ℃诱导可溶性蛋白表达结果;6—重组子pET30a-AmPR-10于16 ℃诱导包涵体蛋白表达结果;7—未诱导对照。图4 重组子pET28a-AmPR-10与重组子pET30a-AmPR-10蛋白表达结果比较Fig.4 Comparison of protein expression between recombinant pET28a-AmPR-10 and pET30a-AmPR-10
由图4可确定16 ℃低温诱导条件下,各重组子的可溶性蛋白表达量更高,故在此条件下,对重组子pET30a-AmPR-10和pET30a-skp-AmPR-10的外源蛋白可溶性表达情况进行比较,如图5所示,重组子pET30a-skp-AmPR-10的可溶性蛋白表达量进一步提高,蛋白大小在34 kD附近(条带2),符合分子伴侣skp与目的基因AmPR-10融合表达的结果。
注:M—Marker;1—未诱导对照;2、3—重组子pET30a-skp-AmPR-10、pET30a-AmPR-10于16 ℃诱导可溶性蛋白表达结果。图5 重组子pET30a-AmPR-10与重组子pET30a-skp-AmPR-10蛋白表达结果比较Fig.5 Comparison of protein expression between recombinant pET30a-AmPR-10 and pET30a-skp-AmPR-10
2.3 目的蛋白结构模拟分析
2.3.1S-tag对蛋白外源表达的影响 载体pET30a和pET28a的区别是前者含有S-tag标签,有学者发现源于地衣芽孢杆菌的漆酶N端融合S-tag构建于pET-22b 载体,并转化大肠杆菌 BL21(DE3)后可显著提高其在大肠杆菌中的可溶性表达量,大约提高20倍[17]。本研究对S-tag修饰前后的AmPR-10分别进行建模分析,通过chimera软件分析发现目的蛋白空间构象的变化:①图6显示AmPR-10在经S-tag修饰后,第一段α螺旋结构得以延长,增加了2个氨基酸,为39位Val和40位Thr,Val是疏水性氨基酸,Thr是极性氨基酸易形成氢键,二者加强了α螺旋的稳定性;②图7显示原91位Asp、92位Ala及93位Asn是连接2段β折叠的linker,经S-tag修饰表达后,该部分形成了1段短α螺旋,且Ala为疏水性氨基酸,同样有利于增强此段α螺旋的稳定性[18]。有文献表明,α螺旋结构有利于提高蛋白稳定性[19],因此,重组子pET30a-AmPR-10表达量高于pET28a-AmPR-10,可能是由于载体pET30a上的S-tag与目标蛋白融合,增加了α螺旋结构的比例,由此提高目标蛋白的稳定性,进而提高可溶性表达量。
2.3.2分子伴侣skp对蛋白外源表达的影响
图8A所示为AmPR-10的三级结构预测图,通过SOPMA分析,其α螺旋占比约为36.08%;图8B为skp与AmPR-10融合表达的蛋白质三级结构预测图,图中Ⅰ部分表示AmPR-10的三级结构,Ⅱ部分表示skp的三级结构,2个部分由“linker”相连,如图中虚线所示,且skp与AmPR-10的N末端结合。分子伴侣帮助目标蛋白正确折叠,在天然宿主体内,最后会被切去,并不成为成熟蛋白的一部分。由图8B显示,模拟结果符合分子伴侣的定义,skp与AmPR-10各自独立表达,skp不影响AmPR-10的空间结构。由于在外源大肠杆菌宿主内,缺失切除分子伴侣skp的酶催化系统,因此2个部分以linker连接的方式融合表达,而skp主要由α螺旋结构组成,因此使得由其与AmPR-10共同构成的全蛋白三级结构中α螺旋比例提高,根据软件计算分析,可达78.87%,进而提高全蛋白的疏水性,使蛋白空间构象更加稳定,实现重组子pET30a-skp-AmPR-10可溶性蛋白表达量提高的目的。
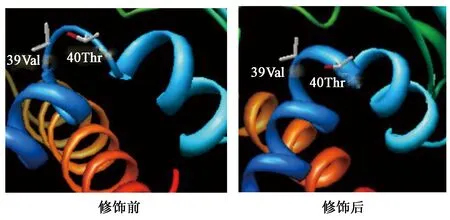
图6 S-tag修饰前、后39位Val、40位Thr空间构象Fig.6 Spatial conformations of 39 Val and 40Thr before and after the S-tag modification
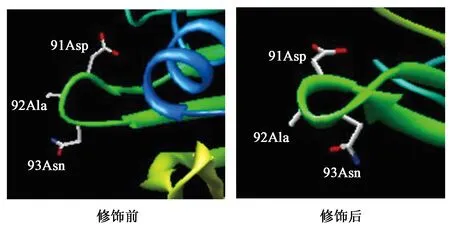
图7 S-tag修饰前、后91位Asp、92位Ala、93位Asn空间构象Fig.7 Spatial conformations of 91 Asp 、92 Ala and 93 Asn before and after the S-tag modification
2.4 目的蛋白纯化与活性测定
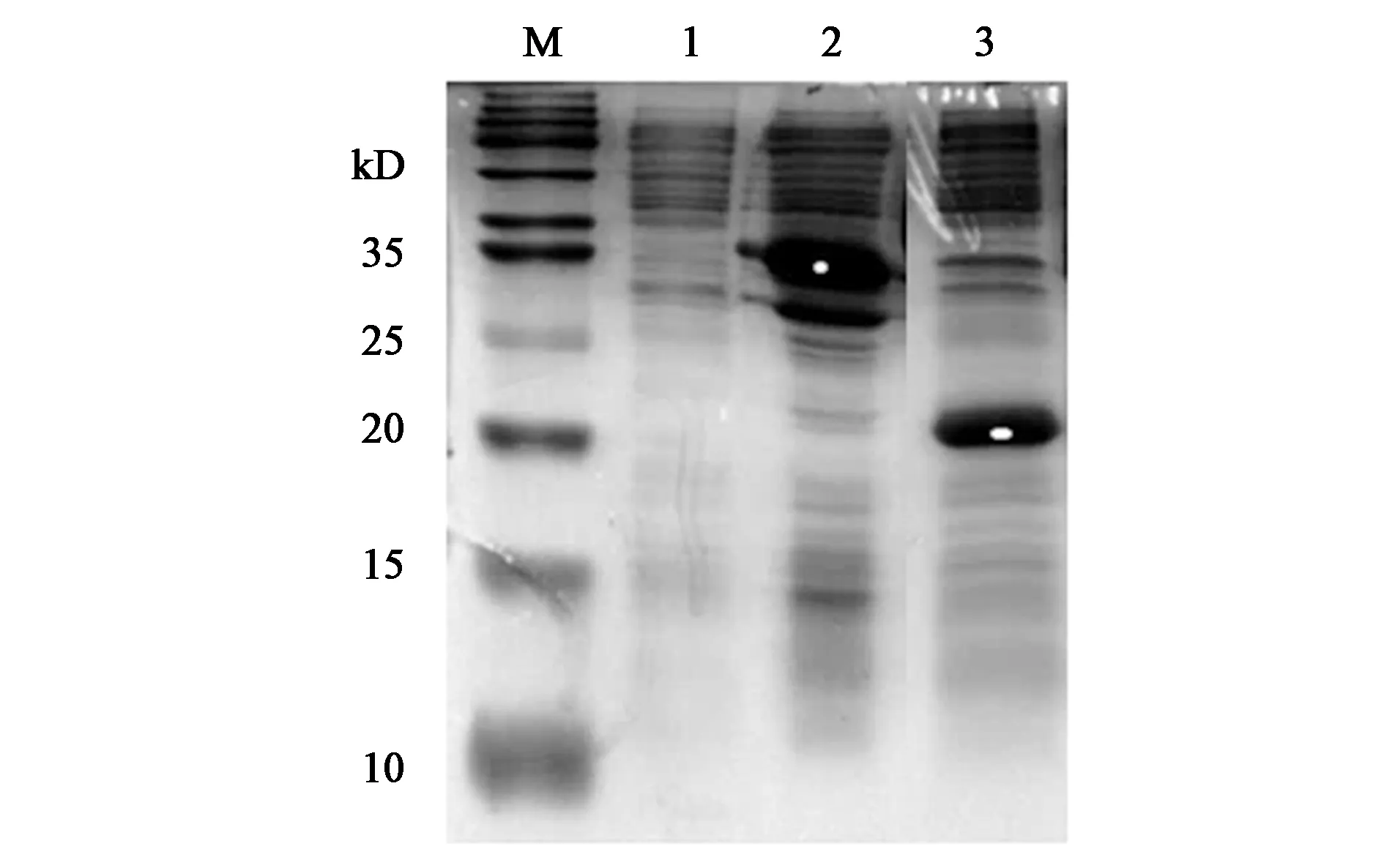
标签S-tag和分子伴侣skp的修饰可提高AmPR-10在大肠杆菌内的可溶性表达量,为进一步探讨融合表达是否对目的蛋白生物活性有影响,研究对3种重组子表达的蛋白进行纯化,按照洗脱液(咪唑)浓度分别为62.5、125及250 mmol·L-1进行梯度洗脱,通过SDS-PAGE检测结果,如图9所示。
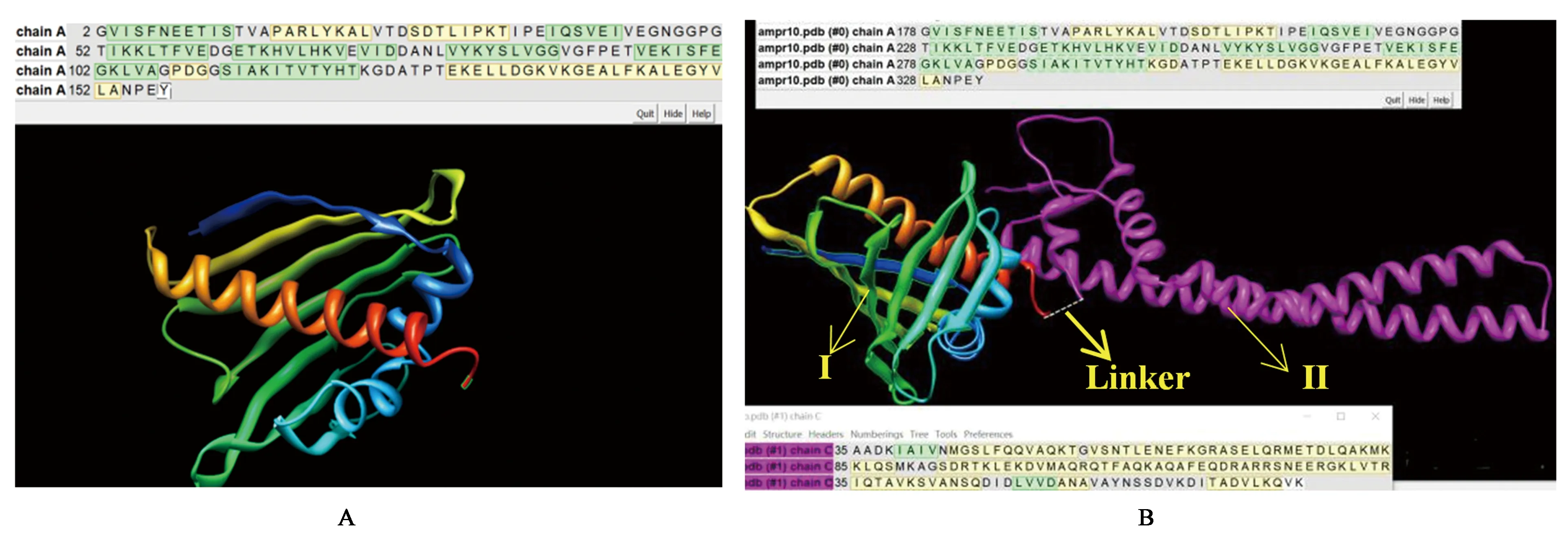
A:AmPR-10三级结构预测模拟图;B:skp与AmPR-10融合表达图8 AmPR-10以及skp与AmPR-10融合表达三级结构预测模拟图Fig.8 The prediction for the 3D structure of AmPR-10 and the fusion protein of skp and AmPR-10
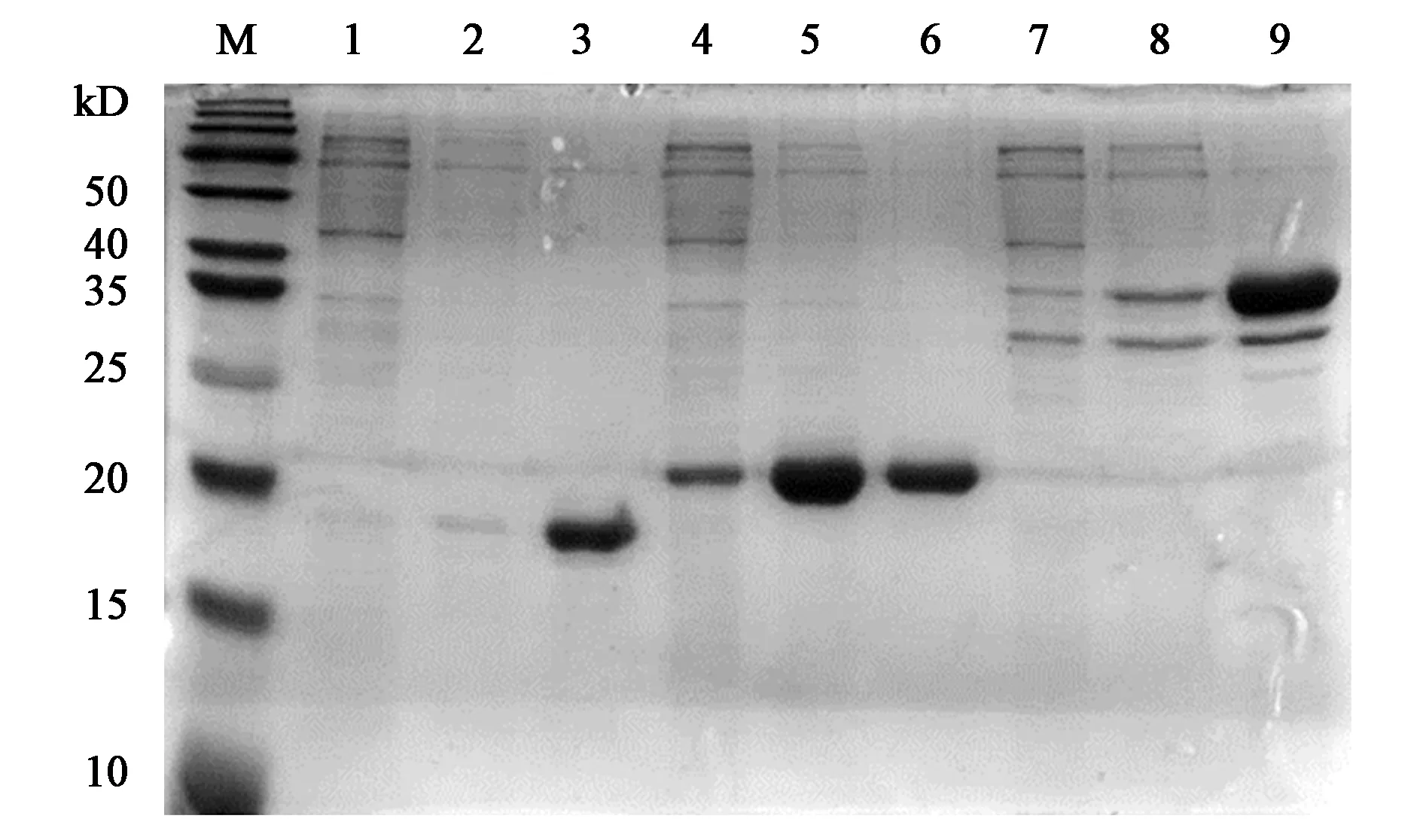
注:M—Marker;1~3—重组子pET28a-AmPR-10表达蛋白纯化结果;4~6—重组子pET30a-AmPR-10表达蛋白纯化结果;7~9—重组子pET30a-skp-AmPR-10表达蛋白纯化结果;洗脱液浓度均依次为62.5、125、250 mmol·L-1。图9 目标蛋白梯度洗脱结果Fig.9 Gradient elution results of target protein
图9中显示洗脱液较高浓度时,目标蛋白纯化效果较好。测定各蛋白浓度,检测出目的蛋白均对酵母tRNA有催化活性,平均值为1.1 U·mg-1,相差不大。说明AmPR-10外源可溶性表达量的提高是以不影响蛋白质生物活性为基础的。
3 讨论
植物病程相关蛋白PR-10是植物体防御体系的重要组成部分,很多蛋白质都已被外源表达,如辣椒病程相关蛋白PR-10体外重组后,可抑制辣椒疫霉菌的菌丝生长[20];刺茄重组病程相关蛋白PR-10可以抑制稻瘟病菌菌丝的生长[21];外源表达的三七病程相关蛋白对腐皮镰刀菌和坏损柱孢菌具有抑制作用[22];本生烟病程相关蛋白经原核表达后成功进行了抗血清制备[23]等。蒙古黄芪病程相关蛋白AmPR-10具有核酸酶活性,与其抗RNA类病毒相关,因此获得大量的具有活性的外源蛋白,有利于后期生物性能的相关研究。目前有关AmPR-10的报道还局限于从天然蒙古黄芪中提取,本研究首次建立目标蛋白在大肠杆菌中的可溶性表达体系,通过更换载体,提高AmPR-10的外源表达量,探讨并确定了载体标签S-tag和分子伴侣skp的生物学功能,利用S-tag和skp的累加效应,实现获得大量外源可溶性AmPR-10的目标,为其活性研究做基础,同时也为其他同源相关蛋白的体外表达提供可参考策略。需要注意的是,目前AmPR-10展现的核酸酶活性并不理想,也没有文献报道其有关抑菌作用的活性,因此后期可考虑深入其生物学活性的探索。通过基因进化等相关技术获得高活性或对底物有广谱性催化作用的目的蛋白,不仅有利于理解黄芪生长发育、抗病免疫的机制,对于抗病毒抗菌制剂的开发也具有重要意义。
