光片荧光显微镜特点及其应用
2021-03-30陈炫亦李绍军陈卫民孟泉科
陈炫亦, 李绍军, 陈卫民, 孟泉科
1.西北农林科技大学创新实验学院, 陕西 杨凌 712100;2.西北农林科技大学生命科学学院, 陕西 杨凌 712100;3.三门峡职业技术学院, 河南 三门峡 472000
在生命科学研究领域中,激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)是光学显微水平上观察生命活动的重要工具,但是其成像模式会对样品和荧光分子产生较大的影响,样品中等焦点以外的荧光分子仍然会被路过的激光激发却不参与成像,等到更换共聚焦点再次激发参与成像时可能会出现光漂白而导致失真;在需要长时间观测高灵敏活性样品的研究中,传统的共聚焦显微镜光毒性较大,会造成样品荧光失活,无法满足高保真观测要求[1-2]。首个真正意义上的光片荧光显微镜(lightsheet fluorescence microscope, LSFM),又名选择平面光照明显微镜(selective plane illumination microscope, SPIM),由Huisken等[3]在《科学》杂志上于2004年报道,距普通光片成像技术的提出(1903年)及荧光显微镜的诞生(1908年)已有百年。光片荧光显微镜作为一种新型荧光显微镜,采用不同于传统共聚焦显微镜的成像模式,大幅降低光毒性,减少了光漂白现象的发生,解决了时空连续性观测大型活体样品内部荧光信号成像难题。鉴于光片荧光显微镜在细胞生物学、发育生物学以及神经生物学等领域的潜在应用价值,与光片荧光显微镜同年诞生的《自然-方法》将其评选为建刊十年以来十大生物学领域新技术之一[4]。
基于此,本文简要介绍光片荧光显微镜的成像原理、成像特点以及标志性改进成像质量的事件,重点介绍光片荧光显微镜在神经生物学、发育生物学、动物细胞生物学和植物科学领域的应用,并对近年来代表性应用进行汇总,旨在帮助研究人员快速了解该显微镜的基本原理及其在生命科学领域中的应用,为相关领域的研究者提供参考。
1 光片荧光显微镜的成像原理、特点与改进
1.1 成像原理
光片荧光显微镜采用薄片层状光源取代了以往荧光显微镜的圆柱状光源,利用柱面镜聚焦或快速扫描高斯光束、贝塞尔光束等方式在探测物镜的焦面产生非常薄的片状光场,在样品内形成一块二维的光平面(sheet),平面内的荧光分子受到光激发产生荧光,形成荧光平面,如同利用光束在立体标本中切出切片一样,“光片(light sheet)”之名由此而来[2,5]。光片的产生方式主要有4种,具体见表1。

表1 4种光片产生方式的比较Table 1 Comparation between four ways of producing light sheet
激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)通常只有1个工作物镜,基于落射式架构的共聚焦显微镜,其物镜同时起到激光光源照明汇聚和样品成像的功能,利用滤色镜将荧光以外的光过滤掉,再通过同一物镜接收激发得到的荧光信号[10]。而光片荧光显微镜通过2个物镜分别完成激发光的照射及荧光信号的收集,将照明和探测成像两个功能分开。片状的激发光源通过一个照明物镜对样品从一侧进行照射,横穿样品内部的扁平光束会在样品中形成一个荧光照射平面。这个二维平面与激发光的轴向呈90°,即照明激发光路与探测光路互相正交,被与激发光束垂直排列的探测成像物镜和相机所采集。由于其激发装置和探测装置在同一平面正交分布,而非在同一条竖线上排列,这使得放置生物样本的承载容器也与传统显微镜的平板状载物台不同(图1)[2, 11]。受到这种装置结构的影响,光片荧光显微镜的样品是装载在含有琼脂糖或氟化乙丙烯的样品圆柱长管中的。共聚焦显微镜的样品通常承载在载玻片或培养皿等平面支持物上,对样品有薄片状的要求;而光片荧光显微镜采用的正交光路设计,使其具有较大的观测空间,可以观测较大的样本,其样品可以是较大尺度的完整胚胎、器官等[5],如秀丽隐杆线虫[12]、黑腹果蝇[13]、斑马鱼[14-15]、夏威夷明沟虾[16]和小鼠[17-19]等模式生物的动物活体胚胎或器官。

图1 光片荧光显微镜的基本原理Fig.1 Basic principle of the light-sheet fluorescence microscope
1.2 成像优势
1.2.1低光毒性、光漂白性与低光损伤 光毒性(phototoxicity)是指在较长时间的强光照射下,活体生物样本细胞内的有机分子会产生分解现象,这是利用激光作为光源进行显微观测时无法避免的[20]。光损伤(photodamage)是指长时间或是高剂量进行激光扫描样品,令样品细胞内有机分子受到破坏的现象[1]。光漂白(photobleaching)指的是荧光分子在光照下荧光褪色减弱的过程,几乎所有的荧光团在光照下都会出现褪色[21]。光毒性、光漂白和光损伤是荧光显微镜、共聚焦显微镜观察样本常面临的负面效应。
共聚焦显微镜基于针孔结构,采用传统的光发射-激发耦合模式,即光的发射与探测装置由二向色镜等效在一条直线上排列且空间重合。在观测样品某一平面的时候将会使样品内大多数的化合物都吸收光,这种无选择性的光照会增大光漂白的影响,容易对样本造成较大的光损伤以及光毒性作用,导致无法长时间连续观测活体样本[20]。而光片荧光显微镜侧向照明的方式使其只需照亮观测平面即可观测所要观测的成像面,使得光毒性和光漂白效应降低几个数量级[21],解决了共聚焦显微镜成像时无法长时间持续观测的问题。
1.2.2高时空分辨率 光片荧光显微镜采用了宽视场的图像采集器如电荷耦合器件(charge coupled device, CCD)相机和科研级互补金属氧化物半导体相机(scientific complementary metal oxide semiconductor, sCMOS),进行逐面成像,使得被激发光所照射的平面所有的荧光信号都能被检测到。结合精确的采样定位系统便可以快速地获得样品多层次的光学切片,还可在低光毒性的基础上对活样本同时进行长时间的多色、多视角成像[20]。
最早的成像模式是保持光片固定不动,沿探测光路轴向移动样品,但由于位移平台速度受限,其成像速度只能达到约10 frames·s-1;随后出现了物镜耦合平面照明显微镜(objective-coupled planar illumination microscope,OCPIM)[22],主要是通过保持样品静止,用移动速度较快的压电位移平台沿轴向同时移动光片和探测物镜进行三维成像,将成像速度提高到了20 frames·s-1,但仅适用于产生高斯光片,其他类型的光片由于需要更复杂的激发装置,无法满足OCPIM的承重要求;再往后出现了解耦合照明探测光片荧光显微镜(decoupled illumination detection-light sheet fluorescence microscope, DID-LSFM)[23],在探测光路中加入三次相位板(cubic phase-mask, CPM)来拓展探测装置的景深,成像速度可以达到1 600 frames·s-1(通过设置感兴趣领域减少相机使用像素数目),这种高时空分辨率的成像模式是其他显微镜难以实现的。但是在引入CPM后,需经后期去卷积处理抵消高速、宽视场成像所带来的分辨率与对比度下降等问题。国内也有相关研究,如胡渝曜等[24]提出通过引入电动可变焦距透镜(electrically tunable lens, ETL)与一维振镜,大幅提高成像速度以突破移动探测物镜或移动样本等方案的速度极限,使单幅图像稳定成像的速度达到275 frames·s-1,此外通过调整光路还有效地减少了高时空分辨率成像过程中伪像的出现。Greer和Holy[25]引入了分布式平面显像(distributed planar imaging)的技术,即在OCPIM的基础架构中的镜筒透镜后置入锋利的棱镜镜面(knife-edged prism mirror, KEM),将图像截成两部分,分别由CMOS相机接收,可以并行对两部分图像处理,而后拼合,提高图像处理速度,支持深达700 μm、每秒扫描28 mm的成像,研究人员将其命名为快速物镜耦合平面照明显微镜(fast objective coupled planar illumination microscopy)。此外,与近年来快速发展的超分辨技术结合,也成为光片荧光显微镜成像模式改进的热点之一,如受激辐射损耗-光片荧光显微镜(stimulated emission depletion selective plane illumination microscope, STED-SPIM)[26]、相干结构照明-光片荧光显微镜(coherent structured illumination light sheet fluorescence microscope, csi-LSFM)[27]等,突破了传统荧光显微镜的光学衍射极限,有效提高了显微镜的分辨率。如Leica公司的TwinFlex可以与自家的SP8超分辨成像技术结合使用。
1.3 成像效果的改进与优化
常见光源的光是容易产生衍射和散射问题的高斯光束(Gaussian beam),存在观测视场与轴向分辨率相互制约的问题。有研究小组选择利用无衍射光束解决这一问题,如利用艾里光束(Airy beam)[28]或贝塞尔光束(Bessel beam)[29]来代替传统的高斯光束来产生光片,显著增强了高散射的大型生物样品的体内细胞分辨率三维成像的信号对比度和成像深度。Wang等[30]以1 320 nm的近红外二区的连续激光为激发光,能够得到中心波长为1 600 nm的发射光,对小鼠脑组织进行非侵入式成像,成像深度达到2 mm。利用光片荧光显微镜观测样品过大仍会造成样本光吸收量和散射过多,从而影响到成像的质量。多向选择性层状光照明显微镜(multidirectional selective plane illumination microscope, mSPIM)的出现解决了这2个问题:首先是从样品的不同角度成像,成像叠加后的结果可以消除样品吸收所引起的激发路径阴影,这个策略也可以解决贝塞尔光片由于旁瓣的存在而导致的成像对比度下降问题;其次,从相反的方向连续照射样品或者是成像后利用算法处理得到优化后的结果,解决了在样品中散射过强的问题[31]。Yang等[32]采用特殊设计的水浸式物镜接收激发光,而后被相机采集,通过改变介质,有效地提高了信号接收率,还可作为附加模块安装到荧光倒置显微镜上,使其能够进行光片荧光显微成像。
对于这种可以进行高时空分辨率成像的显微镜来说,高频的机械偏移使图像质量下降,是一个难以避免的问题。张球等[33]提出利用4f系统和CCD相机跟踪样品的位置并使用纳米平移台对机械漂移进行补偿的方案,有效地减少了机械偏移现象的出现。
在光片荧光显微镜允许尽可能多的光线通过物镜的同时,使得衍射所产生的离焦信号被采集。去卷积算法可以有效解决成像模糊的问题,去卷积(deconvolution)就是利用各种算法消除离焦的图像信号或是对其进行重新分配,提高图像的对比度和分辨率[34]。在单位算力价格逐步下降的今天,计算密集型的去卷积算法愈来愈广泛地应用在光片荧光显微成像中。如Zhang等[35]采用海森正则化(Hessian regularization)算法和修改后的去条纹算法(stripe-removal algorithm)对图像进行处理和重建,能够在较厚的光片中保持高成像对比度和高信噪比的容积成像。此外,Fei等[36]开发了一种新的光片荧光显微镜——亚体素光片荧光显微镜(subvoxel light sheet microscopy, SLSM),通过支持向量回归机(support vector regression, SVR )算法重建一批低分辨率图像。重建4×SLSM采集到的图像分辨率优于同倍数镜SPIM近百倍;4×SLSM的分辨率略优于20×SPIM的分辨率,但成像速度是后者的10倍还多,且光漂白显著低于后者。
目前针对不同的具体研究条件,产生了以正交光路设计为核心的一系列光片荧光显微镜,如在探测物镜焦平面上快速移动聚焦光束,形成一个虚拟光片的数字扫描激光光片显微镜(digitally scanned laser light sheet microscope, DSLM)[20];同时利用3个物镜(2个照明物镜和1个探测物镜),发射两束排在同一直线对射的光束激发样品的多向选择性层状光照明显微镜(multidirectional SPIM, mSPIM)[31];具有多个探测物镜,可多向对立体样本进行信号采集的多视角光片显微镜(multi-view light-sheet microscope, MuVi-LSFM)[5];在倾斜样品内部形成倾斜光片,可以对细胞、秀丽隐杆线虫性腺、果蝇幼虫脑部、小鼠视网膜和脑切片以及整个棘鱼进行深达66 μm超分辨成像的单分子倾斜平面显微镜(single-molecule oblique-plane microscopy, obSTORM)[37]等。
各大公司开发了许多商用光片荧光显微镜。一些显微镜套用的是传统显微镜镜筒装配架构,将平面载物台替换为成像室,侧面有照射物镜。另一些则是采用了集成化箱体设计的非传统显微镜装配架构[5],放弃了传统显微镜的架构使得光片显微镜能在保留核心结构的同时,有了更多灵活的装配空间来观测较大的立体样本。如蔡司(Zeiss)推出的Lightsheet Z.1,呈箱式的外观与传统显微镜相差极大,内部装载有含琼脂糖或聚全氟乙丙烯的样本管;其他比较具有代表性的还有徕卡(Leica)公司的TwinFlex、Luxendo公司的MuViSPIM和InViSPIM等,Lexendo公司生产的这2款显微镜中,MuViSPIM还额外支持样品的旋转功能。
2 光片荧光显微镜的应用
光片荧光显微镜解决了传统的共聚焦显微镜难以长时间观测以及无法对大体积活体样本的观测问题,而这些问题恰恰是研究神经与发育生物学等学科的核心要求。截至2020年12月,被Web of Science数据库收录的以“light sheet fluorescence”或“selective plane illumination”为关键词的文献已有2 263篇,包括但不限于对光片荧光显微镜的改进和应用。
2.1 光片荧光显微镜在神经生物学中的应用
光片荧光显微镜在神经科学领域的应用为中枢神经系统的发育以及获得亚细胞分辨率的完整哺乳动物大脑形态图像等研究提供了可能;使用贝塞尔光束和艾里光束等无衍射光束还可以显著增加混浊神经组织穿透深度的能力[11]。在观测一些密度较大、易造成散射降低成像质量的样品,如大脑、免疫器官、肿瘤组织等时需要作透明化处理,方可达到更理想化的观测效果。Tomer等[13]对发育中的黑腹果蝇胚胎神经系统进行了高分辨率的长期成像,并在体内建立了神经母细胞谱系,还在整个早期胚胎中实现了精准的单细胞自动跟踪。Hahn等[17]在原有3DISCO (3-dimensional imaging of solvent-cleared organ) 技术的基础上开发出了一种新式组织透明技术sDISCO (stabilised 3D imaging of solvent-cleared organs),对小鼠全脑进行了高分辨率的荧光成像。该技术的核心是由1份苯甲醇(benzyl alcohol)和2份苯甲酸苄酯(benzyl benzoate)配制而成的一种组织透明化试剂BABB,它可以作为清除剂将所要观察周围无关的联结组织清理掉,得到更好的深层组织成像效果。研究表明,通过GCaMP对斑马鱼大脑中的钙离子的捕获进而产生荧光,发现丘脑对外界光信号刺激,尤其是对若隐若现的光刺激起到感应器的作用,并将这一信息传达至顶盖,使生物产生逃离的反应[15]。光片荧光显微镜的低光毒性保证了实现长时间检测脑部神经活动的可能性。Misha Ahrens实验室发现位于延髓后侧的一部分去甲肾上腺素能神经细胞能够激活位于延髓侧部的一部分胶质细胞,在必要的时候允许动物选择放弃,抑制持续失败的行为[38]。其实验室在2018年发表在《自然-方法》[39]和《神经元》[40]上的文章提供了该研究使用的光片荧光显微镜、虚拟现实、细胞消融术和光遗传学等技术详细的实验方法与工具说明。此外,还有研究小组首次发现了斑马鱼的睡眠神经信号特征:大脑背侧皮层存在低频率高幅度的簇状放电活动(slow bursting sleep),且端脑存在持续传播的神经信号波,表明脊椎动物大脑中睡眠的共同神经信号可能出现超过了4.5亿年[41]。
2.2 光片荧光显微镜在动物发育生物学中的应用
光片荧光显微技术以其低光毒性和可三维实时成像为核心特性,解决了难以长时间对发育中的生命体进行显微观测的难题,正在成为发育生物学研究中必不可少的研究工具。Ding等[42]利用光片荧光显微镜与配套的荧光友好型组织清理技术(fluorescence-friendly tissue clearing technique)观测了新生儿以及小鼠心脏,量化了心室尺寸,还定位了从出生后到成年小鼠心脏的心脏特异性蛋白和离子通道的空间分布。充分说明了光片荧光显微技术极大地促进了发育生物学所能观测到空间的广度和时间的长度。Wolff等[16]通过对一种海洋甲壳动物——夏威夷明钩虾的胚胎发育过程进行持续长达数天的观察,随后对长出的胸肢在单细胞分辨率下进行细胞重建,分析发现正在生长的早期肢体原基会进一步划分出2个分别进行前-后轴与背-腹轴发育的部分,并于肢远端交汇;肢芽的形成与细胞增殖过程的空间调控有关,同时肢体的伸长也受细胞分裂过程在远-近轴上的优先取向的驱动。Daetwyler等[14]同时对5个活斑马鱼胚胎进行成像,再以红细胞图像作为训练数据,建立了一套可自动化处理并分析数据集的平台。通过平台的分析,得到了一个记录有时间信息且能精准定量的三维血管网络发育模型。有研究报道,将光片荧光显微镜与微粒图像测速(micro-particle image velocimetry, μPIV)技术相结合,对3 d左右斑马鱼幼体的心脏血液流动进行跟踪,根据流动数据模拟重建出心脏血液流动的三维模型,此外还可测算出每次泵动的血液流量[43]。Mcdole等[44]设计了一种智能的光片荧光显微镜,能够自适应性的跟踪胚胎发育过程,构建出小鼠胚胎从原肠胚形成到早期器官发育的全过程,在此基础上该研究小组绘制出了小鼠的高分辨胚胎发育图谱和细胞水平的命运图谱。
2.3 光片荧光显微镜在动物细胞行为相关研究中的应用
光片荧光显微镜的低光毒性、低光漂白性和低光损伤的特点,支持长时间对活细胞进行跟踪。Renkawitz等[45]在借助光片荧光显微镜长时间跟踪细胞行为时,发现了部分种类的癌细胞、中性粒细胞以及T细胞等变形细胞可以利用细胞核衡量路径宽窄,并以此来寻找细胞迁移过程中最易通过路径的行为。Vargas-Patron等[46]对斑马鱼幼体进行了含有荧光标记人胶质母细胞瘤(glioblastoma)细胞的异体移植。通过利用光片荧光显微镜的持续成像,结合流式细胞仪对细胞增殖情况的分析,鉴定出了人胶质母细胞瘤细胞的至少3个细胞增殖周期。同时根据人胶质母细胞瘤在斑马鱼体内的增殖和生长情况,认为其可以作为临床前研究过程中评估抗增殖药物有效性的模型。多形性胶质母细胞瘤(glioblastoma multiforme)会通过诱导血管生成和血管重构来改变健康组织的血管网络,因此研究人员对小鼠大脑进行U87与GL261多形性胶质母细胞瘤的异体移植,通过光片荧光显微镜的成像,建立了移植前后的血管拓扑结构模型[47]。研究发现在整体上基本拓扑结构保持一致,但在细节上发生了许多微妙的改变。移植后的血管拓扑结构具有较高的肿瘤内和肿瘤间异质性,这有助于我们更好的了解这一肿瘤对血管拓扑结构的影响。Prahst等[18]使用光片荧光显微镜对小鼠视网膜组织在细胞和亚细胞水平进行快速、定量的三维及四维时移成像。相对于共聚焦成像时制片对视网膜结构的破坏,光片荧光显微镜可以对整个眼部进行成像,以避免破坏原有组织形态。研究人员运用该显微镜通过氧诱导视网膜病变模型(oxygen-induced retinopathy, OIR)观测到诸如细胞移动异常、细胞丝状伪足的改变以及之前从未观测到的病态血管簇等现象。
2.4 光片荧光显微镜在植物科学中的应用
近年来,在光片荧光显微镜在动物器官和胚胎研究中应用越来越广泛的背景下,植物学家也将其用作研究植物生理生化与发育的新工具。研究人员利用一种荧光能量共振技术结合光片显微镜对拟南芥根尖细胞的胞质及核质中的Ca2+进行动态成像,跟踪其在不同刺激下Ca2+的分布与浓度变化,从而在植物发育与信号转导方面可以获得植物体内高分辨率、在大组织体积深度方面获得可忽略光漂白效应的更精确的研究结果[48]。Jozefamaj实验室分别对拟南芥[49]和紫花苜蓿[50]的根部细胞分裂过程进行长时间成像跟踪。通过对拟南芥根部细胞中磷脂酶Dα(phospholipase D alpha 1)与微管、网格蛋白小泡(clathrin-coated vesicles, CCVs)和网格蛋白小窝(clathrin-coated pits, CCPs)之间的定位,可知细胞是否正在进行分裂;通过对紫花苜蓿根表皮和皮层细胞微管中荧光标记的长时间连续跟踪,得到根部生长速率的信息。De Col等[51]开发出基于荧光能量共振转移的新型ATP荧光感应蛋白——ATeam1.03-nD/nA,结合光片荧光显微镜用于监测细胞质或细胞器(如线粒体)中的MgATP2-,并能绘制出诸如根须等组织的MgATP2-含量与分布图,这套方案能够对活细胞的ATP能量代谢状况进行精准、高效的实时分析,为活细胞能量代谢研究提供了高通量的研究手段。此外,利用对拟南芥花的种系分化(germline differentiation)现象进行多视角跟踪,在亚细胞分辨率下重建出花的三维模型,观察到了雌、雄胚子的减数分裂、花粉不对称分裂、减数分裂过程中染色体的移动以及在绒毡层细胞中异常的再组有丝分裂(unusual restitution mitosis)等现象[52]。Slattery等[53]利用光片荧光显微镜监视叶片内部光环境,对野生大豆和叶绿素b突变体大豆Y11y11叶片的叶绿素与光合光能吸收率进行了分析。使用光片荧光显微镜不仅无需在叶片表面进行多余的处理,还能避免荧光成像时叶绿素所造成的误差和焦平面的光漂白现象。
综上所述,光片荧光显微镜以其宽视野、高时空分辨率及低光毒性、低光损伤等的优势在现代生命科学研究众多领域中迅速崛起,近年来代表性的应用汇总见表2。
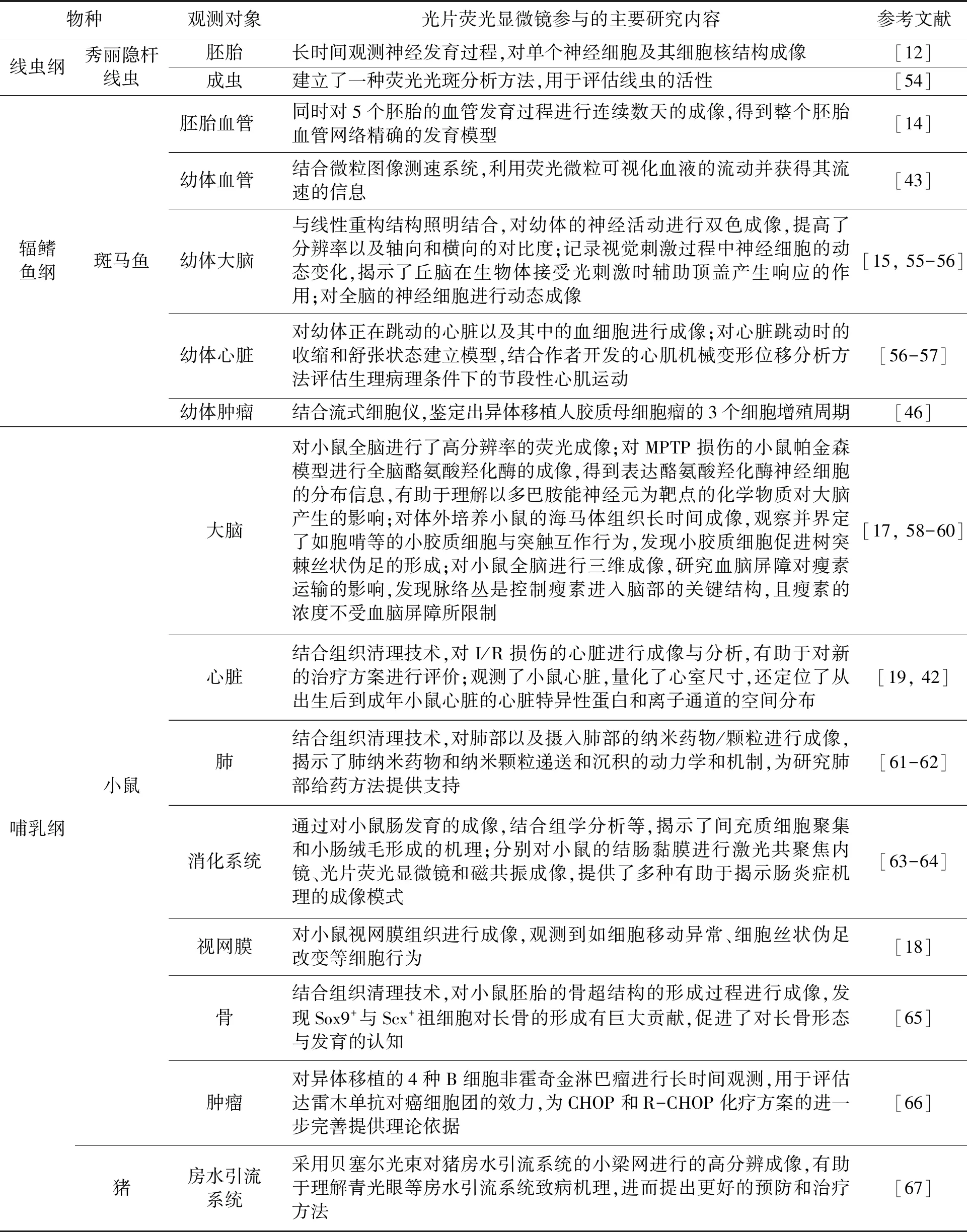
表2 光片荧光显微镜在生命科学领域的应用Table 2 Application of the LSFM in life science

续表物种观测对象光片荧光显微镜参与的主要研究内容参考文献哺乳纲人诱导多能干细胞脂肪干细胞泌尿生殖系统肿瘤免疫细胞体外培养诱导多能干细胞,观察分化心脏微组织的结构与功能,还通过对心肌细胞进行钙成像,检测其不同细胞的功能异质性,为研究组织的结构-功能互作提供新见解[68]结合组织清理技术,在小鼠大脑中观测人诱导多能干细胞源神经前体细胞的分化,分化为神经细胞、星形胶质细胞和寡突胶质细胞,该研究提供了一套研究干细胞分化的成像方法[69]用于观测生物活性玻璃参与诱导脂肪干细胞的成骨分化,开创了新的用于成骨分化和骨再生的立体水凝胶体外培养模式[70]首次系统介绍了利用光片荧光显微镜对胚胎与胎儿内、外生殖器与肾脏的样本制作、成像和体外建模等完整流程[71]对上皮性卵巢癌组织进行成像,发现在癌细胞转移的过程中,血管构造变的无序且密集,减少血流灌输可以有效抑制转移过程,为此类癌症治疗提供了新思路[72]在体外构建出肝癌细胞球状体,使用显微镜观察形态及其功能,发现球状体中的肝细胞会发生极化并形成胆管,进行胆汁排泄,为特定组织的相关研究提供新的思路[73]对部分种类的癌细胞、中性粒细胞以及T细胞等变形细胞进行长时间成像,研究发现其可以利用细胞核宽度寻找最佳运动路径,解答了白细胞等为何能够快速通过致密组织,到达靶点的问题[45]鸟纲斑胸草雀输卵管对斑胸草雀的输卵管组织进行三维成像,研究精子的储存机制,发现了一个可能影响精子选择的门状狭窄开口结构,这是首次对脊椎动物的精子储存器官进行的三维成像与建模[74]昆虫纲果蝇胚胎建立了SiMView成像系统,对胚胎神经系统进行长时间成像,建立神经母细胞谱系,实现了精准的单细胞自动跟踪,提供了高分辨的活体成像方法[13]甲壳纲夏威夷明钩虾胚胎对夏威夷明钩虾胚胎的腹肢发育过程进行长时间成像,这也为其他动物四肢的发育提供了新的研究思路和见解[16]头足纲章鱼胚胎实现了章鱼卵的人工控制孵化,并对章鱼的胚胎进行成像,观测其发育和器官发生事件,为头足类动物发育的研究提供支持[75]珊瑚纲尖枝列孔珊瑚珊瑚共生微生物结合组织清理技术,对珊瑚进行三维成像,还得到了共生微生物的丰度和空间分布,以及对细胞行为的捕捉,为珊瑚相关研究提供了有力的成像方法[76]双子叶植物纲拟南芥紫花苜蓿大豆花根部根部表皮和皮层叶片对拟南芥花的种系分化现象进行多视角跟踪与计算机模拟重建,观察到一系列生殖细胞的细胞活动,为植物有性生殖研究提供新思路[52]对拟南芥根尖细胞胞质及核质中的Ca2+进行动态成像,研究钙信号传递的细胞活动[48]对拟南芥根部细胞中磷脂酶Dα进行定位,结合其他蛋白质的信息,可以确定细胞是否正在进行分裂[49]开发出一种荧光感应蛋白,结合光片荧光显微镜成像,可以监测细胞质或细胞器中的MgATP2-,对活细胞的ATP能量代谢状况进行定量分析[51]对根部进行成像,研究植物与4种真菌的互作关系,以及真菌对植物分泌IAA与JA的影响,为研究植物-微生物互作机理的研究提供新思路[77]对紫花苜蓿根表皮和皮层细胞成像,得到根部生长速率的信息[50]对野生大豆和叶绿素b突变体大豆叶片的叶绿素与光合光能吸收率进行分析,发现叶绿素含量会极大地影响光衰减效应[53]

续表物种观测对象光片荧光显微镜参与的主要研究内容参考文献丝胞纲烟曲霉菌体对3种类型的小鼠侵袭性肺曲霉病模型肺部进行成像,观测菌体生长与侵蚀小鼠肺部情况,揭示了抗真菌过程中肺泡巨噬细胞和多形核中性粒细胞这2个关键免疫细胞群的空间分布、相互作用和激活事件,有助于理解复杂的宿主-病原体互作和对小鼠模型的优化[78]
3 展望
作为一类新式显微镜,光片荧光显微镜在保持高空间分辨率和最小化光漂白与光毒性的同时,进行容积成像。该显微镜所具有的较低的光毒性、高时空分辨率、宽视场、大型样本成像、与不同激发态的相容性以及可以与其他现有成像技术和组学分析相结合的特性日益发展成熟,将满足科研领域日益增长的对整个生物体、组织和细胞快速、温和条件成像的需求。
在光遗传学中,通过向神经元中导入特定基因,表达的光敏蛋白能将光信号转换成电信号,再利用光的有无控制神经细胞的活跃与否[11]。脑的神经连接复杂,神经元之间连接转换处理各种信号的数量是天文数字级别,而对某些神经官能疾病,例如对某些行为的神经网络调控路线,我们要有效的追踪哪些细胞与诸如语言迟滞、强迫症等有关的神经疾病活动有关联——是激活行为还是关闭行为。因此或许可以将光片荧光显微镜同光遗传学技术结合起来,利用LSFM对组织的光照穿透力等特性,实现光控特定荧光标记细胞进行细胞生物学过程的研究。目前美国霍华德·休斯医学研究所的Keller课题组已经采用光遗传学或化学遗传学的方法对神经通路进行干涉并应用于研究中[38-39]。除此之外,光片荧光显微镜作为高时空分辨率的观测装置,还可与当前热门的诸如基因组学、转录组学以及蛋白质组学等多组学研究乃至基因编辑技术相结合[79],通过将观察性研究与构建细胞动态变化模型、细胞分子互作网络的构建及信息整合挖掘的研究相联系,有望统一长期以来对不同细胞种类定义研究领域“百家争鸣”的局面, 为多维度认知细胞发育、行为和互作关系等提供了有力的技术支持。此外,大量的图像数据已难仅靠人力进行处理,以图像识别领头的一系列深度学习技术渐渐成为该领域标本信息分析的“标配”,协助研究人员进行研究;反卷积算法的应用能够有效解决宽视场成像所带来的成像质量低的痛点,由此可以预见到愈来愈多计算机科学元素的加入是未来光片荧光显微镜发展的大势所趋[35-36, 38]。光片荧光显微镜模块化的装配模式,使其包容性足够大,有研究小组将其与药物的高通量筛选系统结合,使得可以实时观测药物对如神经活动作用的效果[80]。
目前在光片荧光显微镜使用过程中仍会有一些局限,譬如在观测心脏等器官时,残留的血红蛋白会干扰荧光分子,产生假阳性信号,还会在观测中遇到生理伪影等的问题[30, 81];一些比较厚的组织较强的光散射会造成成像质量不足[30];以及成像所产生的数据常以太比特计量,需要大量的储存介质保存。但从目前应用来看,光片荧光显微镜可以为细胞生物学、发育生物学以及神经科学等提供独特优势的成像视域并促进学科的进一步发展。
