利用超微粉碎提高花色苷生物可接受率
2021-03-30张佩雯黄光捷骆昌锦冼莹莹周欣燕郭红辉
张佩雯,黄光捷,骆昌锦,冼莹莹,周欣燕,郭红辉,*
(1.广东医科大学公共卫生学院,广东 东莞 523808;2.韶关学院英东食品学院,广东 韶关 512005)
花色苷是具有2-苯基苯并吡喃结构的一类植物化学物,对可见光的最大吸收波长在460 nm~540 nm处,可以使植物呈现红色、紫色乃至黑色。深色植物性食品中的花色苷含量较为丰富,例如浆果(越橘、蓝莓、草莓、葡萄和黑醋栗等)、蔬菜(紫甘蓝、紫洋葱和红菜薹等)、薯类(紫马铃薯和紫番薯)和谷物(高粱、紫玉米和黑米等),花色苷含量通常介于50 mg/kg~3 100 mg/kg(以鲜重计),平衡膳食者每天通过这些食物可以摄入数十毫克的花色苷[1-2]。除了赋予植物性食品鲜艳的色泽,近年来的流行病学研究发现增加膳食花色苷摄入有助于降低非酒精性脂肪性肝病、2型糖尿病及心血管疾病等慢性代谢性疾病的发病风险[3-4]。根据已有对慢性病人群的随机对照临床干预试验结果,中国营养学会提出花色苷预防慢性病的摄入量特定建议值为50.0 mg/d[5]。然而,由于食物破碎程度和基质成分的影响,不同食物来源花色苷的生物利用度和生物活性差异较大,摄入量和健康效应之间的量效关系尚不明确,无法制定准确的摄入量参考值范围[6]。
花色苷的化学结构含有多个酚羟基,极性较强,容易与蛋白质、膳食纤维等食物基质成分结合在一起,加上细胞壁对消化酶的物理阻隔效应,在消化过程中难以释放出来,无法被吸收利用[7-8]。准确判定膳食花色苷经过胃肠消化后可被机体利用的程度,即花色苷的生物可接受率或生物利用度,是建立摄入量和健康效应关系的前提条件。体内试验往往存在研究周期长、个体间的差异、结果重现性差、费用高、伦理限制等问题,而近些年不断完善的体外模拟胃肠消化模型为研究多酚类植物化学物的生物利用提供了便利条件[9]。模拟体外消化模型分为胃消化和肠消化两个阶段。基于国际多领域专家共识的INFOGEST建立了一套更加接近人体生理环境的体外口腔-胃-小肠模拟消化吸收模型,对不同食物当中的营养素进行了体外模拟消化吸收研究,提出可以用消化液当中营养物质的释放量与总摄入量的比值表示其生物可接受率,模拟某种营养物质在机体的消化吸收利用情况[10]。
因此,本研究选择蓝莓、紫甘蓝、紫番薯和黑米分别作为浆果、蔬菜、薯类和谷物的代表性食物,通过超微粉碎和消化酶破除细胞壁和食物基质对花色苷的束缚作用,利用体外胃肠消化模型研究花色苷生物可接受率的变化,为准确评估食物花色苷可被机体利用的程度提供科学依据。
1 材料与方法
1.1 原料与试剂
“兔眼”蓝莓:安庆市茂祥农业科技发展有限公司;紫甘蓝、“广紫薯八号”紫番薯、黑米:韶关市农贸市场。胃蛋白酶(≥250 U/mg):西格玛奥德里奇(上海)贸易有限公司;猪胆盐和猪胰酶复合物(蛋白酶≥100 U/mg,淀粉酶≥100 U/mg,脂肪酶≥8 U/mg):广州鼎国生物技术有限公司;C18色谱柱(粒径5μm,250mm×4.6mm)、甲醇、甲酸色谱纯:北京迪马欧泰科技发展中心;其它化学试剂为市售分析纯。
1.2 主要仪器设备
DHG-9420A电热恒温鼓风干燥箱、DZF-6050真空干燥箱:上海一恒科学仪器有限公司;DLF18中药粉碎机:温州顶历医疗器械有限公司;YF2-2气流式超微粉碎机:瑞安永历制药机械有限公司;SHA-B恒温振荡水浴锅:常州普天仪器制造有限公司;TM3030电子显微镜:日立高新技术公司;LS-POP激光粒度仪:珠海欧美克仪器有限公司;LC-20AT高效液相色谱仪:岛津企业管理(中国)有限公司。
1.3 试验方法
1.3.1 植物材料粉碎
60℃条件下,利用鼓风干燥箱和真空干燥箱将蓝莓、紫甘蓝、紫番薯和黑米干燥至含水量≤10%。植物材料投料进入中药粉碎机中进行机械粉碎,得到粗粉;利用气流式超微粉碎机将植物材料粗粉在转速20 000 r/min条件下粉碎两次,每次3 min,得到超微粉。将制备好的粉末用铝箔袋密封,置于-18℃冰箱中保藏待用。
1.3.2 粒度测定
准确称取粗粉和超微粉样粉各1.00 g,溶于80 mL蒸馏水中,用磁力搅拌器搅拌10 min至均匀,使用激光粒度分析仪测定样品粒径,采用公式计算离散度表示样品粒径的分布情况。
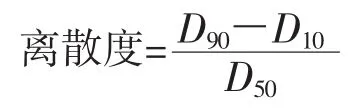
式中:Dn代表有n%的颗粒粒径小于该数值[11]。
1.3.3 显微形貌
将粗粉与超微粉分别均匀粘附在导电胶带上,置于载物台,选择5个视野拍照。
1.3.4 主要营养成分和花色苷含量测定
参照现行食品安全国家标准[12]分别测定脂肪(GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》)、蛋白质(GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》)、总膳食纤维(GB 5009.88—2014《食品安全国家标准食品中膳食纤维的测定》)、水分(GB 5009.3—2016《食品安全国家标准食品中水分的测定》)和灰分(GB 5009.4—2010《食品安全国家标准食品中灰分的测定》)的含量,计算出碳水化合物含量(GB/Z 21922—2008《食品营养成分基本术语》)[12]。
准确称量1.00 g粉体,投入10 mL甲醇,密封后在37℃的恒温水浴摇床中60 r/min振荡提取2 h,0.45 μm微孔滤膜过滤,用分光光度计在520 nm处测定滤液吸光度,采用公式计算粉体花色苷含量[8]。
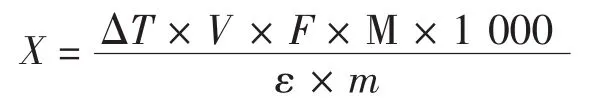
式中:X为粉体花色苷含量,mg/g;ΔT为pH1.0和pH4.5缓冲液稀释待测液后的吸光度差值;V为稀释体积,L;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的相对分子质量(M=449.2);ε为矢车菊素-3-葡萄糖苷的摩尔消光系数[ε=26 900 L/(mol·cm)];m为样品质量,g。
1.3.5 模拟消化
取植物材料粗粉和超微粉各1.00 g置于离心管中,加入人工胃液15 mL(表1)[10],用1 mol/L盐酸调节溶液pH值为2.0,置于振荡速率为40 r/min,37℃的恒温水浴摇床中避光振荡2h,完成模拟胃消化;加入25mL人工肠液,用饱和NaHCO3溶液调节pH值为6.8,置于振荡速率为60 r/min,37℃恒温水浴摇床避光振荡4 h,完成模拟小肠消化;收集消化液,0.45 μm微孔滤膜过滤,在高效液相色谱仪检测滤液花色苷含量,以同体积甲醇代替人工胃液和肠液,作为花色苷最大释放量参照[13]。
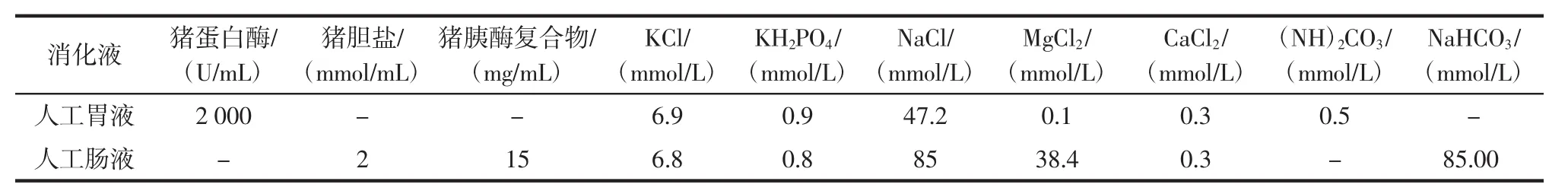
表1 人工消化液组成Table 1 Composition of simulated digestion fluids
1.3.6 花色苷生物可接受率
高效液相色谱仪进样量为20 μL,洗脱速度设置为1.0 mL/min,流动相A为甲醇,流动相B为2%甲酸水溶液,检测波长为520 nm,梯度洗脱:0~5 min,90%B;5 min~35 min,90%~60%B;35 min~55 min,60%~40%B;55 min~60 min,40%~0%B;60 min~70 min,90%B。
对各个样品消化液花色苷峰面积进行自动积分求和,以甲醇提取样品的花色苷峰面积总和设定为100%,采用公式计算花色苷生物可接受率[13]。

1.3.7 数据处理
使用SPSS 19.0软件对数据进行处理,结果用3次重复试验数据±S表示,对粗粉与超微粉的理化参数运用独立样本t检验的方法进行分析,对花色苷生物可接受率采用单因素方差分析(one-way ANOVA)比较差异,检验水准设为p<0.05。
2 结果与讨论
2.1 超微粉碎对食物样品粒径分布的影响
食物样品粗粉和超微粉粒径分布见表2。

表2 食物样品粗粉和超微粉粒径分布Table 2 Particle size distribution of coarse and superfine food powders
植物细胞的直径通常为30 μm~100 μm,一般机械粉碎得到的粉体直径约为150 μm~300 μm,很难将细胞壁破碎[14]。经过超微粉碎,4种食物样品的粒径D10、D50和D90均显著低于粗粉(表2),其中D50符合超微粉的粒径判断标准(≤25 μm),从而达到了破除细胞壁的预期效果[15]。紫甘蓝、黑米和紫番薯3种食物样品超微粉离散度均显著小于粗粉,说明其粒径分布更加均匀;然而,超微粉碎并未使蓝莓果粉离散度显著降低,可能与浆果中果胶质含量较高,粉体不易分散有关[16]。
2.2 不同粉体的显微形貌
4种样品粗粉和超微粉放大400倍的显微形貌如图1所示。
由图1可知,粗粉颗粒明显大于超微粉,紫甘蓝、黑米和紫番薯3种离散度较大的粗粉粒径大小更为不均匀,形状也不规则;与其他学者的研究结果相似[14-15],经过超微粉碎,食物样品的绝大部分纤维束冠状结构被破碎,质地更加蓬松,粉体颗粒大小均匀,直径较小,颗粒形貌趋于一致。

图1 各种食物粉体显微形貌Fig.1 The micromorphology of various food powders
2.3 超微粉碎对食物样品主要营养成分的影响
食物破碎程度会直接影响到消化酶与食物颗粒的接触,从而决定营养素的消化吸收率[17]。为明确粉碎程度对宏量营养素释放的影响,利用国家标准食品理化检验方法对4种食物样品的营养成分组成做了分析,结果见表3。

表3 4种食物样品粗粉和超微粉的营养成分组成Table 3 Nutrient composition of coarse and superfine powders of four food samples
表3结果表明,粉碎程度对食物脂肪、蛋白质、碳水化合物、总膳食纤维和灰分含量检测值并没有造成显著影响。经过超微粉碎后,由于破除了细胞壁和部分食物基质对花色苷释放的阻隔作用,4种食物样品的花色苷含量检测值均有显著提高,其中蓝莓和紫甘蓝的检测值增加幅度统计学差异极显著(p<0.01)。
2.4 超微粉碎和纤维素酶对食物样品花色苷生物可接受率的影响
花色苷的生物活性大小取决于其被机体吸收和利用程度,现有动物整体生物利用度试验和人群代谢动力学试验研究结果显示,不同食物来源花色苷的生物利用度差异较大,介于0.8%~12.4%之间[18],生物利用度从大到小顺序为:花色苷单体、花色苷提取物、澄清果汁和固态食物[19]。花色苷在植物细胞内可以通过共价键、氢键和亲水作用力与碳水化合物和蛋白质等基质成分结合,在胃消化阶段,胃液的强酸性可以将部分花色苷从食物基质解离出来,通常不同食物花色苷的释放量差别不大,而在肠消化阶段,pH值偏碱性,花色苷的化学结构由黄烊盐阳离子转变为查尔酮或者甲醇式假碱,与食物基质结合更加紧密,就需要蛋白酶和淀粉酶酶解将花色苷从食物基质释放[20]。超微粉碎和纤维素酶对食物样品花色苷生物可接受率的影响结果见图2。
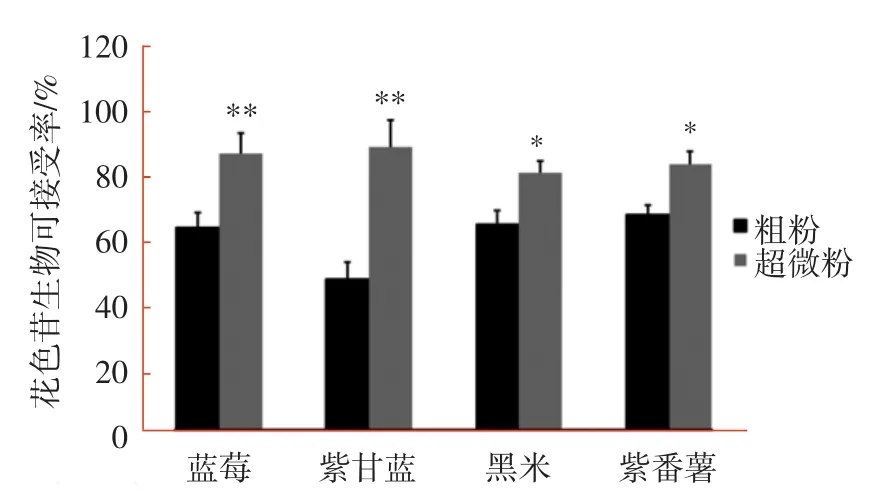
图2 4种食物样品粗粉和超微粉的花色苷生物可接受率Fig.2 Anthocyanin bioaccessibility of coarse and superfine powders of four food samples
图2结果显示,蓝莓、黑米和紫番薯粗粉花色苷的生物可接受率均超过60%,而紫甘蓝粗粉的生物可接受率最低,仅为46.5%。细胞壁的物理阻隔和食物基质结合效应可能是影响花色苷在肠道被吸收利用的主要因素[21]。进一步对超微粉花色苷生物可接受率的检测结果表明,蓝莓、紫甘蓝、黑米和紫番薯超微粉花色苷峰面积均显著大于粗粉(p<0.05),计算得到的花色苷生物可接受率较粗粉分别提高37.1%、87.7%、24.7%和23.8%,说明超微粉碎可以有效提高花色苷的生物可接受率。与pH示差法检测花色苷总量结果相似(表3),蓝莓和紫甘蓝不同粉体花色苷的生物可接受率差异极显著,可能与粉体较高膳食纤维含量有关。
3 结论
综上所述,超微粉碎可以有效破除细胞壁和食物基质对蓝莓、紫甘蓝、黑米和紫番薯中花色苷的阻隔效应,将花色苷的生物可接受率提高23.8%~87.7%。在利用纤维素含量较高的植物材料制备花色苷提取物或者固体饮料等富含花色苷的食品时,通过超微粉碎辅助处理原料将有助于提高花色苷的提取效率或者机体对花色苷的吸收利用程度。
