双氢青蒿素对类风湿关节炎患者外周血单个核细胞TLR/MyD88信号通路的影响研究
2021-03-26闫慧明安燕张雪刘咏梅秦洁莉刘远王武龙岳建伟赵洪
闫慧明,安燕,张雪,刘咏梅,秦洁莉,刘远,王武龙,岳建伟,赵洪
类风湿关节炎(RA)是以慢性破坏性多关节炎为主要表现的自身免疫性疾病,病理变化是自身免疫异常引起的致炎细胞因子和炎性递质等释放,其发病机制目前尚未完全明确,如不及时有效诊治,70%的患者2年后可发生不可逆的关节破坏、畸形和功能丧失。大量研究证实Toll样受体(TLR)/髓样分化因子88(MyD88)信号通路在RA的发病中具有重要作用[1]。MyD88是TLR信号通路中的一个关键的转导蛋白,其死亡结构域的缺失可导致下游产生炎性细胞因子白介素(IL)-6、IL-12及肿瘤坏死因子α(TNF-α)作用明显减弱,现有研究认为双氢青蒿素(DHA)及其衍生物对免疫系统有双向调节作用[2]。国内外关于DHA对RA作用机制的研究较少,认为其可干预TLR介导的信号通路[3]。本研究通过DHA干预RA患者TLR/MyD88介导的信号通路,探讨DHA治疗RA的可能作用机制,为RA治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2017年10月—2018年12月于内蒙古科技大学包头医学院第二附属医院就诊的活动期RA患者10例为观察组,均符合2010年美国风湿病学会/欧洲抗风湿联盟(ACR/EULAR)中的相关诊断标准[4]。10例患者中男2例,女8例;年龄25~79岁,平均(52.2±19.5)岁。同时随机选取本院体检中心健康体检者10例为对照组,其中男2例,女8例;年龄29~40岁,平均(34.2±4.8)岁。排除患有血液系统、心脑血管系统及其他自身免疫性疾病如系统性红斑狼疮、干燥综合征等患者。研究对象均签署了知情同意书。本研究通过了内蒙古科技大学包头医学院第二附属医院伦理委员会审查。
1.2 试剂与仪器 人外周血淋巴细胞分离液、PBS、RPMI-1640培养基、胎牛血清、Trizol试剂、Ficoll细胞分离液、cDNA第一链合成试剂盒、SDS-PAGE凝胶配制试剂盒购自大连宝生物公司,TLR2抗体及抑制剂、MyD88抗体、TNF-α试剂盒、IL-6试剂盒购自美国Pepro Tech公司,DHA购自四川光大制药有限公司,荧光定量PCR循环仪购自ABI-7500美国 Thermo公司,Western电泳仪购自美国伯乐公司,流式细胞仪购自美国 Beekton Dickson 公司。
1.3 人外周血淋巴细胞分离、培养 两组研究对象于清晨空腹时抽取肝素抗凝静脉血5 ml,立即置于离心机,离心半径12 cm,4 000 r/min离心10 min分离血浆,收集2 ml于冻存管中存于-80 ℃冰箱备用。实验前室温冻融冻存管30 min,用密度梯度离心法分离外周血单个核细胞(PBMCs),调整细胞浓度至5×106/ml,接种于24孔细胞培养板,每孔1 ml,置于37℃ 5%CO2培养箱中培养4 h后弃上清,将37 ℃预热PBS轻洗细胞培养板2遍,获得贴壁的PBMCs。RPMI-1640完全培养基重悬(内含100 U/ml青霉素,100 µg/ml链霉素,10%胎牛血清)PBMCs。将PBMCs分为5组,每组设5个复孔。(1)对照组:健康志愿者外周血PBMCs,不给予干预TLR介导的信号通路;(2)RA组:RA患者外周血PBMCs,不给予干预TLR介导的信号通路;(3)TLR2抑制剂组:RA患者外周血PBMCs,给予100 µg/L的TLR2抑制剂干预TLR介导的信号通路;(4)DHA低剂量组:RA患者外周血PBMCs,给予200 µmol/L的DHA干预TLR介导的信号通路;(5)DHA高剂量组:RA患者外周血PBMCs,给予1 000µmol/L的DHA干预TLR介导的信号通路。置于37 ℃、5% CO2培养箱中培养24 h后收获细胞。
1.4 TLR2阳性率检测 采用双色荧光法检测PBMC上TLR2阳性率,用Cell Quest软件获取和分析数据。
1.5 RT-PCR法 检 测TLR2 mRNA、MyD88 mRNA Trizol法提取外周血PBMCs的总RNA,紫外分光光度仪测定RNA的质量和浓度。采用Primer5软件设计引物(南京金斯瑞科技有限公司,见表1)。取RNA样品5 µl,甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,使用试剂盒逆转录合成cDNA。Real-time PCR反应条件:94 ℃、5 min×1 次,94 ℃、30 s,52 ℃、15 s,72 ℃、30 s,循环35次,72 ℃、5 min×1次。溶解曲线:以60 ℃为初始温度,每隔30 s升高0.5 ℃,直到温度上升至95 ℃,测定TLR2 mRNA、MyD88 mRNA。

表1 引物序列Table 1 Primer sequence
1.6 Western blotting法检测TLR2、MyD88 用等量的蛋白样本(50 µg)进行SDS-PAGE凝胶电泳,湿法转膜,5%脱脂奶粉封闭过夜(4 ℃),弃封闭液。加入封闭液稀释好的TLR2、MyD88及GAPDH抗体(1∶1 000),TBST漂洗滤膜4次,10 min/次。将膜与辣根过氧化酶标记的二抗(1∶5 000),室温下摇荡孵育2 h,然后用TBST充分洗膜,漂洗4次,10 min/次。显影液置膜上,凝胶成像仪成像。GAPDH表达作为内参蛋白,得出TLR2/GAPDH,MyD88/GAPDH的比值。
1.7 ELISA法检测TNF-α、IL-6水平 使用酶标仪ELISA方法检测上清液中TNF-α、IL-6水平,具体实验操作按照试剂盒说明书进行。
1.8 统计学方法 应用SPSS 21.0软件进行数据的处理分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较用SNK-q检验,若方差不齐用Dunnett's T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 TLR2阳性率比较 5组TLR2阳性率比较,差异有统计学意义(P<0.05)。其中RA组TLR2阳性率高于对照组、TLR2抑制剂组,差异有统计学意义(P<0.05);DHA低剂量组TLR2阳性率高于对照组、TLR2抑制剂组、DHA高剂量组,差异有统计学意义(P<0.05,见表2)。
表2 五组TLR2阳性率比较(±s,%,n=3)Table 2 Comparison of the TLR2 positive expression rate in five groups

表2 五组TLR2阳性率比较(±s,%,n=3)Table 2 Comparison of the TLR2 positive expression rate in five groups
注:DHA=双氢青蒿素,RA=类风湿关节炎;与对照组比较,aP<0.05;与TLR2抑制剂组比较,bP<0.05;与DHA低剂量组比较,cP<0.05
组别 TLR2阳性率对照组 0.03±0.01 TLR2抑制剂组 1.05±0.32 RA组 5.93±2.31ab DHA低剂量组 3.65±1.02ab DHA高剂量组 2.38±0.96c F值 12.536 P值 <0.001
2.2 TLR2 mRNA、MyD88 mRNA比 较 5组 TLR2 mRNA、MyD88 mRNA比较,差异有统计学意义(P<0.05)。其中RA组TLR2 mRNA、MyD88 mRNA高于对照组、TLR2抑制剂组,差异有统计学意义(P<0.05);DHA低剂量组TLR2 mRNA、MyD88 mRNA高于对照组、TLR2抑制剂组、DHA高剂量组,差异有统计学意义(P<0.05,见表3)。
表3 五组TLR2 mRNA、MyD88 mRNA比较(±s,n=3)Table 3 Comparison of the expression levels of TLR2 mRNA and MyD88 mRNA in five groups
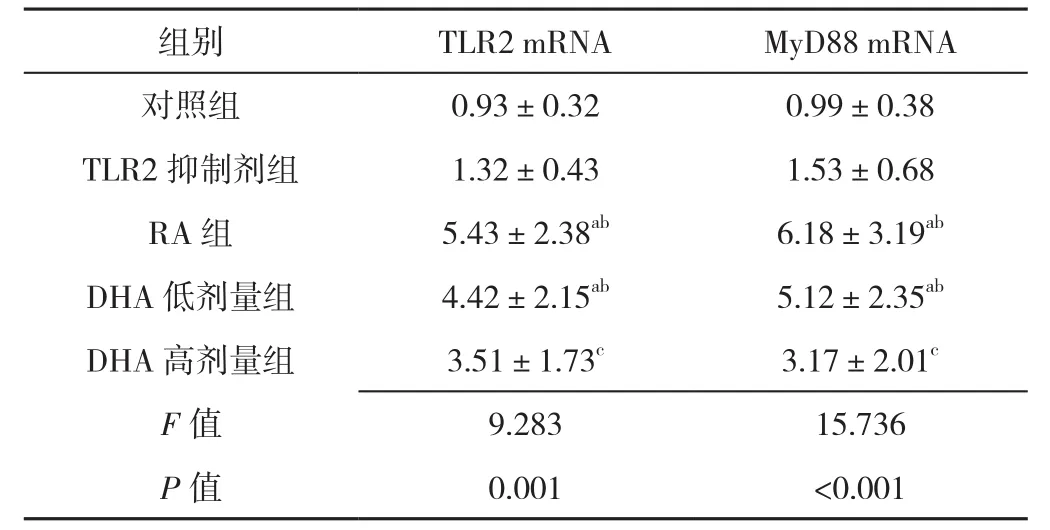
表3 五组TLR2 mRNA、MyD88 mRNA比较(±s,n=3)Table 3 Comparison of the expression levels of TLR2 mRNA and MyD88 mRNA in five groups
注:与对照组比较,aP<0.05;与TLR2抑制剂组比较,bP<0.05;与DHA低剂量组比较,cP<0.05
组别 T L R 2 m R N A M y D 8 8 m R N A对照组 0.9 3±0.3 2 0.9 9±0.3 8 T L R 2抑制剂组 1.3 2±0.4 3 1.5 3±0.6 8 R A 组 5.4 3±2.3 8 ab 6.1 8±3.1 9 ab D H A低剂量组 4.4 2±2.1 5 ab 5.1 2±2.3 5 ab D H A高剂量组 3.5 1±1.7 3 c 3.1 7±2.0 1 c F值 9.2 8 3 1 5.7 3 6 P值 0.0 0 1 <0.0 0 1
2.3 TLR2、MyD88比 较 5组 TLR2、MyD88比 较,差异有统计学意义(P<0.05)。其中TLR2抑制剂组、RA组、DHA低剂量组、DHA高剂量组TLR2、MyD88高于对照组,差异有统计学意义(P<0.05)。RA组TLR2、MyD88高于TLR2抑制剂组,差异有统计学意义(P<0.05);DHA低剂量组TLR2、MyD88高于DHA高剂量组,差异有统计学意义(P<0.05,见表4)。
表4 五组TLR2、MyD88比较( ±s,n=3)Table 4 Comparison of the expression levels of TLR2 and MyD88 in five groups
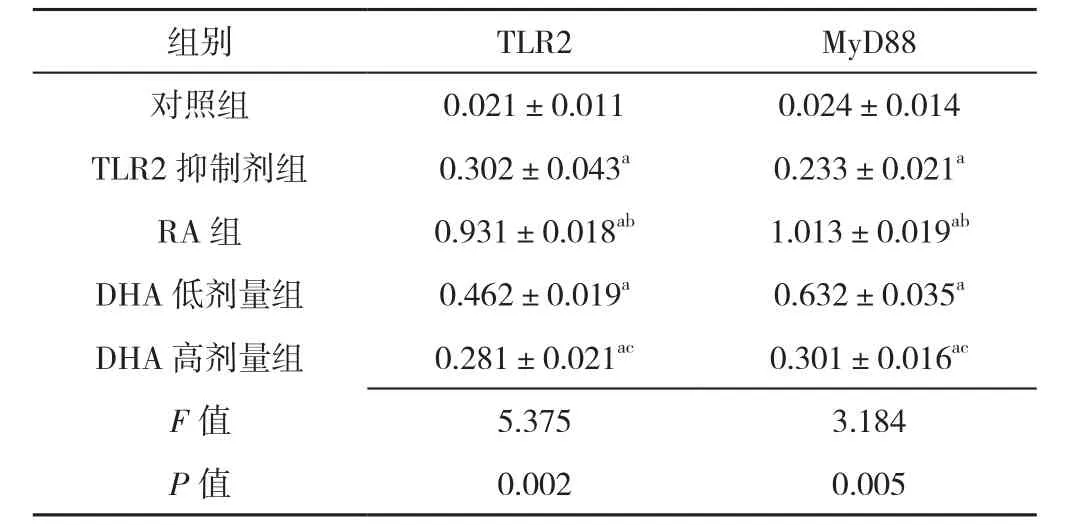
表4 五组TLR2、MyD88比较( ±s,n=3)Table 4 Comparison of the expression levels of TLR2 and MyD88 in five groups
注:与对照组比较,aP<0.05;与TLR2抑制剂组比较,bP<0.05;与DHA低剂量组比较,cP<0.05
组别 T L R 2 M y D 8 8对照组 0.0 2 1±0.0 1 1 0.0 2 4±0.0 1 4 T L R 2抑制剂组 0.3 0 2±0.0 4 3 a 0.2 3 3±0.0 2 1 a R A 组 0.9 3 1±0.0 1 8 ab 1.0 1 3±0.0 1 9 ab D H A低剂量组 0.4 6 2±0.0 1 9 a 0.6 3 2±0.0 3 5 a D H A高剂量组 0.2 8 1±0.0 2 1 ac 0.3 0 1±0.0 1 6 ac F值 5.3 7 5 3.1 8 4 P值 0.0 0 2 0.0 0 5
2.4 TNF-α、IL-6水平比较 5组TNF-α、IL-6水平比较,差异有统计学意义(P<0.05)。其中TLR2抑制剂组、RA组、DHA低剂量组、DHA高剂量组TNF-α、IL-6水平高于对照组,差异有统计学意义(P<0.05)。RA组TNF-α、IL-6水平高于TLR2抑制剂组,差异有统计学意义(P<0.05);DHA低剂量组TNF-α、IL-6水平高于DHA高剂量组,差异有统计学意义(P<0.05,见表5)。
表5 五组TNF-α、IL-6水平比较( ±s,mmol/L)Table 5 Comparison of TNF-α and IL-6 levels in five groups
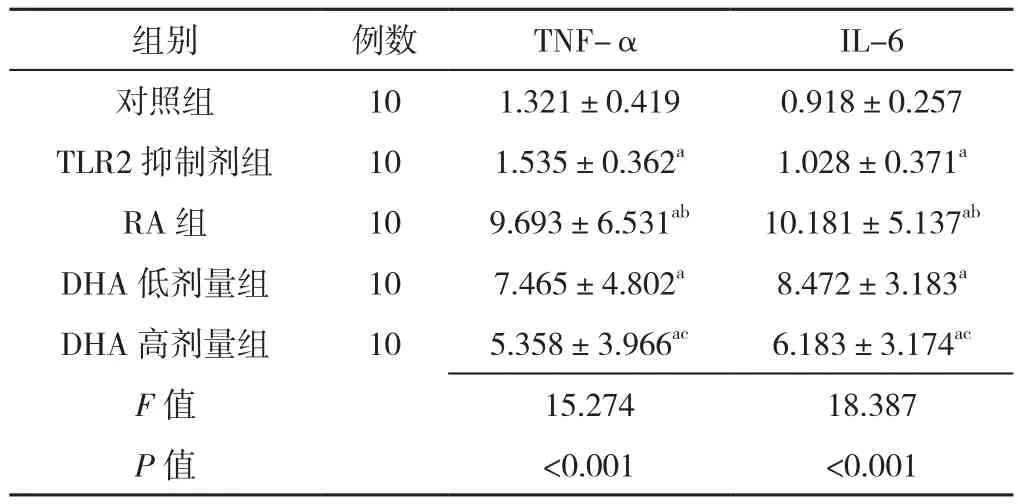
表5 五组TNF-α、IL-6水平比较( ±s,mmol/L)Table 5 Comparison of TNF-α and IL-6 levels in five groups
注:与对照组比较,aP<0.05;与TLR2抑制剂组比较,bP<0.05;与DHA低剂量组比较,cP<0.05
组别 例数 TNF-α IL-6对照组 10 1.321±0.419 0.918±0.257 TLR2抑制剂组 10 1.535±0.362a 1.028±0.371a RA组 10 9.693±6.531ab 10.181±5.137ab DHA低剂量组 10 7.465±4.802a 8.472±3.183a DHA高剂量组 10 5.358±3.966ac 6.183±3.174ac F值 15.274 18.387 P值 <0.001 <0.001
3 讨论
RA是以慢性破坏性多关节炎为主要表现的全身性自身免疫性疾病,基本病理变化是自身免疫异常引起的致炎细胞因子和炎性递质等的释放,由此所致的关节滑膜的慢性炎症、血管翳形成、软骨和软骨下骨破坏。研究证实TLR在 RA 的发病中具有关键作用。TLR作为膜结合蛋白,可识别病原体不同的分子结构后激活细胞内的信号转导通路,上调炎性细胞因子和趋化因子,加速炎性反应及炎症持续时间等[5]。在自身免疫性疾病中以TLR2及其介导的信号通路在RA的发病中具有重要作用,MyD88是TLR信号转导通路中的一个关键的接头蛋白,对 TLR2信号起负性调控作用[6-7]。诸多学者研究认为DHA及其衍生物对免疫系统有调节作用。目前,国内外关于DHA对RA可能作用机制的研究较少。本研究通过DHA干预RA患者TLR2/TLR4介导的信号通路,探讨DHA治疗RA的可能作用机制,为RA治疗提供可能的理论依据。
本研究结果显示,RA活动期各组TLR2阳性率高于对照组,RA组TLR2阳性率高于TLR2抑制剂组,提示在RA活动期TLR的表达是增强的,与钱雷等[8]研究表明RA患者关节滑膜衬里层和里衬层TLR2、TLR4蛋白表达水平较骨关节炎患者及健康人明显偏高的结果一致。其原因可能为RA患者病原体分子结构刺激PBMC处于活化状态,TLR受体激活,产生大量炎性因子,引起关节炎症的发生。本研究结果显示,TLR2抑制剂组PBMCs中TLR2、MyD88表达 、上清液中TNF-α及IL-6水平低于RA组,提示应用TLR2抑制剂后RA患者的TLR下降,炎性因子TNF-α及IL-6水平下降,关节炎性反应降低,病情趋于缓解。与国内外相关研究结果一致,抑制TLR2可以使模型小鼠关节炎的严重程度降低,骨破坏及炎性反应减少[9-10]。其原因可能为RA患者通过TLR启动机体的炎性反应,合成和释放炎性因子,抑制TLR2后炎性反应降低。本研究结果显示,DHA低剂量组PBMCs中TLR2、MyD88表达,上清液中TNF-α及IL-6水平高于DHA高剂量组,提示RA患者应用DHA后可以抑制TLR,而且随着DHA剂量的增大对TLR的抑制作用在增强,与相关研究结果类似,DHA及其衍生物可显著降低促炎细胞因子IL-6、TNF-α的表达[11-12]。其原因可能为DHA及其衍生物可能对免疫系统具有调节作用,通过抑制TLR2受体减轻炎性反应。
本研究通过体外培养RA患者PBMCs,观察和检测不同浓度DHA处理过的RA患者PBMCs增殖程度;通过抑制TLR2/MyD88后,检测PBMCs 中TLR2、MyD88、TNF-α和IL-6的表达水平,应用DHA作用RA患者PBMCs后,使受刺激后PBMCs增殖程度减低,细胞凋亡加快;随DHA浓度的改变细胞增殖程度和凋亡也在改变;不同药物浓度刺激后细胞TLR2、MyD88、TNF-α和IL-6的表达水平在下降,证明了DHA对TLR2、MyD88信号通路具有抑制作用。DHA制剂对RA患者PBMCs的抑制作用机制,为临床治疗RA提供更多的理论依据。
总之,RA的发病机制复杂,在RA的发病机制中除了TLR信号通路外,还有JAK-STAT 信号通路、Wnt/β-catenin信号通路、PI3K/AKT信号通路、PD-1/PD-L1信号通路、MAPK 信号传导通路和BMPs信号通路。本文研究只是对DHA对RA患者TLR2/MyD88信号通路的抑制作用做了初步探索,希望能对基础研究和临床治疗RA提供更多的理论依据。本研究也具有很大的局限性:信号通路之间的相互关系复杂,网络相互交错,在抑制TLRs通路时可能对其他信号通路产生不利影响。
作者贡献:闫慧明进行研究设计与实施、撰写论文并对文章负责;安燕、刘咏梅、秦洁莉、刘远、王武龙、岳建伟、赵洪进行研究实施、评估和资料收集;张雪进行质量控制及审校。
本文无利益冲突。
