分期介入治疗主动脉缩窄合并右锁骨下动脉瘤1例
2021-03-26刘丛勇刘雨强张露杨艳旗
刘丛勇,刘雨强,张露,杨艳旗
1 临床资料
患者女性,30 岁,因“体检发现降主动脉及右锁骨下动脉瘤9 年余”于2016-11-30 入院。患者2007 年体检行胸部CT 检查发现动脉瘤,当时无胸闷气促,无胸腹部疼痛,无头晕头痛等特殊不适。2007-03-13 初次就诊胸部CT 示:降主动脉假性动脉瘤,局部降主动脉受压变窄,双侧胸腔大量侧支循环形成,右侧锁骨下动脉起始部真性动脉瘤,当时予倍他乐克控制血压后未予其他特殊治疗。多次就诊不同医院,考虑大动脉炎诊断,予以糖皮质激素抑制自身免疫治疗。2016-08-08 复查主动脉CTA:右侧锁骨下动脉起始部类圆形扩张,约为44 mm×28 mm,右侧锁骨下动脉受压,局部管腔变窄。降主动脉上段见类圆形扩张,约为51 mm×36 mm,降主动脉近段及远段均变窄,较窄处直径约5 mm。
患者此次入院时仍无胸闷气促,无头晕头痛,无胸腹部疼痛等不适,自觉双下肢易麻木、乏力。入院时四肢血压为:左上肢血压150/90 mmHg,右上肢血压138/72 mmHg,左下肢血压95/59 mmHg,右下肢血压91/53 mmHg。胸部正侧位片示:右侧锁骨下动脉起始部投影区增宽,宽约25 mm;降主动脉起始部增宽,宽约42 mm,余未见异常,考虑右侧锁骨下动脉、降主动脉起始部动脉瘤。心电图示:窦性心律,逆钟向转位,心率78 次/分。心脏超声示:各房室腔内径正常范围,降主动脉峡部变窄(最窄处约7 mm),其后呈瘤样扩张(大小约47 mm×41 mm),各瓣膜形态、结构未见明显异常,考虑降主动脉峡部狭窄、降主动脉瘤形成。血液生化检验提示总胆红素、直接胆红素及间接胆红素轻度升高,余未见明显异常。“主动脉缩窄并右锁骨下动脉动脉瘤及降主动脉假性动脉瘤”诊断明确。因患者病情复杂,决定分期手术,2016-12-6 患者先行“主动脉缩窄扩张、覆膜支架植入及降主动脉假性动脉瘤腔内隔绝术”处理主动脉缩窄及降主动脉瘤,应用定制Armada 35 球囊扩张导管,局麻下于左股动脉穿刺置入导丝及球囊支架血管,术中见主动脉缩窄处直径约2 mm,假性动脉瘤位于缩窄处。
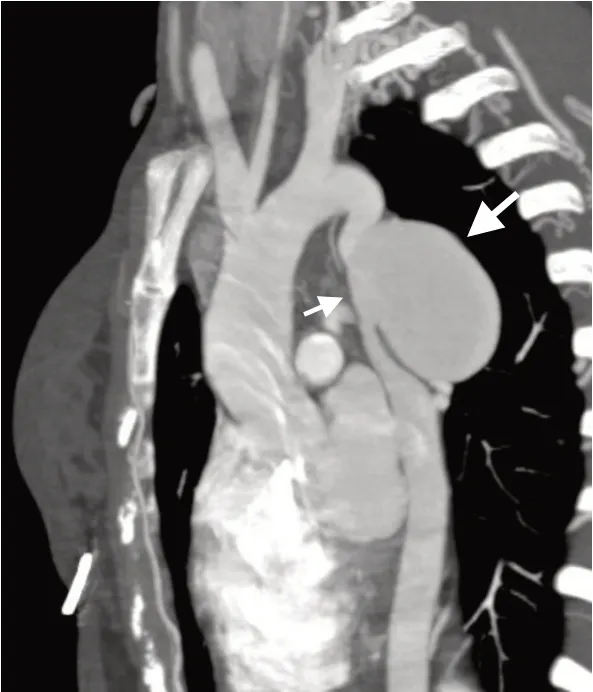
图1 2016-8-8 胸部CT 示降主动脉缩窄及降主动脉瘤(箭头示)
定位准确后充盈气囊,扩张主动脉缩窄,将缩窄处扩张至10 mm,同时释放覆膜血管支架,置入球囊,再将支架血管扩张至12 mm(图3),降主动脉缩窄处的假性动脉瘤消失。术后安返病房,出院前监测四肢血压示:左上肢血123/74 mmHg,右上肢血压110/68 mmHg,左下肢血压102/68 mmHg,右下肢血压116/80 mmHg。术后1 个月回访患者,无诉头晕头痛,下肢乏力等不适,四肢血压:左上肢血压126/77 mmHg,右上肢血压106/73 mmHg,左下肢血压110/72 mmHg,右下肢血压105/73 mmHg。术后3 个月复查胸部CT(图6 示),主动脉缩窄未见复发,覆膜支架固定良好,患者无诉胸闷胸痛,下肢乏力等不适。
2017-03-28 患者行“右锁骨下动脉覆膜支架植入术”处理右锁骨下动脉狭窄并动脉瘤,局麻下于右股动脉穿刺置入导丝及造影导管至升主动脉远端,拔除导丝,植入导丝捕捉器至升主动脉远端。另从右侧肱动脉穿刺置入导丝及造影导管至右锁骨下动脉狭窄处,经升主动脉远端的导丝捕捉器固定导丝后,经股动脉穿刺口拉出导丝。从股动脉鞘管送入一枚自膨胀支架至右锁骨下动脉瘤处,退出导管,释放支架。复查造影显示动脉瘤入口封闭,右锁骨下动脉扩张良好。对患者随访观察2 年后,2019-3-21 胸部CTA 示(见图8):两处支架对比剂未见明确外漏征象,术后2 年来未出现头晕头痛,下肢乏力等不适,血压稳定。
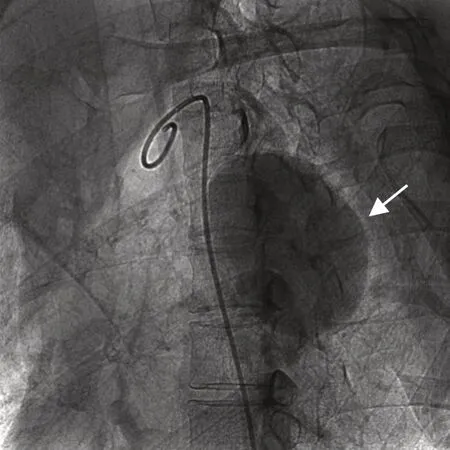
图2 术中主动脉造影示假性动脉瘤(箭头示)

图3 术中所见Amada 35 扩张球囊(箭头示)
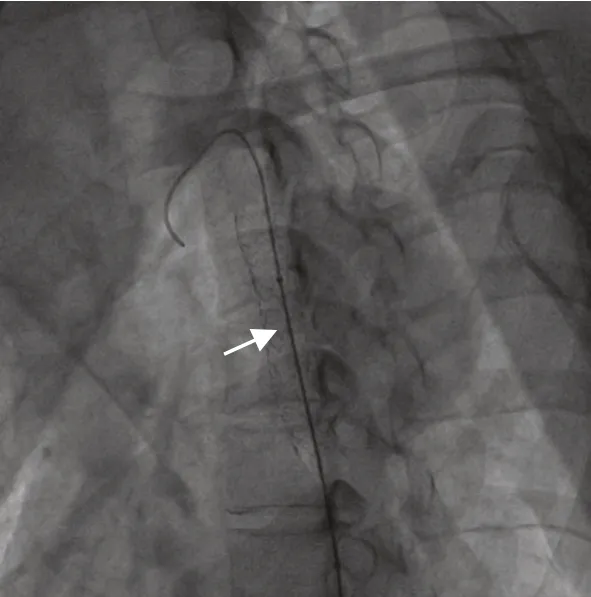
图4 术中所见定制血管支架(箭头示)
2 讨 论
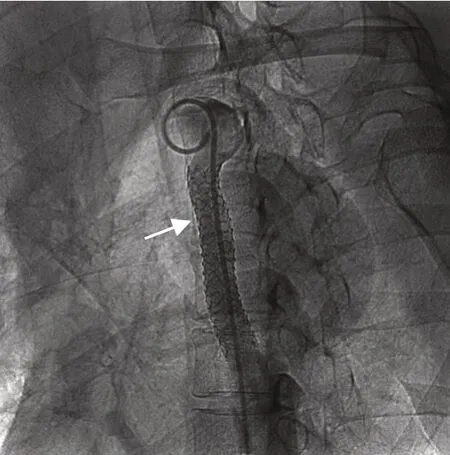
图5 术后造影示定制Armada 35 球囊扩张导管及覆膜支架(箭头示)
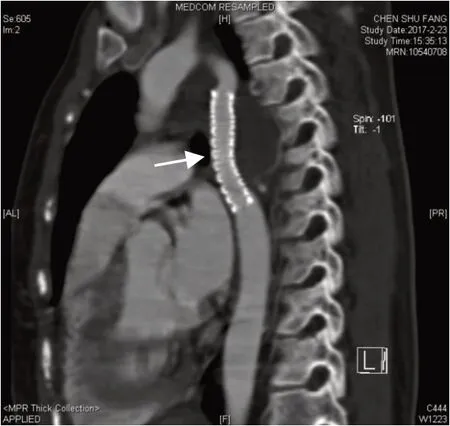
图6 术后3 月复查胸部CT 示球囊扩张导管及支架(箭头示)
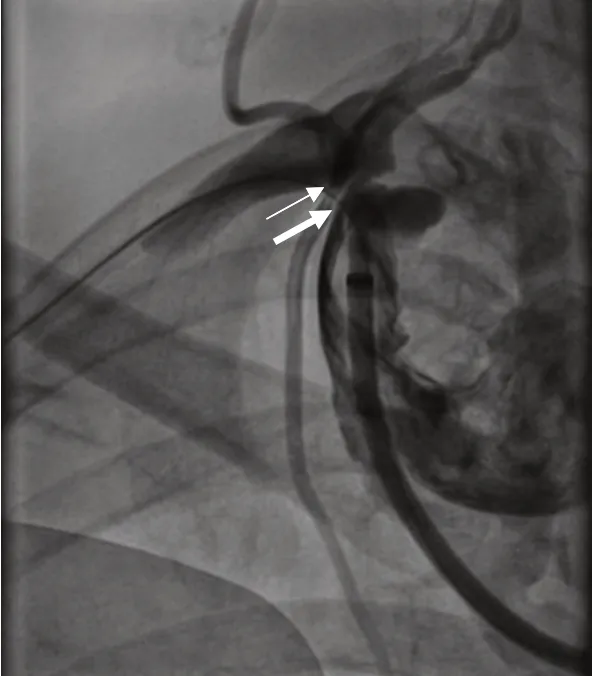
图7 术中所见右锁骨下动脉狭窄(细箭头示)及动脉瘤(粗箭头示)
主动脉缩窄在所有先天性心脏病中占5%~7%,发生率约为 4/10 000[1,2],而其中男性病人的发病率大概是女性的1.5 倍[3],狭窄可发生于胸腹动脉的任何部位,超过95%的患者狭窄发生在左锁骨下动脉远端,即弓降部动脉导管或动脉韧带附着处附近[4]。研究表明,未接受手术的患者平均生存年龄只有34 岁,而75%的患者在46 岁前死亡,系统性高血压、冠心病、脑卒中、主动脉夹层等是主动脉缩窄患者的常见并发症[5-7],而17%的患者会合并单发或者多发的动脉瘤。合并动脉瘤者更可发生瘤体破裂等风险,因此,对于主动脉缩窄合并动脉瘤要争取做到早期诊断,及早采取合理的治疗手段,目前CoA 的常用治疗方法包括外科手术,球囊扩张及支架植入。
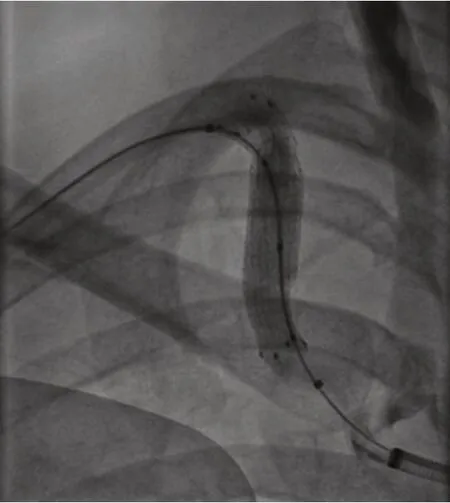
图8 术后造影所见自膨胀支架及动脉瘤闭锁
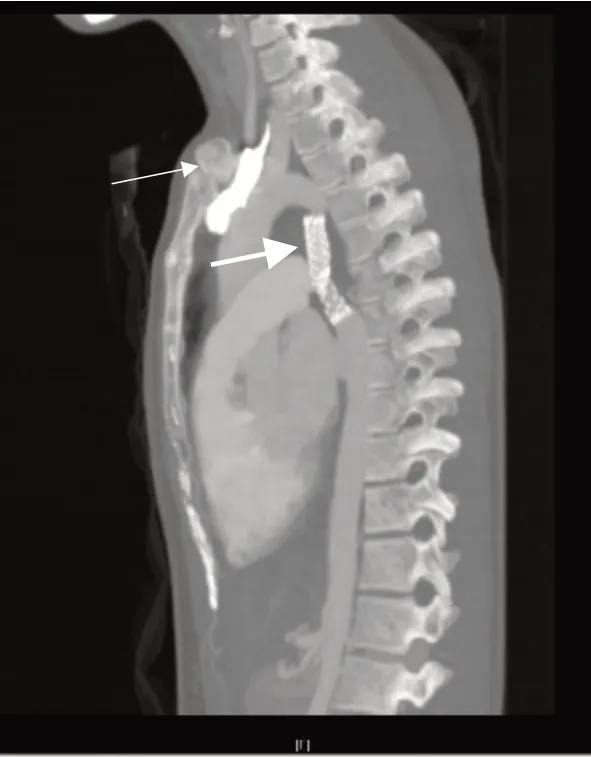
图9 术后2 年复查胸部CTA 示球囊扩张导管(粗箭头示)与自膨胀支架(细箭头示)
自1944 年Crafoord 完成首例主动脉狭窄的端端吻合术以来[8],后续又出现多种外科手术方式,包括原位端端吻合、补片成形术、人工血管转流术、锁骨下动脉垂片成形术等,但是外科手术更倾向用于婴幼儿以及出生体重小于2.5 kg 的早产儿,因为在成年主动脉缩窄患者中,外科手术的并发症比幼儿更常见,如恢复时间长、膈神经及喉返神经损伤、脊髓缺血损伤、截瘫等[9,10]。
球囊扩张术作为一种安全有效的治疗手段,主要运用于没有合并主动脉弓发育不全的1~6 个月的婴幼儿、术后缩窄复发或者有明确的外科手术禁忌症的新生儿的姑息治疗[11,12],同时,有研究表明,对于因心室功能障碍、二尖瓣返流、低心排量等引起的心力衰竭患者出现主动脉缩窄时,不管患者处于何年龄段,亦可考虑应用球囊扩张治疗[10]。球囊扩张术可有效降低主动脉缩窄近远端峰压差,但远期动脉瘤形成(发生率约9%)及再缩窄的发生率明显比外科手术要高,有研究表明,需要再次手术干预的发生率高达 50%[13,14],这也是限制球囊扩张术应用的重要原因。
1991 年首次开始用支架置入来治疗主动脉缩窄[8],血管内支架虽然通过球囊导管置入体内,但是不需要血管壁的过度扩张,同时可以为血管提供结构支撑,因此相对于球囊扩张而言,其动脉壁损伤及术后再狭窄的发生率明显更低[15],而COASTⅠ和Ⅱ的试验都证明了覆膜支架的安全性和有效性[16,17]。美国心脏病学会及心脏学会(ACC/AHA)在2018 年的指南中推荐成人CoA 满足下述条件时可采用介入治疗:①缩窄近远端动脉峰压差≥20 mmHg,或≤20 mmHg 但有明显缩窄或侧支血流的影像学证据;②再发或者不连续的缩窄且动脉压差≥20 mmHg[17],对于年龄较小的CoA 患者,支架置入后,随着主动脉的发育,直径变大,势必需要再介入治疗,这也是支架置入术常见的并发症,因此血管内支架置入一般用于发育完全的青少年及成年CoA 患者。
因CoA 的外科治疗手术切口大,风险相对较高,且更容易产生并发症,本例患者一期采用特殊定制的Armada 35 球囊扩张导管及覆膜支架进行治疗,有效扩张缩窄处主动脉,消除降主动脉假性动脉瘤,同时降低了手术风险,减少了术后并发症的发生,二期介入治疗右锁骨下动脉瘤,这种分期治疗主动脉缩窄的情况国内外有类似文献报导[18-20],但国内尚未见主动脉缩窄合并右侧锁骨下动脉瘤的报道。临床上对于主动脉缩窄合并多发动脉瘤的患者,应根据患者的病情,年龄等综合情况,合理选择治疗方式,若患者病情复杂,可视情况采取本例中分期介入治疗的手段。
