阿司匹林衍生物药理活性研究概述
2021-03-26吴定浩邢志华李兴杨王琪琪包然程美池张凤阳
吴定浩,邢志华,李兴杨,王琪琪,包然,程美池,张凤阳
(哈尔滨商业大学药学院,中央与地方共建高等学校药学重点实验室,黑龙江省预防与治疗老年病药物研究重点实验室,国家教育部抗肿瘤天然药物研究工程中心,黑龙江 哈尔滨 150076)
阿司匹林(aspirin,Asp)自1898年作为解热镇痛抗炎药上市以来,距今已有100多年的应用历史(结构式见图1)。现代医学研究发现阿司匹林还具有抗血小板聚集、预防结肠癌、防治糖尿病及其并发症、防治老年痴呆、预防老年性白内障、防治中风及心肌梗死等多种药理活性[1],是老药新用的典型药物之一。阿司匹林药理作用广泛,但其副作用也不容忽视,其副作用主要有胃肠道反应、过敏反应、水杨酸反应、瑞士综合征、肝损害等,长期服用会对胃肠道、肝、肾和中枢神经系统造成损害,也会增加心律不齐的风险[2]。为此,人们对其进行结构修饰或改造,以期寻找效果更好、不良反应更小的阿司匹林衍生物药物。本文主要对阿司匹林衍生物及其药理活性两大方面进行综述。
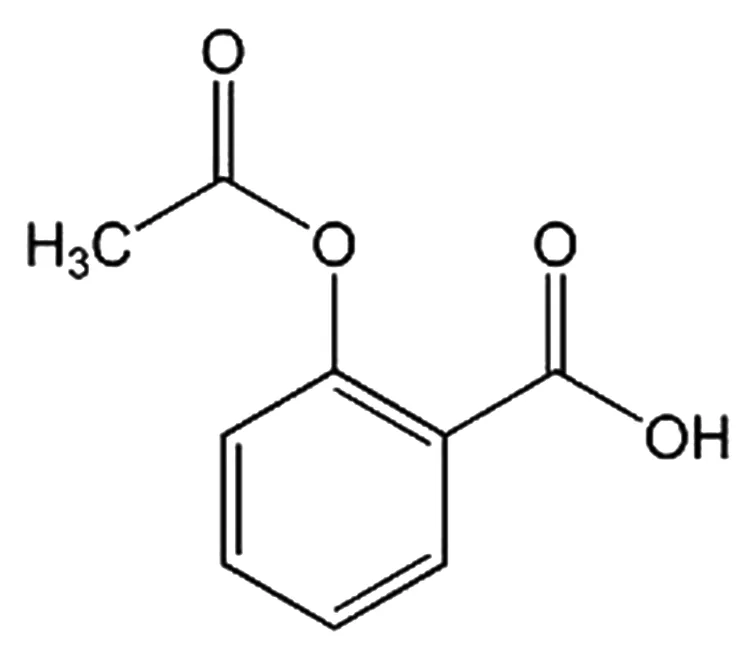
图1 阿司匹林的化学结构式
1 阿司匹林-无机衍生物
1.1 阿司匹林-一氧化氮与抗炎、抗肿瘤 一氧化氮(NO)是一种内源性的具有调节细胞多功能的信息分子,在舒张血管、降低动脉血压、抗血栓、参与心脏正常生理功能的调节、介导胃肠黏膜的自我保护、保持气道舒张和维持正常通气等方面发挥着重要的生物学作用。研究人员将含有NO供体的化合物与阿司匹林反应生成阿司匹林-一氧化氮衍生物(NO-Asp)(结构式见图2)。较之Asp,NO-Asp对胃肠道的刺激作用更小,抗炎活性增强,同时可以抑制SW480结肠癌细胞和RM-1前列腺癌细胞的生长[2]。
Gao等[3]研究显示,NO-Asp通过阻止G2/M细胞周期来抑制SW480、HT-29、HCT-15、LoVo人结肠腺癌细胞,HeLa人宫颈腺癌细胞、MCF-7人乳腺腺癌细胞、BxPC-3人胰腺癌-noma细胞和A431人皮肤癌细胞的生长;Rao等[4]对p48-LSL-Krastransgenic雄性小鼠胰腺癌研究显示,NO-Asp可抑制胰腺上皮内瘤(pancreatic intraepithelial neoplasia,PanIN)的生长,阻止胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的扩散。NO-Asp比Asp抑制胰腺癌更安全,有效。
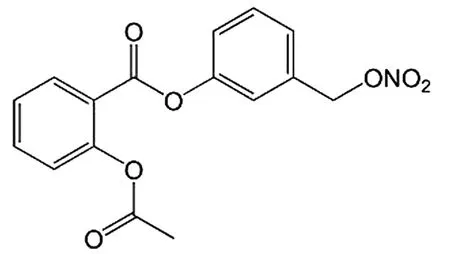
图2 NO-Asp的化学结构式
1.2 阿司匹林-硫化氢与抗白血病、抗高血压、降低血管内皮功能障碍 硫化氢(H2S)是近年来发现的一种内源性气体分子,具有扩张血管、抑制平滑肌增殖、传递神经信号等功能。Chattopadhyay等[5]将阿司匹林与H2S合成阿司匹林-硫化氢(HS-Asp)衍生物(结构式见图3)。HS-Asp对 β-连环蛋白(β-catenin)有下调作用,抑制白血病Jurkat T-leukemia细胞的生长,其抑制作用比阿司匹林更强。
HS-Asp对谷胱甘肽合酶抑制剂(buthionine sulfoximine,BSO)引起的胃黏膜损伤比Asp有明显的保护作用,可降低BSO引起的高血压和主动脉组织血管内皮功能障碍,对BSO诱导的心血管疾病有保护作用[6]。

图3 HS-Asp的化学结构式
1.3 阿司匹林-重氮烯吡啶与抗胃溃疡、抗炎 Basudhar等[7]将重氮烯吡啶与阿司匹林反应生成O2-(乙酰水杨酸酰氧基甲基)-1-(N-异丙基氨基)-重氮烯-1-1,2二盐(IPA/NO-Asp)和O2-(乙酰水杨酸酰氧基甲基)-1-(N,N-二乙氨基)-重氮烯-1-1,2二盐(DEA/NO-Asp)(合成路线见图4)。IPA/NO-Asp,DEA/NO-Asp抗胃溃疡均强于阿司匹林;对大鼠足部水肿的研究显示,IPA/NO-Asp的抗炎活性强于Asp;IPA/NO-Asp与小鼠肌细胞融合时,显著缩短了肌小节,增强了心室肌细胞功能。

图4 IPA/NO-Asp、DEA/NO-Asp的合成路线
1.4 阿司匹林-磷酸复合物与抗乳腺癌 阿司匹林-磷酸复合物(phospho-aspirin-2,PA-2)(结构式见图5)可抑制乳腺管癌细胞(T-47D)和MCF-7细胞的生长,抑制作用较Asp强。PA-2还可抑制雌激素受体阳性(ER+)乳腺癌的生长[8]。
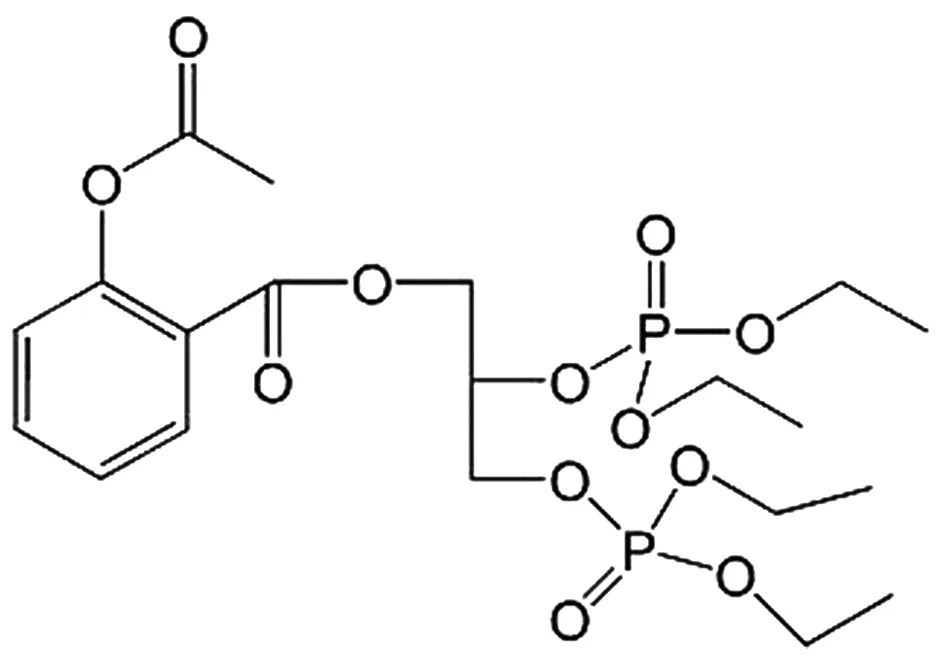
图5 PA-2的化学结构式
2 阿司匹林-脂类衍生物与抗血小板聚集
2.1 阿司匹林-酸酐与抗血栓 Roy等[9]将阿司匹林与亚硫酰氯(SOCl2)和脂肪酸反应,得到3种阿司匹林酸酐:LA anhydride(C1)、EPA anhydride(C2)和 DHA anhydride(C3)(合成路线见图6)。3种化合物通过抑制环氧化酶-血栓素合酶(cyclooxygenase-thromboxane synthase COX-TXAS)途径起到抗血小板聚集作用,其中C3抗血小板聚集效果最好,有望开发成新型抗血栓药物。
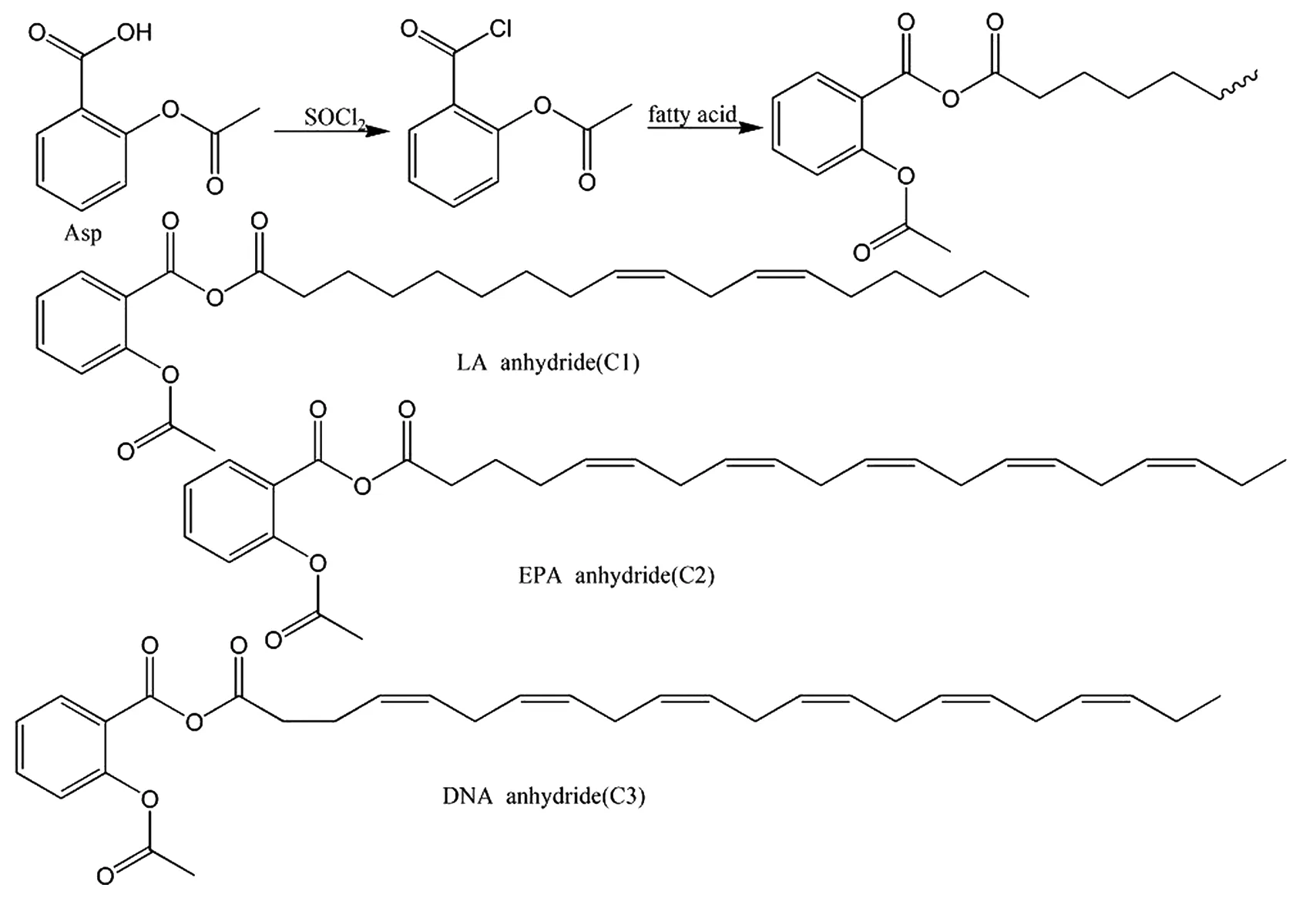
图6 LA anhydride(C1)、EPA anhydride(C2)和 DHA anhydride(C3)的合成路线
2.2 阿司匹林-磷脂复合物与抗血栓 阿司匹林与磷脂复合物(主要成分为磷脂酰胆碱)反应生成阿司匹林-磷脂复合物(Asp-PC)[10]。该磷脂复合物能有效改善阿司匹林对胃肠道的刺激性[11]。临床研究显示,阿司匹林-磷脂酰胆碱复合物的抗血小板活性与阿司匹林等效,但对胃十二指肠溃疡的风险比Asp低[12]。
3 阿司匹林-氨基酸衍生物
3.1 精氨酸-阿司匹林与抗炎 精氨酸-阿司匹林,具有抗氧化作用,通过降低体内血清肿瘤坏死因子(tumor necrosis factor,TNF-ɑ )及白细胞介素-10(interleukin-10,IL-10)水平,减轻炎症反应,从而减轻了肝、肾和肺的损伤程度[13]。对百草枯(paraquat,PQ)中毒有很好的治疗作用。
3.2 赖氨酸-阿司匹林与保护PQ中毒肺损伤 赖氨酸-阿司匹林(lysine acetylsalicylate,LAS)通过免疫保护作用,抑制脂质过氧化反应和肺组织细胞的凋亡,降低了急性PQ中毒大鼠肺损伤[14]。
4 阿司匹林-金属衍生物
Asp可与某些金属离子配位,在增强或拓展Asp自身药理作用的情况下,还可使金属离子的毒性和Asp的副作用明显降低。
4.1 阿司匹林-锌与抗炎、预防心肌损伤 研究表明,阿司匹林-锌[Zn(Asp)2]具有比Asp更好的抗炎活性和更低的致溃疡副作用[15]。研究人员对其预防糖尿病性心肌病进行研究,发现Zn(Asp)2在降低糖尿病大鼠的血浆葡萄糖浓度的同时,还可通过激活心肌蛋白激酶B(protein kinase B,AKT)信号通路来减轻2型糖尿病对大鼠心肌组织的损伤[16]。而在预防缺血心肌功能障碍研究中发现,Zn(Asp)2在预防急性心肌缺血后的电、机械和组织学变化方面优于Asp,其中抗氧化酶的诱导和抗炎细胞因子(transforming growth factor,TGF-β1)可能起着关键作用[15]。
4.2 阿司匹林-烟酰胺-锌与抗胃癌 蒲其松等[17]将阿司匹林-锌与维生素烟酰胺反应,合成了阿司匹林-烟酰胺-锌络合物(Wuyisa,WUY)(合成路线见图7)。所得络合物WUY的水溶性比Asp强约20倍,镇痛抗炎作用比Asp强5倍以上[18],抗实验性血栓形成和抗血小板聚集活性均比Asp强[19]。在小鼠体内抗肿瘤研究中发现,WUY能抑制H22移植瘤的生长,并改善小鼠的胃肠道反应[20]。在研究其对人胃癌细胞SGC-7901的生长抑制作用时发现,WUY对SGC-7901的抑制作用有一定的浓度依赖性[21]。
4.3 阿司匹林-铜、阿司匹林-钙与抗炎、抗血栓 研究人员将水杨酸、醋酸酐和醋酸铜反应生成了阿司匹林-铜配合物,该配合物对MCF-7和胃癌MGC-803细胞有较强的抑制作用[22]。较之Asp,该配合物在抗炎、抗血小板聚集和抗血栓方面活性更好[23]。
Zhen等[24]以纳米羟基磷灰石对Asp进行修饰后得到阿司匹林-钙(Ca-Asp)化合物(结构式见图8)。该化合物具有与Asp相似的抗血栓活性,且引起胃黏膜损伤的副作用较小,其作用机制与Ca-Asp抑制COX-2而非COX-1,进而刺激前列腺素(prostaglandin,PG)E2的合成有关。
4.4 阿司匹林-铂与抗肿瘤 顺铂(cisplatin)作为第一代铂类药物,是治疗睾丸癌、卵巢癌、膀胱癌、宫颈癌、头颈癌、小细胞及非小细胞肺癌的首选药物之一。但是由于其缺乏肿瘤组织选择性,致使其毒副作用较大。研究人员以顺铂、H2O2和乙酰水杨酸酐合成了阿司匹林-铂(asplatin)化合物(结构式见图9)。MTT实验评价asplatin在多种(包括HeLa细胞、MCF-7细胞、肝癌HepG2细胞、肺癌A549和A549顺铂耐药细胞系A549R)人源肿瘤细胞系中的细胞毒性时,发现Asplatin较顺铂有更显著的细胞毒性,抑制肿瘤细胞生长,从而体现出更好的抗肿瘤性能[25]。

图8 Ca-Asp 的化学结构式

图9 阿司匹林铂的化学结构式
4.5 阿司匹林-钐与镇痛 稀土金属具有特殊的电子结构、成键特征和高配位数,与某些药物配位后在治疗烧伤、抗凝血、抑菌消炎、抗动脉硬化和保护胃黏膜作用等方面具有特殊疗效。研究人员以Asp为原料和稀土金属钐(Sm)配位得到阿司匹林-钐配合物[Sm(Asp)3(H2O)3]。在小鼠醋酸扭体实验中发现,其镇痛效果优于Asp,与罂粟碱接近。研究还发现Sm(Asp)3(H2O)3通过抑制下丘脑PG的合成和释放来发挥外周镇痛作用。由于络合中心的Sm与细胞磷脂有较强的亲和力,与溶酶体膜结合后稳定了溶酶体膜及细胞膜,抑制溶酶体释放PG、激肽类致痛因子,体现出中枢镇痛活性[26]。
4.6 阿司匹林-六羰基二钴与抗恶性胸膜间皮瘤 Zanellato等[27]对阿司匹林-六羰基二钴衍生物(Co-ASS)(结构式见图10)进行了恶性胸膜间皮瘤细胞株的抗增殖活性研究,发现Co-ASS的抗癌增殖效果比顺铂好。而且Co-ASS能显著降低细胞内的活性氧/氮(ROS/RNS)水平,降低亚硝酸盐含量,减少亚硝酸盐致癌风险。
4.7 阿司匹林-Zeise盐与抗结肠癌、抗乳腺癌 Weninger等[28]将Asp和4种相应不同烷基链长的1-羟基烯基烷酯化后,与Zeise盐(含Pt配位)合成Asp亚结构的Zeise盐衍生物1a、2a、3a、4a (合成路线见图11)。发现较长烷基链结构的阿司匹林-Zeise盐对COX有较强的抑制作用。较之Asp和Zeise盐本身,4种衍生物是更有效的COX酶抑制剂,对结肠癌HT-29细胞和乳腺癌MCF-7细胞产生抗增殖作用。
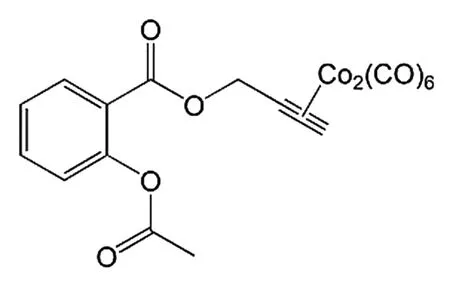
图10 Co-ASS的化学结构式
5 阿司匹林-萜类衍生物
5.1 阿司匹林-齐墩果酸与抗骨质疏松、镇痛、抗炎 齐墩果酸(oleanolic acid,OA)具有抑制肠源血清素(5-羟色胺,5-HT)活性。吉璐宏等[29]将Asp与OA骈合成5种阿司匹林-齐墩果酸(OA-Asp)(结构式见图12)。研究发现OA-Asp能明显地降低小鼠血清、小肠中血清素和细胞中色氨酸羟化酶-1(tryptophan hydroxylase 1,TPH-1)的含量,抑制效果均强于Asp、OA及 OA和Asp联合用药,有较优良的促进成骨细胞增殖效果,其中化合物3效果最佳,有望开发成抗骨质疏松的新药。
Barbara等[30]通过3-羟基亚胺-17-N-甲酰吗啉齐墩果酸和阿司匹林在二恶烷中缩合生成OAO-Asp(合成路线见图13),研究发现,OAO-Asp具有良好的镇痛和抗炎活性,与Asp联合用药效果更佳,其作用机制需要进一步研究。
5.2 阿司匹林-熊果酸酯与抗乳腺癌 熊果酸(ursolic acid,UA)有良好的抗肿瘤生长和扩散以及抵制致癌物质突变作用。汤乔[31]以邻乙酰水杨酰氯和UA缩合成UA-Asp(合成路线见图14)。研究发现,与UA和Asp相比,UA-Asp在抑制MCF-7、4T1乳腺癌细胞与细胞外基质之间的黏附、迁移运动及侵袭穿膜的效果更显著,其分子机制是通过抑制肿瘤细胞侵袭关键蛋白酶MMP-2/MMP-9及相关酶COX-2的表达、调控参与乳腺癌细胞黏附转移中α6β1整合素信号通路及上下游CD44、EGFR、ERK和PTEN等信号传导蛋白的表达、调节上皮间质转换(epithelial-mesenchymal transition,EMT)信号通路中E-cadherin、β-catenin等蛋白的表达从而抑制乳腺癌的转移。

图11 阿司匹林Zeise盐的合成路线

图12 5种阿司匹林-齐墩果酸的化学结构式

图13 OAO-Asp的合成路线

图14 阿司匹林-熊果酸的合成路线
6 阿司匹林-丁香酚酯
丁香酚是丁香油的主要成分,具有抗凝血、镇痛、抗炎、杀菌、抗氧化、止泻以及抗血小板聚集等药理作用,但其结构中的酚羟基使其具有刺激性且容易被氧化。为了改善阿司匹林的不良反应和增强丁香酚的稳定性,研究人员将Asp与SOCl2反应生成酰氯化合物,再与丁香酚酯化合成阿司匹林-丁香酚酯(aspirin eugenol ester,AEE)[32],合成路线见图15。
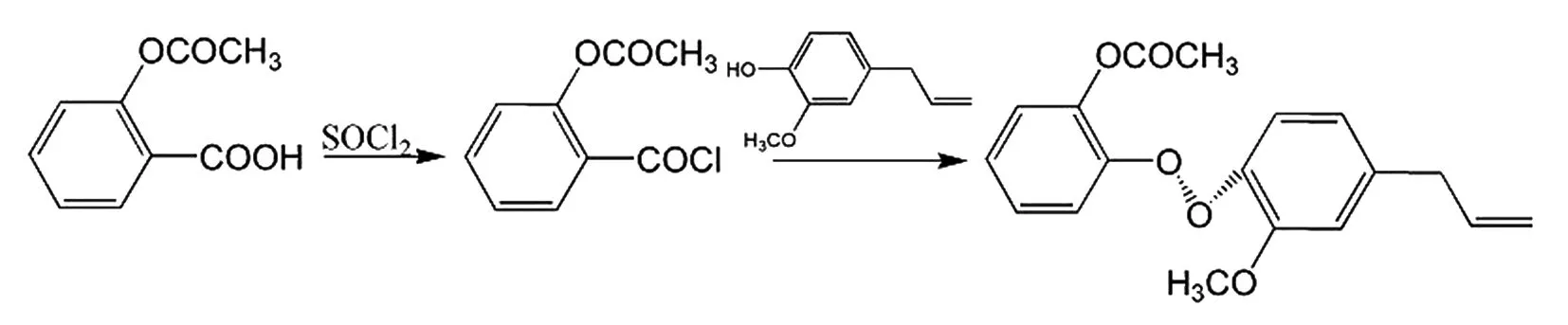
图15 阿司匹林-丁香酚酯的合成路线
6.1 AEE与解热镇痛抗炎 所得的化合物AEE的解热作用速效持久,明显优于Asp与丁香酚,其作用机制可能是与降低下丘脑中环磷酸腺苷的含量和腹中隔区、血浆中精氨加压素含量有关[33]。AEE的镇痛作用有效持久,且优于Asp与丁香酚,可能与降低小鼠全脑中的前列腺素E2(prostaglandin E2,PGE2)含量有关[34]。
在抗炎方面,AEE能有效减少PGE2、5-HT及NO含量,但对丙二醛(malondialdehyde,MDA)含量无影响[35]。Ma等[36]研究发现,AEE对大鼠体内的COX-1、COX-2、C反应蛋白(C-reactive protein,CRP)、凝血酶原(prothrombin,FII)、5-脂氧合酶(5-lipoxygenase,ALOX5)5种蛋白质的作用强于Asp和丁香酚。从化学-蛋白相互作用的角度看,AEE具有抗炎、抗血栓形成的积极作用,且作用强于阿司匹林和丁香酚。
6.2 AEE与抗血小板聚集、抗血栓 AEE具有抗血小板聚集作用,作用优于Asp和丁香酚。研究表明,AEE通过降低血小板胞内钙离子浓度和血小板内容物三磷酸腺苷(adenosine triphosphate,ATP)ATP的释放量,以及抑制MAPK通路中ERK2磷酸化,从而抑制二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板聚集。相比于Asp和丁香酚,AEE增加了一条新的作用途径,即降低血小板ATP释放量[37]。
AEE具有抗血栓形成作用,能增强血栓形成引起的肺栓塞小鼠的保护作用,以及显著抑制κ-角叉菜聚糖(kappa-Carrageenan)诱导的大鼠尾部血栓的形成,其效果强于Asp、丁香酚以及联合用药。其可能是通过修复能量代谢(TCA循环、柠檬酸代谢等)损伤,显著减少补体和凝血级联反应中相关肝脏蛋白的合成,抑制血小板激活以及调节 HIF-1、MAPK等信号通路从而抑制血栓形成[38-40]。
AEE具有抗血瘀作用,其作用机制可能主要与调节氨基酸、脂肪酸、能量和甘油磷脂的代谢有关[41]。
6.3 AEE与抗动脉粥样硬化 AEE具有抗动脉粥样硬化(atherosclerosis,AS)活性,可显著降低高脂肪饮食AS金黄地鼠的动脉粥样硬化指数,从而显著改善肝组织和主动脉弓的病理变化,对肝脏、血浆、尿液和粪便中的代谢差异物(包括氨基酸、谷胱甘肽、DHA、壬二酸、泛酸、辅酶A、核黄素和甘油磷脂等)具有很好的调节作用[40]。AEE抗AS作用的机制可能与改善调节代谢物的代谢、抑制氧化应激和减少黏附分子水平而介导血管内皮功能障碍的减少有关[42]。
6.4 AEE与防治高脂血症 AEE能够有效地预防高血脂,并且其作用强于辛伐他汀、Asp和丁香酚,而且能改善大鼠高脂肪饮食对盲肠微生物群的负面影响。研究发现AEE能显著增加高密度脂蛋白(HDL)水平,降低甘油三酯(TG)、总胆固醇(TCH)和低密度脂蛋白(LDL)水平,其治疗高脂血症作用机制可能与对脂质代谢、能量代谢及氨基酸代谢的调节作用有关[43-45]。
6.5 AEE与抗血管内皮细胞氧化损伤 AEE具有抗人脐静脉内皮细胞氧化损伤的活性,可能与其增强血管内皮细胞 Nrf2和 Bcl2的表达,提升内皮抗氧化能力、减少内皮细胞活性氧/活性氮(ROS/RNS)的积累、降低血管内皮细胞黏附分子的表达有关[46-47]。
7 结语与展望
本文主要介绍了30种阿司匹林衍生物,并总结了主要衍生物的合成路线、结构及药理活性。从药理活性报道中发现,阿司匹林衍生物主要集中在解热镇痛、抗炎、抗骨质疏松、防治心脑血管疾病及抗肿瘤活性等方面。其中阿司匹林-丁香酚酯在防治心脑血管疾病方面具有很好的开发前景。另外,阿司匹林-钐配合物具有很好的中枢镇痛作用,这对于开发非成瘾性的非阿片类的中枢镇痛药提供了一条新思路。
