1例输入性HIV-1 G亚型毒株的检出及基因组序列分析
2021-03-25罗周正马玉霞刘文新田晓东
杜 波,李 贺,罗周正,马玉霞,刘文新,赵 地,吴 莹,郭 勇,田晓东
HIV-1为反转录病毒属正链RNA病毒,由于病毒复制过程缺少校对功能,具有高度变异性。HIV-1除少数为N组和O组外,大部分属于M组,而M组又可分为9个亚型和102个重组亚型[1-2]。随着基因测序技术的进步,越来越多的HIV基因组得到测序,这为分析HIV亚型、流行趋势、分子溯源提供基础数据,也对制定有效的艾滋病防治措施提供科学依据[3-5]。HIV-1亚型中,G亚型主要分布于西非和欧洲,其感染者只占全球感染者的4.6%;但G亚型出现时间较长,随着病毒的变异和重组,G亚型与HIV-1其他亚型重组产生的重组亚型广泛流行。例如,重组亚型CRF02_AG就是由HIV-1 A亚型和G亚型重组而成,CRF02_AG重组亚型感染者占全球感染者的7.7%[6]。
阜新地区流行的HIV-1毒株亚型呈现复杂趋势。2009年以前,主要以B亚型感染为主;2009年以后,以CRF01_AE亚型感染居多,亚型种类包括B亚型、CRF07_BC亚型和CRF65_cpx亚型,但之前本地区未发现过G亚型。在2019年的艾滋病监测中,首次监测到本地区有1例输入性HIV-1 G亚型感染者,本文对其体内的HIV-1基因组进行序列测定和进化分析,为本病例病毒溯源提供依据,也为本地区HIV-1流行趋势提供预测。现报道如下。
1 对象与方法
1.1 对象 本病例来自阜新市卫生健康服务中心(阜新市疾病预防控制中心)艾滋病监测人群,为艾滋病WHO临床分期I期的尼日利亚来华人员,血清样本编号FX2019042,经ELISA、胶体金筛查和免疫印迹确证试验确认为HIV-1抗体阳性。在确保患者知情同意的前提下,采集患者血清2 ml,冻存于-70 ℃冰箱备用。
1.2 HIV-1 RNA提取 采用RNA病毒提取试剂盒QIAamp Viral RNA Mini Kit(QIAGEN公司,货号52904)提取血清样品中的HIV-1 RNA,具体操作严格按照说明书进行。提取的RNA冻存于-70 ℃冰箱备用。
1.3 HIV-1 RT-PCR扩增 由于样本珍贵,先将病毒RNA反转录为cDNA,再以cDNA为模板,进行两轮PCR,最后进行测序。反转录反应按照试剂盒说明书进行。反应过程简述如下。RT-PCR反应体系总体积50 μl,体系成分包括:1 μl反转录酶(0.5 U/μl)、25 μl 2× 缓冲溶液,10 μl模板RNA,5 μl随机引物及 2 μl dNTP,用水补足至50 μl。反转录反应条件为 50 ℃温育50 min,85 ℃5 min终止反应。用2×Taq PCR Master Mix试剂盒(日本TaKaRa公司)进行第一轮PCR扩增,其PCR产物为近似全长基因组,上游引物为UFA,下游引物为URB。PCR反应体系总体积50 μl,体系成分包括:25 μl 2×Taq PCR Master Mix混合液、2 μl cDNA 模板、2 μl上下游引物(10 μmol/L),用水补足至 50 μl。PCR反应条件如下:95 ℃ 10 min;95 ℃ 60 s,55 ℃ 60 s,70 ℃ 10 min,进行 40 个循环;终延伸72 ℃ 10 min。用2×Taq PCR Master Mix试剂盒(日本TaKaRa公司)进行第二轮巢式PCR扩增,反应体系和条件同第一轮PCR反应。所有引物序列见表1。

表1 RT-PCR 引物序列表Table 1 Sequence of RT-PCR primers
1.4 PCR产物的纯化和测序 PCR产物进行1%琼脂糖凝胶电泳,对目的条带切胶回收,使用QIAGEN公司(德国)QIAquick Gel Extraction Kit对切胶产物进行纯化,纯化后的产物委托Invitrigen公司进行DNA测序。
1.5 序列分析 用Chromas软件查看测序序列峰图,序列编辑使用Sequencher 4.0软件,最后用BioEdit 6.1软件对序列进行拼接,基因位置的绘图和分析采用HIV Sequence Locator软件。从HIV Database (https://www.hiv.lanl.gov)下载HIV-1各亚型参考毒株基因组序列,使用MEGA 6.0软件构建Neighbor-Joining系统进化树,计算参数设定为Bootstrap值500次。在GenBank中下载所有G亚型基因组序列,利用NCBI BLAST在线比对G亚型各基因与本研究毒株各基因相似度。对获得的基因组序列,使用RIP 3.0软件进行基因重组分析,并将序列中env基因C2V3区序列应用Gene Cutter软件搜索并翻译为氨基酸序列。所得到的氨基酸序列使用Geno2pheno软件进行辅助受体预测,辅助受体判定标准:假阳性率<5%判定为病毒使用趋化性细胞因子受体4(chemokine cysteine-X-cysteine motif receptor 4,CXCR4)为辅助受体;5%~15%判定为趋化性细胞因子受体5(chemokine cysteinecysteine motif receptor 5,CCR5)/CXCR4双嗜性辅助受体;>15%判定为CCR5为辅助受体。
1.6 统计学处理 采用EpiData 3.1 软件录入数据,采用SPSS 23.0 软件对数据进行统计分析。计量资料以±s表示。
2 结 果
2.1 近似全长基因组分析 经过测序,所获得的7个片段经拼接后,序列全长为8695 bp。基因组中,4种碱基分别为:3199A、1491C、2071G、1934T,嘌呤(A+G)占 60.6%(5270/8695),毒株符合反转录病毒基因组碱基组成特征,将此毒株编号为FX2019042。经HIV Sequence Locator软件分析,FX2019042 从 5´-3´分 别 为 gag、pol、vif、vpr、tat、vpu、env、rev和 nef共 9个基因,参照HIV-1标准毒株HXB2,FX2019042毒株的序列位置见图1。

图1 FX2019042毒株基因序列位置图Figure 1 FX2019042 strain gene sequence location map
2.2 系统进化分析 在HIV Database中下载A~D、F~H、J~K各亚型及其常见重组亚型的参考株全长序列,使用Kimura2-parameter模型,绘制Neighbor-Joining系统进化树(见图2)。FX2019042毒株与G亚型参考株G.KE.1993.HH8793基因离散率为9.96%,并与其他G亚型参考株亲缘关系相近,Bootstrap值为98%,提示该毒株为G亚型毒株。
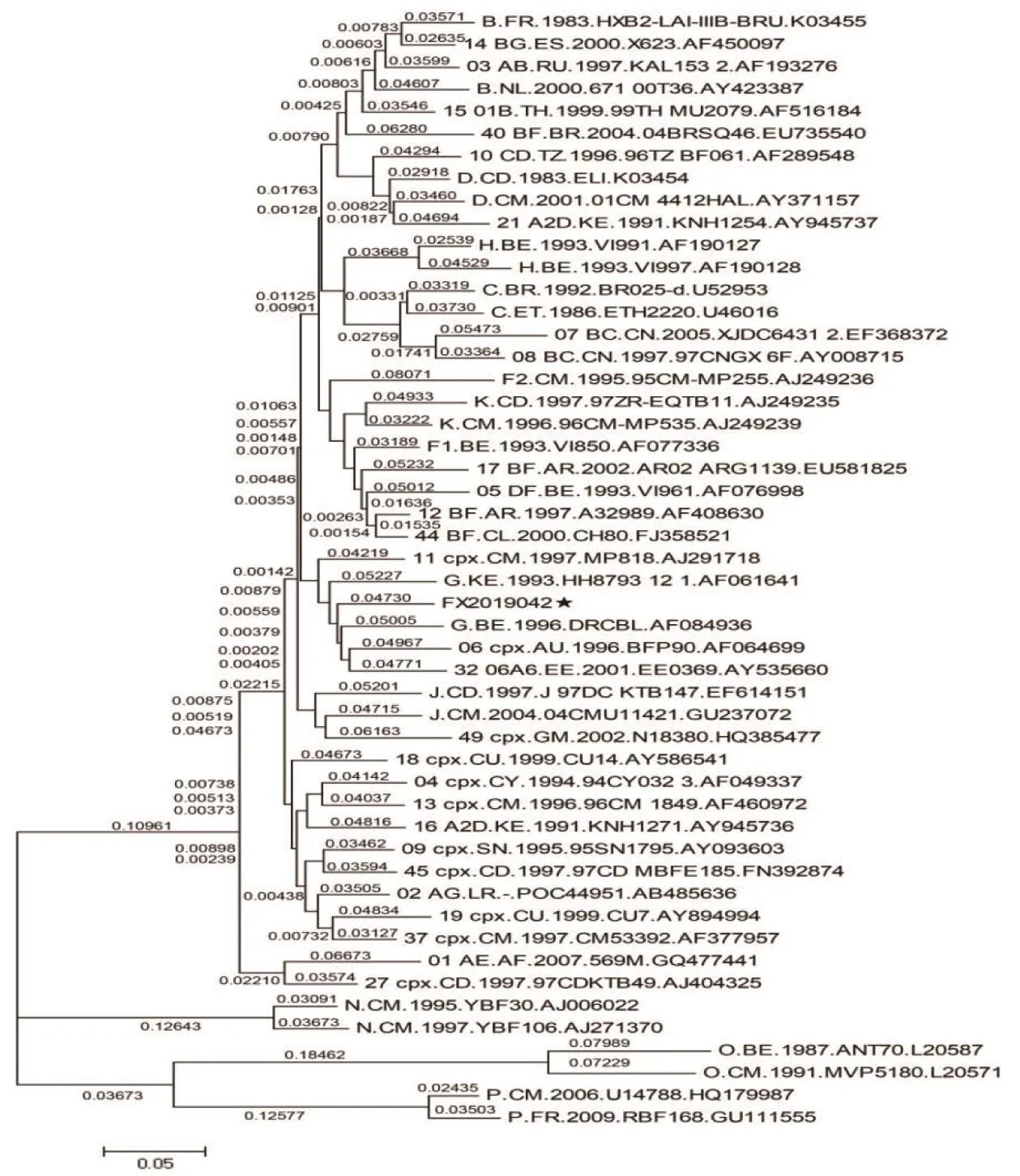
图2 FX2019042毒株与各亚型参考株全长序列进化分析★.FX2019042毒株Figure 2 Full-length sequence phylogenetic tree of FX2019042 and reference strains of each subtype
为了在分子生物学上进一步确定FX2019042毒株的来源,将GenBank中6株国内G亚型毒株和17株国外G亚型毒株与FX2019042一起绘制进化树。结果显示,我国的G亚型呈散在分布,FX2019042毒株与尼日利亚流行株G.NG.1995.NG1937.AF069937亲缘关系最近,基因离散率为8.95%(见图3)。GenBank中G亚型HIV基因组序列共142条,将FX2019042毒株的3个结构基因和6个非结构基因序列分别与G亚型HIV基因组中各基因比对,获得相似度分值,基因序列相似度比较结果见表2。结果显示,FX2019042毒株发生变异最大的主要基因为结构基因env和非结构基因tat。

图3 FX2019042毒株与G亚型参考株进化分析★.FX2019042毒株;●.与FX2019042毒株亲缘关系最近的G亚型毒株;△.国外G亚型毒株;▲.国内G亚型毒株Figure 3 Phylogenetic tree of FX2019042 strain and subtype G reference strain

表2 FX2019042毒株各基因与G亚型各基因序列相似度比较Table 2 Comparison of sequence similarity between each gene of FX2019042 strain and each gene of G subtype
2.3 基因重组分析 为了检测FX2019042毒株基因组是否存在重组片段,我们使用在线软件RIP3.0对FX2019042毒株进行重组分析,参数设置:windowsize=400,confidence threshold=90%,gapoption=3,multistate characters=yes。FX2019042毒株基因组序列重组分析结果见图4。结果显示,未发现FX2019042毒株基因组序列与HIV-1的A~D、F~H、J~K的9个亚型发生重组,提示该毒株为纯粹的HIV-1 G亚型毒株。

图4 FX2019042毒株基因重组分析X轴表示序列在移动的窗口中心的位置;Y轴表示与参考毒株相似程度Figure 4 Analysis of FX2019042 strain gene recombination
2.4 糖蛋白GP120分析 GP120的糖基化过程对于蛋白质的折叠至关重要,在HIV感染人体T淋巴细胞过程中,GP120通过糖基化使病毒吸附于T淋巴细胞,而且HIV可以利用糖基来阻塞抗体表位而逃避人体免疫系统。含511个氨基酸的GP120中,V1~V5为可变区,C1~C5为恒定区。对FX2019042毒株的GP120的可变区和糖基化程度进行分析,结果显示FX2019042毒株V3区有1个氨基酸缺失,在GP120区域共有25个糖基化位点,但其中8个位点因多糖空洞而导致糖基化位点缺失(见图5)。在辅助受体方面,对V3区关键氨基酸的分析显示,FX2019042毒株V3区氨基酸序列为CVRPNNNTRRSIHFGPGQA IYTTGIIGDIRQAHC,预测此毒株利用 CCR5作为辅助受体。

图5 FX2019042毒株GP120糖基化位点预测黄色部分代表缺失的糖基化位点Figure 5 Prediction of GP120 glycosylation sites of FX2019042 strain
3 讨 论
HIV-1 G亚型为古老的HIV-1亚型,在全球的流行分布极不平衡,主要集中在西非的尼日利亚和喀麦隆等地区。而G亚型与其他亚型重组形成的重组亚型则广泛分布[6-7],在我国常见的为CRF02_AG流行重组型,在世界范围内,虽然G亚型感染者只占全部HIV-1感染者的5.0%,但CRF02_AG感染者占全部HIV-1感染者的7.7%。在G亚型的发源地西非地区,67%的HIV-1感染者中能检测到G亚型基因片段[7],可见G亚型毒株极易与其他毒株发生重组并获得传播优势,需要加强对本地区的HIV流行株严密监测,防止新型重组毒株的出现及流行。
我国发现的HIV-1 G亚型毒株较少,仅重庆、上海和广西有相关报道[3,8-9]。我国在重庆市首次检测到G亚型毒株[8],根据HIV传统分型基因env,鉴定为G亚型,但是由于只测序了env基因的686 bp,无法排除此毒株为CRF02_AG重组亚型的可能[3,9]。在2019年的艾滋病监测中,本课题组发现了1例HIV-1 G亚型毒株,对其进行基因组测序,RIP 3.0软件分析显示FX2019042为纯G亚型,构建的系统进化树显示FX2019042毒株与尼日利亚毒株亲缘关系最近,与在广西等地发现的G亚型毒株亲缘关系较近[3,10],但与上海分离株sh52亲缘关系较远,推测FX2019042毒株为境外输入型毒株。
HIV-1感染人体细胞除了需要与CD4+T淋巴细胞受体结合外,还需要env基因编码的辅助受体CCR5和CXCR4[1,11-12]。这两种受体为HIV-1进入人体细胞的主要辅助受体,在艾滋病不同时期HIV-1使用的辅助受体不同,在HIV-1感染早期,体内病毒准种常以CCR5为辅助受体,随着病情进展,病毒利用的辅助受体向CXCR4过渡,在感染晚期则利用CXCR4辅助受体[1,3-15]。由于GP120的糖基化过程对于HIV-1感染细胞至关重要,而且HIV可以利用糖基来阻塞抗体表位而逃避机体免疫功能[12,15],所以本研究在基因序列分析基础上,对FX2019042毒株的GP120可变区和糖基化程度进行分析,结果显示,FX2019042毒株准种进入CD4+T淋巴细胞时利用的辅助受体为CCR5,这与该患者病程为艾滋病发病早期相符。
综上,本研究对艾滋病监测获得的HIV-1 G亚型近似全长基因组序列进行研究,从分子流行病学角度证实该毒株为境外输入型毒株,这与该感染者流行病学史相符。此毒株序列的测定和分析对于本地区HIV流行趋势和HIV毒株多样性研究均具有重要意义,提示我们需加强艾滋病监测,防止境外毒株与本地毒株发生重组和流行。
