肾综合征出血热患者血清铁蛋白水平变化研究
2021-03-25胡海峰连建奇王晓艳王平忠白雪帆
胡海峰,连建奇,王晓艳,王平忠,白雪帆,李 璟,杜 虹
铁蛋白(ferritin,FRT)作为机体内一种铁储存的可溶性大分子组织蛋白质,是去铁蛋白和铁核心Fe3+形成的复合物。FRT主要存在于肝脏、脾脏和骨髓的网状内皮细胞内,正常情况下为骨髓合成血红蛋白供铁,并根据机体需要向血清中释放,可维持血红蛋白相对稳定,故临床常将FRT水平作为体内缺铁或铁过量的指标[1]。
目前认为,血清FRT水平不仅受铁代谢的影响,还受感染、细胞更新、组织坏死等炎症活动的影响。FRT通过不同的机制调节免疫活动,包括促凋亡和抗凋亡通路以及诱导促炎细胞因子的合成[2]。随着对FRT研究的不断深入,大量数据表明,FRT与冠心病、动脉粥样硬化、急性脑梗死、脑出血、骨髓增生异常综合征、非酒精性脂肪肝、类风湿关节炎、抗心磷脂综合征、噬血细胞综合征、Ⅱ型糖尿病等疾病密切相关[3-6]。此外,越来越多的研究表明,FRT可作为一种新型的评价机体炎性状态和氧化应激的指标[7]。FRT增高可能还与炎症及感染有关,其有助于早期评估脓毒症的严重程度,预测患者预后[8-9]。
在病毒感染方面,近年来亦有研究表明,FRT与埃博拉出血热和克里米亚-刚果出血热患者的病毒血症、出血风险和死亡相关[10-11],但是对汉坦病毒所致肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)患者病程中FRT动态变化的相关研究较少[12]。本研究基于上述背景,以2011年10月—2013年12月我院收治的102例HFRS确诊患者为研究对象,观察不同分型、不同分期HFRS患者血清FRT水平变化,探讨其对HFRS严重程度及预后(死亡)评估的价值。
1 对象与方法
1.1 对象 收集空军军医大学第二附属医院传染科2011年10月—2013年12月收治的符合纳排标准的102例HFRS患者为研究对象。纳入标准:①符合HFRS典型临床表现且经血清学检查(HFRS特异性IgM和IgG阳性)确诊;②年龄为18~70岁;③入院时处于HFRS病程急性期。排除标准:①年龄<18岁或>70岁;②入院时已进入HFRS病程的恢复期;③合并妊娠的女性患者;④合并心血管疾病、糖尿病、血液系统疾病、慢性肾脏疾病、自身免疫性疾病、病毒性肝炎或艾滋病患者。鉴于发热期、低血压休克期和少尿期是HFRS患者疾病进展、脏器功能损伤和并发症发生的主要时期,而且多数患者在进入多尿早期时,肾功能损伤仍较重,可能伴有肾性脑病、肾破裂等严重并发症,因此本研究将急性期界定为发热期至多尿期前3病日,恢复期为多尿中后期和恢复期[13]。另选取28例健康志愿者作为对照。依据HFRS临床分型标准,将纳入的102例患者分为轻型、中型、重型和危重型4组,对患者人口统计学信息及住院期间实验室检查数据进行采集汇总。本研究经空军军医大学第二附属医院伦理委员会审查同意,所有纳入患者均签署知情同意书。
1.2 标本采集与保存 采用无抗凝剂的干燥管,分别于纳入患者病程的急性期和恢复期各采集1份晨起空腹血标本,每份5 ml。标本采集后30 min内进行低温高速离心(4 ℃,5000 rpm,10 min),分离血清,用500 μl EP管分装后,冻存于-80℃冰箱中备用。为避免因标本反复冻融影响检测结果,以及检测过程中因不同批次试剂带来的误差,待全部标本收集完后一次性解冻,成批检测。
1.3 FRT检测 采用双抗体夹心ELISA法测定标本中的FRT含量,所使用的试剂盒购自上海西唐生物科技有限公司且为同一批号。实验操作严格按照试剂盒操作说明进行。以标准品浓度为横坐标,吸光度(optical density,OD)值为纵坐标,绘制标准曲线。根据各样本OD值计算出相应FRT含量。每个样本均设复孔,取平均值作为该样本的FRT含量。
1.4 统计学处理 分别用SPSS 23.0和GraphPad Prism 8进行数据统计分析和图表绘制。对符合正态分布且各组间方差齐同的资料用±s表示,组间总体比较用单因素方差分析,组间两两比较用SNK-q检验。对不符合正态分布或组间方差不齐的资料用中位数(四分位数间距)表示,用非参数Kruskal-Wallis H检验比较总体差异,用Nemenyi秩和检验进行组间两两比较,两配对样本比较采用Wilcoxon符号秩检验。计数资料用频数(率)表示,组间比较用χ2检验或Fisher确切概率法。急性期FRT与常规实验室指标的相关性用Spearman秩相关分析。应用Logistic回归分析构建基于急性期FRT和常规实验室指标的HFRS预后(死亡)风险模型,并用ROC曲线评估模型、FRT和常规实验室指标对HFRS预后(死亡)预测的价值。双侧P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料 102例HFRS患者中,男性81例,女性21例,平均年龄为42.15岁。其中轻型组17例、中型组19例、重型组27例、危重型组39例,危重型患者中有18例在急性期死亡。各型患者与对照组之间的性别、年龄分布,以及各型急性期采血时间比较,差异均无统计学意义(P均>0.05)(表1)。

表1 HFRS患者及健康对照者的人口统计学特征Table 1 Demographic characteristics of patients with HFRS and healthy controls
2.2 HFRS患者血清FRT水平比较 各型HFRS患者急性期血清FRT水平均高于同型恢复期和对照组(P均<0.05),且随着病情加重,FRT水平逐渐增高,在危重型患者中表达最高(P<0.05)。各型患者恢复期血清FRT水平均高于对照组(P均<0.05),但各型间表达差异无统计学意义(P>0.05)(图1)。

图1 HFRS患者血清FRT水平比较A.各组急性期静脉血标本量:轻型n=17,中型n=19,重型n=27,危重型n=39,对照组n=28;各型患者急性期血清FRT水平比较,H=71.734,P=0.000。B.各组恢复期静脉血标本量:轻型n=13,中型n=15,重型n=25,危重型n=21,对照组n=28;各型患者恢复期血清FRT水平比较,H=33.074,P=0.000。C.各型患者急性期血清FRT水平与同型恢复期对比:轻型组,Z=-3.180,P=0.001;中型组,Z=-3.296,P=0.001;重型组,Z=-4.372,P=0.000;危重型组,Z=-4.015,P=0.000。Kruskal-Wallis H检验比较多组间总体差异。Nemenyi秩和检验进行多组间两两比较。两配对样本比较采用Wilcoxon符号秩检验。*.P<0.05Figure 1 Comparison of serum FRT levels in patients with HFRS
2.3 FRT与常规实验室指标的相关性分析 Spearman相关性分析显示,HFRS患者急性期血清FRT水平与WBC、PLT、AST、APTT等常规实验室指标均具有相关性。其中与PLT相关性最强(rs=-0.792,P=0.000)(表2,图2)。
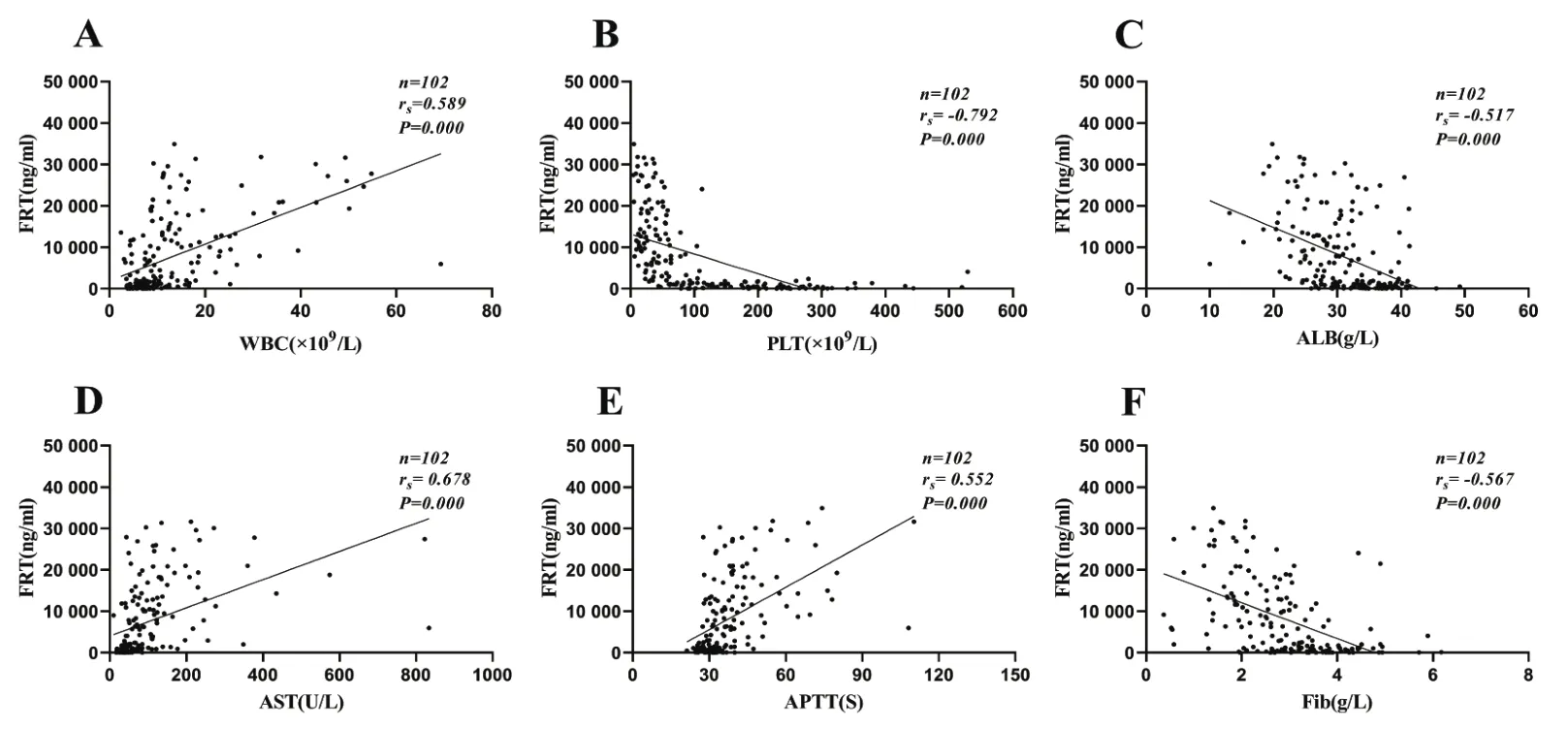
图2 FRT与WBC、PLT、ALB、AST、APTT、Fib的相关性Figure 2 Correlation analysis between FRT and WBC,PLT,ALB,AST,APTT,Fib

表2 FRT与常规实验室指标的相关性分析Table 2 Correlation analysis between FRT and conventional laboratory parameters
2.4 HFRS预后(死亡)风险模型构建及ROC曲线分析 纳入HFRS患者急性期FRT及常规实验室指标(WBC、PLT、HGB、ALB、ALT、AST、PT、APTT、Fib、BUN、SCr、K+、Na+),应用Logistic回归分析构建HFRS预后(死亡)风险模型,最终进入模型的指标为WBC、AST和APTT(表3)。
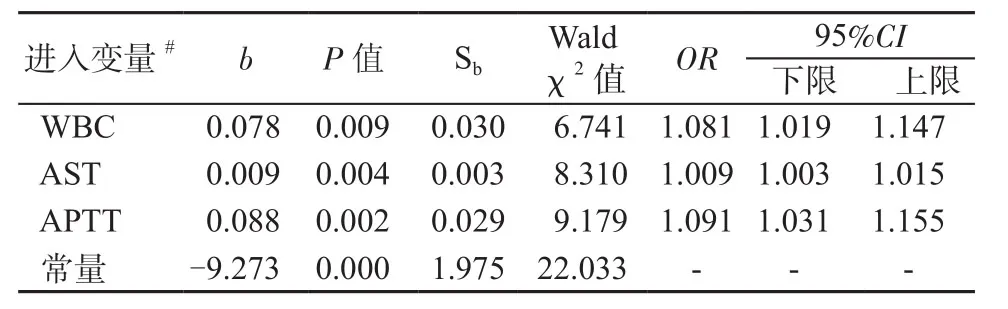
表3 Logistic回归分析构建HFRS预后(死亡)风险模型*Table 3 Prognostic (death) risk model* in patients with HFRS constructed by Logistic regression analysis
应用ROC曲线分析评估模型对HFRS患者预后(死亡)的预测价值,AUC为0.936(95%CI:0.867~1.000,P=0.000),敏感度为94.4%,特异度为59.0%,模型预测预后(死亡)的价值高于FRT、WBC、PLT和AST等单个实验室指标(表4,图3)。

图3 ROC曲线分析模型及单个实验室指标预测预后(死亡)的价值Figure 3 ROC curves for evaluating the predictive values of prognostic risk model and single laboratory parameter

表4 预后风险模型及单个实验室指标预测预后(死亡)的价值比较Table 4 Comparison of predictive values for prognosis (death) between the prognostic risk model and single laboratory parameter
3 讨 论
HFRS是由汉坦病毒感染引起的一种自然疫源性疾病,我国一直是HFRS流行的重灾区,特别是陕西省关中地区,以汉坦型病毒感染引起的重症患者居多,死亡率较高[14]。HFRS具有全身炎症反应综合征的病理生理特征,病毒感染后可导致内皮细胞受损,血管通透性增加,重症患者甚至出现“毛细血管渗漏综合征”[15-16]。HFRS的临床表现以发热、出血及肾脏损害为主要特征,典型病例通常有发热、低血压休克、少尿、多尿和恢复期五期经过[17]。在某些重症患者中,发热、低血压休克和少尿期可能重叠,进而出现难治性休克、急性呼吸窘迫综合征、急性肾损伤、脑病、严重凝血功能障碍和多器官功能障碍综合征[18]。虽然国内早在二十世纪80年代制定了HFRS的临床分型标准,其在该病防治中起到了十分重要的作用,但由于该分型标准中多数指标均建立在患者主观症状和医生体检的基础上,大多数参数未能量化,因此难以早期评估患者病情及预测预后,使用上具有一定局限性。近年来,亦有部分研究探索了一些可反映HFRS疾病严重程度和预测患者预后的早期预警指标,如白细胞介素-18、脂联素、生长抑制特异性蛋白-6、尿中性粒细胞明胶酶相关脂质运载蛋白等[19-21]。但是以上指标由于检测成本较高,操作方法复杂,而且预测效力不高,因此尚未推广应用至临床。
在本研究中,我们检测了HFRS患者血清FRT水平变化,发现急性期FRT浓度较同型恢复期和健康对照明显升高,且与疾病严重程度呈正相关,在危重型患者中表达最高。FRT作为一种评价机体炎性状态和氧化应激的指标,该结果反映了汉坦病毒感染后机体超强的免疫反应所致的“细胞因子风暴”,这与FRT在脓毒症、埃博拉出血热和克里米亚-刚果出血热患者中的研究结果相一致[8-11]。汉坦病毒侵入机体后,引起机体过度的炎症反应,大量炎症因子释放可能诱导肝细胞合成并释放FRT。同时,HFRS患者WBC升高,中性粒细胞和单核巨噬细胞在抗炎吞噬过程中可大量合成并释放FRT,进而引起血清FRT水平升高。此外,重症HFRS患者肝细胞受损导致大量FRT释放入血可能也是其急性期血清FRT水平升高的机制之一。
本研究还发现HFRS患者血清FRT水平与WBC、PLT、AST和APTT等指标密切相关。WBC是机体固有免疫充分活化的标志,PLT与血管内皮细胞损伤程度密切相关,AST、APTT分别反映了患者心脏和凝血系统的受损程度。这表明急性期血清FRT水平与HFRS疾病严重程度密切相关。ROC曲线分析显示,FRT预测HFRS预后(死亡)的敏感度和特异度均较高,其预测价值与WBC、PLT、AST、APTT等常规实验室指标相当。因此,FRT可用于评估HFRS患者病情,并预测患者预后。
FRT是目前临床工作中实际开展的检查项目,其检测方法简单,操作方便,价格低廉。但因不同疾病甚至同一疾病不同病程的FRT水平变化较大,部分医院在检测时仅按说明书操作,在检测到>2000 μg/L以后便不再进一步稀释,且大多数医院主要将其作为肿瘤标志物而用于早癌筛查,这些因素均限制了FRT在临床诊疗中的应用。本研究结果显示,FRT在重症HFRS早期预警及预后评估中具有重要价值,可进一步推广普及此项检测,建议将其作为HFRS的一项常规检测项目。当然,考虑到不同分型、不同病期HFRS炎症反应程度不同,需要对采集的血样本进行合理地稀释,以得到更为准确的检测结果,这样才能真正发挥FRT在重症HFRS早期预警及预后评估中的作用。
本研究中Logistic回归分析所构建的预后(死亡)风险模型表明,联合多个指标对HFRS患者预后进行评估,其预测效力明显高于单个实验室指标。但该模型最终纳入的3个指标为WBC、AST和APTT,FRT未能进入模型。因此,未来需要扩大样本,采取多中心、前瞻性研究,进一步深入探索并验证包括FRT在内的新的重症HFRS早期预警指标,对现有的影像学检查、实验室指标和重症监护数据进行有效整合和分析,构建基于新型生物标志物、临床参数和实验室指标的预后风险模型,制定HFRS重症评分系统及新的临床分级标准,以早期动态评估HFRS患者病情变化并预测患者预后,这对指导临床医生及时调整治疗方案,提高重症患者救治成功率、改善患者预后具有重要意义。
