海洋亚硝酸盐氧化细菌的多样性分布及其生态功能研究进展
2021-03-25洪义国焦黎静吴佳鹏龙爱民王伟
洪义国, 焦黎静, 吴佳鹏, 龙爱民 , 王伟,
1. 广州大学大湾区环境研究院, 珠三角水质安全与保护教育部重点实验室, 广东 广州 510007;
2. 广州大学环境科学与工程学院, 广东 广州 510007;
3. 热带海洋环境国家重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
4. 中国科学院大学, 北京 10049
硝化过程是指微生物将氨(NH4+)氧化成为亚硝酸盐(NO2−), 并进一步氧化成为硝酸盐(NO3−)的过程, 是全球氮循环过程的一个重要环节, 在维持自然生态系统的运行中发挥重要作用(Ward et al, 2007; Zehr et al, 2011; Kuypers et al, 2018)。一般认为硝化过程由两类功能微生物介导: 氨氧化微生物(Ammonia-oxidizing microbes, AOM)和亚硝酸盐氧化微生物(Nitrite-oxidizing microbes, NOM)。其中, AOM 包括氨氧化细菌(Ammonia-oxidizing bacteria, AOB)和氨氧化古菌(Ammonia-oxidizing archaea, AOA), 催化硝化过程的第一阶段, 即NH4+氧化生成NO2−的过程。而NOM 目前只发现亚硝酸盐氧化细菌(Nitrite-oxidizing bacteria, NOB), 催化硝化过程的第二阶段, 即NO2−氧化生成NO3−的过程。相较于AOM, 目前对NOB 的认知相对较少, 这严重制约了对硝化过程以及相关微生物功能类群的了解, 原因主要有两个: 1) 氨氧化过程是硝化过程的限速步骤, 环境中很少有NO2−的累积。因此, 对于NOB的群落结构及生理特性的探究没有受到足够的重视; 2) NOB 通常在生长过程中聚集成簇, 被胞外聚合物包围, 所以相较于AOB 和AOA, NOB 的分离与鉴定更加困难, 制约了在纯培养水平上对NOB 生理功能和遗传特征的认识。随着现代分子生态技术的进步, 例如变性梯度凝胶电泳技术(Denatured Gradient Gel Electrophoresis, DGGE)、鸟枪测序技术(Shotgun sequencing)、全基因组测序技术(Whole-genome sequencing)、荧光原位杂交技术(Fluorescence in situ Hybridization, FISH)、高通量测序(High-throughput sequencing)等技术的发展, 我们对NOB 的多样性、生态分布以及代谢途径都有了更深入的了解, 同时也认识到NOB 在海洋生态系统的物质和能量代谢中发挥重要生态功能, 从而推动了海洋亚硝酸盐氧化过程的研究。本文基于NOB 的最新研究进展, 对其在海洋生态系统的生态分布和生态功能进行综述, 以加深对NOB 的进一步认识。
1 亚硝酸盐氧化细菌的种类
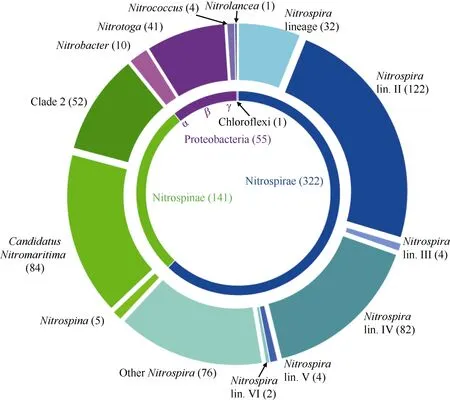
图1 不同种类亚硝酸盐氧化细菌的系统进化关系[根据Daims 等(2016)绘制] 图中括号内的数字表示某个门或者属的亚硝酸盐氧化细菌的包含的种的个数; 内环表示亚硝酸盐氧化细菌在门分类水平上的种类和相对丰度; 外环表示亚硝酸盐氧化细菌在属分类水平上的种类和相对丰度 Fig. 1 Phylogenetic tree among different species of nitrite oxidizing bacteria
在一个多世纪以前, Winogradsky 首次分离出亚硝化单胞菌(Nitrosomonas)和硝化杆菌(Nitrobacter) (Winogradsky et al, 2012), 开启了NOB 的微生物学研究。目前, 已鉴定的NOB 共涵盖4 个细菌门, 分别为变形菌门(Proteobacteria)、硝化刺菌门(Nitrospinae)、绿弯菌门(Chloroflexi)以及硝化螺旋菌门(Nitrospirae)。已知的NOB 归属于7 个不同的菌属, 分别为硝化杆菌属(Nitrobacter)、硝化球菌属(Nitrococcus)、硝化螺旋菌属(Nitrospira)、硝化刺菌属(Nitrospina)、Nitrolancea 属以及没有纯培养菌株的 Candidatus Nitrotoga 属和 Candidatus Nitromaritima 属(图1)。此外, Griffin 等从活性污泥和淡水沉积物中通过富集培养分离到一株能利用亚 硝酸盐作为电子供体进行不产氧光合作用的荚硫菌属菌株Thiocapsa KS1 (Schott et al, 2010)。16S rRNA基因分析表明, 此菌株与桃红荚硫菌(Thiocapsa roseopersicina)和Nitrococcus 有较高的相似度, 但进一步的系统发育和生物化学分析显示, 菌株KS1 的亚硝酸盐氧化还原酶(Nitrite Oxidoreductase, NXR)是从硝酸盐还原酶(Nitrate Reductase)的一个分支进化而来, 与传统的化能自养NOB 的NXR 存在较大差异, 因此通常不归入传统的NOB 系列(Hemp et al, 2016)。变形菌门中的 NOB 种类最多, 包括Nitrobacter 属、Nitrococcus 属以及 Candidatus Nitrotoga 属。Nitrobcater 是最早用于研究NOB 的模式微生物, 属于α 变形菌门。目前已完成全基因测序的 Nitrobacter 菌株有 N. hamburgensis、N. winogradskyi、N. alkalicus 以及N. vulgaris (Meincke et al, 1992; Hemp et al, 2016)。Candidatus Nitrotoga- arctica 是从西伯利亚北极圈的永久冻土中分离的嗜冷型NOB 菌株, 属于β 变形菌门(Alawi et al, 2007)。Nitrococcus mobilis 分离于南太平洋水体, 隶属于γ变形菌门(Watson et al, 1971)。
Nitrospinae 菌门在海洋环境中具有较高的丰度, 目前分离鉴定的有 Nitrospina 属和 Candidatus Nitromaritima 属。Nitrospina 最初被归为δ 变形菌门, 直到2013 年Lücker 等利用基因组测序技术对从大西洋表层水体中分离得到的菌株N. gracilis strain 3/211 并进行基因组测序分析, Nitrospina 被重新归为Nitrospinae 菌门(Lücker et al, 2013)。随后, 从黑海水体中分离到的菌株Nitrospina watsonii sp. Nov, 也被归为Nitrospinae 菌门(Spieck et al, 2014)。2015年Ngugi 等采用单细胞基因组技术从红海海水中分离鉴定的新种 Candidatus Nitromaritima RS 与Nitrospina 亲缘关系较近, 也被归属于Nitrospinae菌门(Ngugi et al, 2016)。
Chloroflexi 菌门目前发现的只有 Nitrolancea hollandica 菌, 分离于硝化反应器, 是NOB 中唯一的革兰氏阳性菌(Sorokin et al, 2012; Kruse et al, 2013)。全基因组测序结果表明, N. hollandica 中含有卡尔文循环中相关的所有CO2固定基因, 能在亚硝酸盐氧化的同时固定CO2, 也可以利用甲酸盐作为能源和碳源(Sorokin et al, 2012)。目前, 在海洋环境中还没有发现这类菌。
Nitrospirae 菌门中目前只有Nitrospira 菌属, 在Nitrospirae 菌门的亚硝酸氧化还原酶基因(nxr)系统发育分析中形成独立的一个分支, 并且被认为是分布最广且多样性最高的 NOB。目前已鉴定的Nitrospira 属分离于海水(Watson et al, 1986; Hentschel et al, 2002; Spieck et al, 2006; Haaijer et al, 2013)、供暖系统(Ehrich et al, 1995)、污水处理系统(Lebedeva et al, 2008; Ushiki et al, 2013; Nowka et al, 2015)以及热泉(Lebedeva et al, 2011)等不同生态系统。2015 年通过富集培养得到的3 株完全硝化菌(Comammox): Candidatus Nitrospira inopianata (Daims et al, 2015)、Candidatus Nitrospira nitrosa 和 Candidatus Nitrospira nitrificans (van Kessel et al, 2015), 都属于Nitrospira 菌属。
2 亚硝酸盐氧化细菌多元起源的系统进化
基于纯培养、富集培养和基因组分析鉴定的NOB 的种属信息, 利用16S rRNA 和nxr 基因序列的系统进化分析, 揭示了不同种属NOB 之间的系统进化关系。Pester 等依据Nitrospira 纯培养菌的16S rRNA 的系统进化, 对Nitrospira 菌属的NOB 进行了亚群(Sublineage)分类, Ca. N. defluvii 归属于Sublineage Ⅰ; N. lenta、N. moscoviensis、N. japonica以及Comammox 类的Ca. N. nitrosa、Ca. nitrificans和Ca. N. inopinata, 在系统发育树上聚集成一簇, 归属于Sublineage Ⅱ; N. marina 和N. Ecomare 的进化关系较近, 归属于Sublineage Ⅳ; Sublineage Ⅴ中包含Ca. N. bockiana; Sublineage Ⅵ中包含N. calida; 而Sublineage Ⅲ中目前还没有分离出纯培养菌(Pester et al, 2014) (图1)。由于Comammox 类的NOB 在Nitrospira 属中不能形成独立的分支, 因此无法通过16S rRNA 基因将其与传统的Nitrospira分开。
基于nxrB 基因的系统发育分析, 可以进一步分析 NOB 之间的系统进化关系(图 1)。归属于Sublineage Ⅰ的Ca. N. defluvii 在功能基因进化关系上与Sublineage Ⅱ比较接近, 表明Sublineage Ⅰ可能是从Sublineage Ⅱ进化而来。此外, N. inopinata与其他 NOB 进化距离较远, 表明完全硝化菌 N. inopinata 的nxrB 基因与其他Nitrospira 菌的nxrB基因进化关系有所不同。N. inopinata 对硝酸盐亲和性较高, 甚至高于AOB 和陆源的氨氧化古菌(AOA), 但对亚硝酸盐亲和性较低(Kits et al, 2017)。所以在多数亚硝酸盐浓度较低的自然环境中, N. inopinata可能不仅发挥亚硝酸盐氧化功能, 也可能具有较强的反硝化能力(Kuypers et al, 2018)。同样, 在基于nxrB 基因的分析中, Comammox 类的 NOB 在Nitrospira 菌属中也不能形成独立的分支, 因此也无法通过nxrB 基因将其与传统的Nitrospira 菌分开。对比目前已鉴定种属信息的Nitrospira 纯菌的16S rRNA 基因系统发育树和nxrB 基因系统发育树可知, 两基因在进化关系上具有一定的相对一致性, 但Sublineage Ⅰ的功能基因可能与Sublineage Ⅱ发育关系更近。除N. inopinata 外, 其他两种Comammox菌的 16S rRNA 基因和 nxrB 基因均与其他传统Nitrospira 菌进化一致。
Comammox 不仅具有亚硝酸氧化功能, 还能氧化氨。因为Comammox 基因组中存在氨氧化基因(amo) 和羟胺氧化基因(hao), Daims 等推测Comammox 的amoA 基因可能是从β-AOB 中水平转移而来, 并且在转移后经历了不同的进化过程, 从而导致基因差异的出现(Daims et al, 2015)。由于Comammox 的amoA 基因与AOA/AOB 的相关基因存在差异, 因此amoA 基因被用作分子标记区分这3种功能类菌群(Xia et al, 2018)。虽然Comammox 具有直接将氨代谢生成硝酸盐的功能, 但相对丰度检测结果表明, Comammox 几乎不可能是自然生境中的唯一硝化菌群, Comammox 在环境中与传统的AOM、NOB 同时存在(Koch et al, 2018)。但是Comammox 和AOA、AOB 以及NOB 间的相互关系目前还尚不清楚。值得肯定的是, Comammox 具有广泛的生态位, 因为生理生态学研究表明, Comammox 具有较强的底物摄取能力, 并且能适应较低的溶氧环境。目前, Comammox 被发现广泛分布于地下水系统、饮用水系统、地下水快速滤砂系统以及土壤中(Pjevac et al, 2017)。
纵观NOB 的系统进化关系, 发现NOB 分属于不同的菌门和菌属, 推测NOB 的进化是多源的, 是经过多次独立的进化而产生不同的基因型。对于nxr基因的同源性分析表明, NOB 的多样性是基因转移和独立进化共同作用的结果(Hong et al, 2020)。基于不同种属NOB 的功能基因的同源性, 需要提出这样的问题: 最初的亚硝酸盐氧化微生物是什么?如果亚硝酸盐氧化细菌的祖先是变形菌, 那么很可能亚硝酸盐氧化最初在变形菌的微生物中出现, 然后向其他类型细菌转移扩散, 形成现代生态系统中的NOB 的多样性种群结构。虽然NOB 是多源进化的, 但是其多样性却是有限的, 在系统进化上归于较小的群体种类。因此可以使用分子探针容易的检测环境中NOB 细菌多样性组成, 形成了关于自养NOB多样性和生态分布的认知体系, 而且对于进一步研 究NOB 提供了可以借鉴的方法。
3 亚硝酸盐氧化细菌的亚硝酸盐氧化以及自养固碳机制
NO2−的氧化(NO2−+H2O→NO3−+2H++2e−)是由亚硝酸盐氧化还原酶(NXR)催化完成的, 产生的电子运输到末端氧化酶供氧气消耗(2H++2e−+0.5O2→H2O)。整个反应(NO2−+0.5O2→NO3−)产生中等大小的能量(△G0= 82kJ·mol−1), 这解释了通常NOB 较慢的生长率。NOB 的功能基因nxrA、nxrB 和nxrC 分别编码NXR 的α、β 及γ 亚基。α 亚基主要是与底物结合, β亚基及γ 亚基则负责电子转运。基于Daims 等综合NOB 菌株的细胞生物化学和基因组学信息, 构建了两种NOB 亚硝酸盐氧化的作用模型以及在氧化亚硝酸盐时可能发生的电子转运过程(Daims et al, 2016)( 图 2) 。 其 中, Nitrospira 、 Nitrospina 和 Candidatus Nitromaritima 的α 亚基分布于周质空间, 而Nitrobacter、Nitrococcus 和Nitrolancea 的α 亚基则分布于细胞质中。在第一种模型中, NXR 在周质空间将亚硝酸盐氧化成硝酸盐的同时水解水分子, 形成质子驱动势能, 通过呼吸链产生ATP和NADH, 为其自养还原性三羧酸代谢固碳过程提供能量。在第二种模型中, 电子转运蛋白把亚硝酸盐泵进细胞内, NXR 在细胞质内氧化亚硝酸盐, 产生ATP 和NADH, 为卡尔文循环固碳提供能量。在这种模式下, 转运硝酸盐和亚硝酸盐需要消耗能量, 导致这种亚硝酸盐氧化过程产生的能量较低。
这两种NXR 的工作原理及不同固碳模式反映了不同种类NOB 的进化过程。具有细胞质朝向NXR的NOB 细菌可能是从光合细菌进化而来。由于电子传递链是质子或电子在一系列复合物中依次传递的过程, 复合物的转向一般不容易发生颠倒, 否则会影响电子在下游复合物中的传递(Lücker et al, 2010)。对于光合细菌而言, 细胞膜电势是由光驱动的电子流维持, 细胞质朝向的NXR 有利于亚硝酸盐氧化过程和电子传递链的发生。因此, 当功能菌从光合营养型向化能自养型转变时, NXR 维持朝向不变。这一推论与Griffin 等发现的以亚硝酸盐为电子供体的不产氧光合细菌相吻合, 且该菌与Nitrococcus 进化关系较近(Griffin et al, 2007)。相反, Nitrospira 与光合菌进化关系较远, 周质空间朝向的NXR 表明它们可能是从厌氧菌或微好氧菌进化而来, 这同时也能解释Nitrospira 中存在的还原性三羧酸代谢固碳途径(Lücker et al, 2010)。
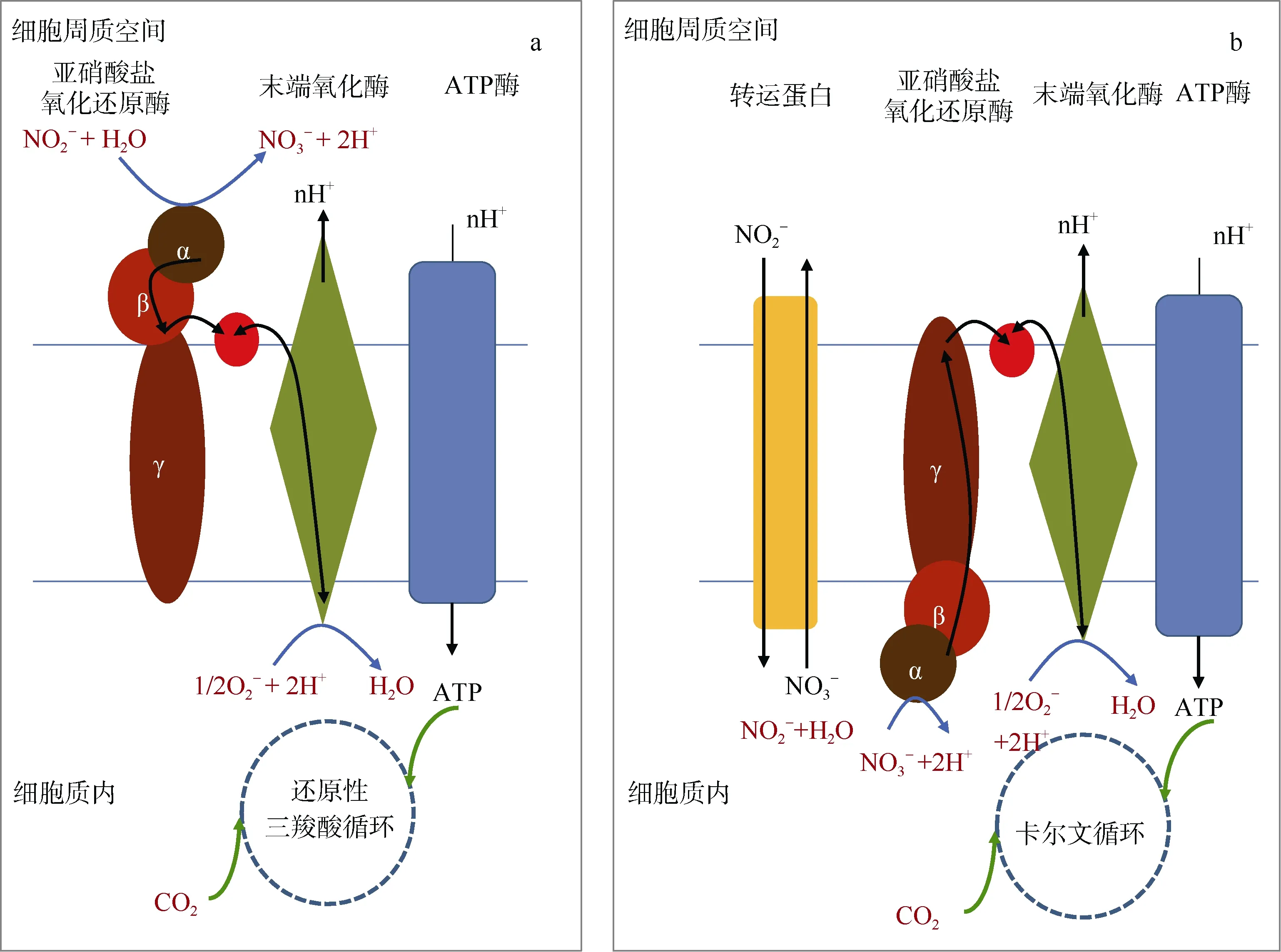
图2 亚硝酸盐氧化细菌两种不同的亚硝酸盐氧化和自养固碳模型 a. 第一种模型: 在周质空间氧化亚硝酸盐偶联还原性三羧酸循环自养固碳; b. 第二种模型: 在细胞质内氧化亚硝酸盐偶联卡尔文循环自养固碳 Fig. 2 Two different modes of nitrous oxide coupled to autotrophic carbon sequestration by nitrous oxide bacteria (NOB). The first mode is to oxidize nitrite coupled with reductive tricarboxylic acid in the periplasmic space, and the second one is to oxidize nitrite coupled with Calvin cycle in the cytoplasm
与其他类型微生物的相互协作也是NOB 的重要生存策略。N. moscoviensis 含有编码脲酶的基因, 可以水解尿素产生CO2和氨, 并将氨提供给AOB, AOB 则将氨氧化产物亚硝酸盐提供给 N. moscoviensis 作为代谢底物, 从而达到互惠共生的作用(Koch et al, 2015)。Ca. N. bockiana 在纯培养条件下不能利用有机质, 但在自然条件下, Ca. N. bockiana 与 Nocardioides sp.共生, 有机质能为Nocardioides sp.提供反应底物促进其生长, 与此同时, Nocardioides sp.能将硝酸盐还原为亚硝酸盐从而为Ca. N. bockiana 提供反应底物。目前对于不同硝化微生物间的相互作用机制仍了解较少, 是未来的重要研究方向(Koch et al, 2015)。
4 亚硝酸盐氧化细菌在海洋碳氮生物地球化学循环中发挥重要功能
NOB 在海洋生态系统中广泛分布, 是海洋生态系统中氮素循环的重要参与者。在太平洋东南部季节上升流区以及沉积物中, Nitrospina 属类细菌是亚硝酸盐氧化氧化的主要驱动者, 占到总细菌的5% (Levipan et al, 2014; Rani et al, 2016)。其中Nitrospina 属和Nitrococcus 属是海洋环境中NOB 的优势种群。在纳米比亚氧气最小区域(Namibian oxygen minimum zone, OMZ), 利用16S rRNA 的酶联荧光原位杂交技术(Catalyzed Reporter Deposition Fluorescent in situ Hybridization, CARD-FISH) 仅检测到Nitrospina 属和Nitrococcus 属, 且两种微生物分别占总微生物量的 5.4%和 4.9% (Füssel et al, 2012); Nitrospina 在东热带北太平洋(Eastern Tropical North Pacific Ocean, ETNP)表层水体及OMZ 区域总细菌群落中占据9.25% (Beman et al, 2013); 在红海水体中, Nitrospina 属占据咸水~海水交界面细菌 16S rRNA 基因序列总量的 1/3, 而Candidatus Nitromaritima 则主要分布在高盐高温环境中(Ngugi et al, 2016)。最近使用宏基因组手段对海洋无光层NOB 的研究发现, NOB 在海洋中层纬度上的差异很小, 主要表现在垂直剖面上的分布差异, 这可能是因为在海洋中层纬度上温度差异小, 而在垂直剖面上温度、营养盐、溶解氧浓度和静水压力都有很大不同(Pachiadaki et al, 2017 )。另外也发现海洋中层NOB 拥有一个高吸附性的亚硝酸盐氧化还原酶(NXR), Nitrospira 属在海洋中层分布广泛、丰度高可能与该酶有关。与 Nitrococcus 属和Nitrobacter 属相比较, 拥有一个高吸附性的NXA 酶能够使Nitrospira 属在亚硝酸盐浓度很低的海洋环境中较好的生存(Pachiadaki et al, 2017 )。
NOB 在全球海洋氮循环中发挥了重要作用。NOB 可以使亚硝酸盐停留在生态系统中, 有效降低了生态系统中氮的丢失, 对于贫营养海洋生态系统的氮素维持有着重要的作用。作为亚硝酸盐氧化的产物, 硝酸盐一方面可以为微生物及植物提供氮源, 另一方面也可以在低氧环境中为微生物呼吸产能提供硝酸盐电子受体。在海洋环境中, Nitrospinae 菌门是NOB 的主要群体。虽然Nitrospinae 菌门比AOA的丰度低, 但是却有高的生长率, 有一半以上的氮需求是由有机氮和氰酸盐供给的, 在深海的氮素循环平衡中发挥重要作用(Palatinszky et al, 2015; Kitzinger et al, 2019)。此外, 在海洋环境尤其是深海环境中, NOB 可能是固碳的优势种群。通过对来自太平洋、地中海、近北极的太平洋海域深海微生物样品的宏转录组和宏蛋白组分析, 发现在昏暗的大洋深部具有高丰度的Nitrospinae 菌门的NOB, 亚硝酸盐氧化是亚硝酸盐能量产生的主要途径, 产生的能量固定了北大西洋 15%到 45%的无机碳(Pachiadaki et al, 2017 )。张瑶等研究表明, NOB 对底物就有高的亲和力, 亚硝酸盐氧化是深海自养固碳的重要驱动力(Zhang et al, 2020)。
5 海洋亚硝酸盐氧化细菌的研究展望
亚硝酸盐氧化是海洋氮循环的重要环节, 对维持海洋生态系统的物质和能量循环有重要的功能。但由于亚硝酸盐氧化不是海洋硝化作用的限速步骤, 在很长的时间里没有受到充分的重视。但近年来, 在亚硝酸盐氧化的研究领域取得了很多突破性进展, 对于亚硝酸盐氧化的机制有了更深入的理解, 未来的研究可以注重以下几个方面:
1) NOB 的遗传多样性与亚硝酸盐氧化速率的分布和调节是否相关?分子生态学的方法能够使我们从基因水平了解参与硝化作用每个过程的微生物群体分布的多样性, 纯培养NOB 以及自然样品的亚硝酸盐氧化速率的测定将会更清晰的探索NOB 适宜的小生境, 是否遗传类型不同的NOB 在不同的生态环境中有不同的活性?微生物群体是以多大的时间尺度响应环境条件的改变?什么样的环境条件的改变最可能会影响环境的亚硝酸盐氧化速率呢?生物地球化学和分子生物学的综合方法将会解决这些问题。
2) 亚硝酸盐氧化速率测定的优化。虽然当前的一些直接测定硝化的方法以及地球化学的参数提供了一些关于亚硝酸盐氧化速率大小和分布的一些认识, 但是准确测定环境中的亚硝酸盐氧化速率的方法还需要进一步提高。微量的氮稳定同位素示踪剂添加不会改变培养体系中的底物浓度, 因此基于氮稳定同位素的方法是目前准确测定亚硝酸盐氧化速率的最佳选择。此外, 通过氮、氧天然稳定同位素组成也能实现亚硝酸盐氧化速率的测定。
3) 更多纯培养NOB 的分离和鉴定。目前, 已经分离鉴定了几株纯培养的NOB 菌株, 但是仍然需要更多的NOB 纯培养菌的分离和鉴定, 以便更深入的揭示不同种类NOB 的作用机制和生态功能。而且, 氨氧化古菌的发现为进一步研究亚硝酸盐氧化古菌(NOA)的存在提供了重要思考, NOA 的发现也是我们所期待的。
