高温对褐藻羊栖菜逆境生理的影响
2021-03-25刘丽杰林立东
刘丽杰 , 林立东
1. 齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006;
2. 温州市洞头区海洋与渔业发展研究中心, 浙江 温州 325700
羊栖菜(Sargassum fusiforme / Hizikia fusiformis)隶属于褐藻门, 墨角藻目, 马尾藻科马尾藻属/羊栖菜属, 是西北太平洋特有的多年生暖温带性海藻(曾呈奎 等, 2000)。羊栖菜广泛分布于中国、日本和朝鲜沿岸, 在海洋生态系统修复、食疗以及海藻工业方面具有很高的应用价值(孙建璋 等, 1996; Zou et al, 2005)。我国的羊栖菜主要分布在辽东半岛、山东、浙江、福建和广东等地沿海, 其中浙江沿海尤其是洞头生产的羊栖菜产量高、品质最好(曾呈奎 等, 2000; 张展 等, 2002)。
羊栖菜具有一定的温度适应性, 在4~25℃时可以正常生长, 最适温度生长为14~21.6℃ (孙圆圆 等, 2009)。在全球气候逐渐变暖的大背景下, 浙江地区每年秋季发生的高温回暖天气给羊栖菜栽培业的可持续发展带来了不可忽视的影响, 会造成羊栖菜大面积欠收, 给养殖业造成较大损失。目前关于温度对羊栖菜的生长、生理及代谢方面有一定的研究, 赵素芬等(2015)研究发现温度与光照强度会联合影响羊栖菜幼孢子体的生长率, 温度影响大于光照影响, 在21.5℃、66.04μmol·m–2·s–1条件下, 羊栖菜幼孢子体的体长和体宽增长率均达到最大值。当羊栖菜生长温度为22.9℃时, 总光合速率氧气生成达到最大值12.55μmol·m–2·s–2(Kokubu et al, 2015); 当温度高于30℃, 羊栖菜的光合速率会迅速下降, 并且高温会抑制有性生殖(Zou et al, 2018)。温度和盐度对羊栖菜的比增长率以及组织碳、氮质量分数具有显著影响, 温度20℃、盐度30‰时的比增长率达到最大值(6.04%·d–1); 温度10℃、盐度30‰时组织碳质量分数达到最大值(38.19%±1.01%); 温度15℃、盐度 10‰ 时组织氮质量分数达到最大值(2.78%±0.09%); 温度15℃、盐度20‰时叶绿素a和叶绿素 c 的质量分数均达到最大值(Li et al, 2019)。但关于高温(高于25℃)对羊栖菜生理代谢的影响报道较少, 因此本研究以羊栖菜为试验材料, 分别以常温培养(22℃)和高温胁迫(27℃和32℃)为对照组和试验组, 通过研究不同时间水平下(第0、1、3、5、7 天)羊栖菜的生理特征, 探讨高温影响羊栖菜生理代谢的机制, 以期为全面认识羊栖菜的抗逆性机理奠定基础。
1 材料与方法
1.1 试验材料
试验材料用5 月份浙江省温州市洞头区海洋与渔业发展研究中心博士后工作站培育的羊栖菜的成熟孢子体。
1.2 试验设计
从养殖区取回形态和株高均匀的羊栖菜样品, 去除杂质, 在自然海水中培养24h, 然后将试验材料放到三角烧瓶中, 烧瓶中放入海水, 培养密度为150g·L–1, 并通入空气, 在光照培养箱中不同温度(22℃为对照组, 27℃和32℃为高温胁迫组)下培养7d。试验期间每24h 更换一次海水, 试验时的环境因素见表1, 光照时间为(6:00—18:00)。在试验培养期间的第0、1、3、5、7 天收集羊栖菜气囊, 用蒸馏水洗净, 擦干, 液氮速冻, 放入–80℃冰箱备用, 每个培养3 个重复。
1.3 指标测定
相对电导率的测定采用电导法。具体步骤如下: 1) 用去离子水冲洗气囊, 将气囊分装到3 只洁净的称量瓶中, 每瓶10 个气囊。2) 向各瓶加10mL 去离子水, 置真空干燥箱中抽气10min, 当缓缓放入空气时, 水即渗入细胞间隙, 叶片变成半透明状, 沉入水下。3) 室温放置1h, 将各瓶充分摇匀, 用电导率仪测初始电导率值(γ1)。4) 将各瓶置沸水浴中10min, 杀死植物组织。取出称量瓶, 自来水冷却至室温, 室温下平衡 10min, 摇匀, 测终电导率值(γ2); 5) 结果计算: 相对电导率(γ)=γ1×γ2–1(苍晶 等, 2013)。

表1 试验期间的环境条件 Tab. 1 The environment factors during experiments
丙二醛(Malondialdehyde, MDA)质量摩尔浓度测定采用硫代巴比妥酸(Thiobarbituric acid, TBA)比色法。具体步骤如下: 1) 样品提取: 称取羊栖菜气囊1g 放入研钵, 加10%三氯乙酸(Trichloroacetic acid, TCA) 2mL 和少量石英砂, 研磨至匀浆, 再加8mL 10% TCA 进一步研磨, 匀浆于4000r·min–1离心10min, 上清液为样品提取液。2) 显色反应和测定: 吸取上清液2mL (对照加2mL 蒸馏水), 加入2mL 0.6% TBA 溶液, 混匀, 沸水浴中反应15min, 迅速冷却后离心。取上清液在紫外可见光分光光度计上测定450nm、532nm、600nm 的吸光值。3) 结果计算: MDA 质量摩尔浓度(单位: μmol·g–1)=[6.45×(OD532- OD600) -0.56×OD450]×V×m–1。式中: V 为提取液体积(单位: mL); m 为羊栖菜气囊鲜质量(单位: g); OD532表示在532nm 的吸光值; OD600表示在600nm 的吸光值; OD450表示在450nm 的吸光值(李合生, 2000)。
可溶性蛋白质量分数测定参考考马斯亮蓝G250 染色法进行。具体步骤如下: 1) 绘制标准曲线: 以系列不同质量浓度(1~50μg·mL–1)的标准牛血清蛋白溶液2mL, 分别加入染料试剂2mL, 立即混匀, 用分光光度计测定其620nm 的吸光值, 以蒸馏水2mL 加染料试剂2mL 作为比色空白对照。根据测定结果, 绘制出吸光值-蛋白质质量浓度标准曲线。2) 样品提取: 称取气囊样品2g 放入研钵, 加2mL 蒸馏水研成匀浆, 转移到离心管中, 然后用6mL 蒸馏水分次洗涤研钵, 洗涤液全部转移至离心管, 放置1h以充分提取, 然后4000r·min–1离心20min, 弃沉淀, 上清液转入容量瓶, 以蒸馏水定容至10mL, 混匀后待测。3) 比色测定: 用同一标准曲线和同样的方法, 测定样品溶液在620nm 处吸光值, 然后从标准曲线查得蛋白质质量浓度, 并计算出样品中的蛋白质的质量分数(张志良 等, 2015)。
可溶性糖质量分数测定主要参考张治安等(2008)的蒽酮比色法进行测定。具体步骤如下: 1) 可溶性糖的提取: 将气囊在110℃烘箱烘15min, 然后调至70℃过夜。干样磨碎后称取50mg 样品, 倒入10mL 刻度离心管内, 加入4mL 80%乙醇重复提取2次, 合并上清液。在上清液中加10mg 活性炭, 80℃脱色30min, 80%乙醇定容至10mL, 过滤后取滤液测定。2) 绘制标准曲线: 取20mL 带塞试管, 编号, 加入不同浓度的葡萄糖标准液(葡萄糖质量分别为0、10、20、40、60、80、100μg), 然后在每只试管中加入5mL 蒽酮试剂, 混匀, 盖上盖子, 在沸水浴中煮沸 10min, 取出, 立即用水冷却至室温, 在625nm 波长下, 分别测量各管的吸光值, 用0 号管调零。以吸光值为纵坐标, 葡萄糖含量为横坐标, 绘制标准曲线。3) 测定: 吸取上述糖提取液1mL, 加入 5mL 蒽酮试剂混合, 用上述同样的方法, 在625nm 处测得吸光值, 以0 号管调零。由标准曲线查得提取液中糖含量, 然后根据每mL 提取液含有5mg 干样品中的糖, 再计算样品中糖的质量分数。
脯氨酸质量分数的测定采用茚三酮法进行。具体步骤如下: 1) 制作标准曲线: 用100μg·mL–1脯氨酸配制成0、1、2、3、4、5、6、7、8、9、10μg·mL–1的标准溶液。取标准溶液各2mL, 加2mL 3%磺基水杨酸、2mL 冰醋酸和4mL 2.5%酸性茚三酮试剂于具塞试管中, 置沸水浴中显色1h, 冷却后加入4mL 甲苯, 盖好盖子于漩涡混合仪上震荡0.5min, 静置分层, 吸取红色甲苯相, 于波长520nm 处测定吸光值, 以吸光值为纵坐标, 脯氨酸质量浓度(单位: μg·mL–1)为横坐标绘制标准曲线。2) 样品提取: 称取羊栖菜气囊0.5g 放入研钵, 加 3%磺基水杨酸溶液5mL, 研磨成匀浆, 转入离心管, 沸水浴浸提10min, 冷却后以3000r·min–1离心10min, 取上清液待测。3) 测定: 吸取上清液2mL, 加2mL 冰醋酸和4mL 2.5%酸性茚三酮试剂, 然后按照标准曲线制作方法进行甲苯萃取和比色。4) 结果计算: 脯氨酸质量分数(单位: μg·g–1) = mp×V×(Va×m)–1。式中: mp为由标准曲线求得提取液中脯氨酸质量(单位: μg); V 为提取液总体积(单位: mL); Va为测定时所吸取的体积(单位: mL); m 为羊栖菜气囊鲜质量(单位: g)(李合生, 2000)。
超氧化物歧化酶(Superoxide, SOD)比活性测定参考Spycbaha J P 的方法(Spychalla, 1990)。具体步骤如下: 1) 粗酶液提取: 取气囊样品5g, 加入5 倍样品量的酶提取液, 冰浴中研磨后以纱布过滤, 经9075r·min–1离心20min, 上清液即为粗酶提取液。2) 酶活性测定: 测定前在54mL 14.5mmol·L–1甲硫氨酸中分别加入乙二胺四乙酸(EDTA)、氮蓝四唑(NBT)、核黄素溶液各2mL, 混匀, 此为反应混合液。在盛有3mL 反应混合液的试管中, 加入适量的粗酶液, 混匀后放在透明试管架上, 于光照培养箱中准确照光10min, 迅速测定在560nm 的吸光值, 以不加酶液的照光管为对照, 计算反应被抑制的百分比。3) 酶活性计算: 以能抑制反应50%的酶量为一个SOD 酶单位。SOD 比活性(单位: U·mg–1) = (对照管OD 值-测定管OD 值)/50%加入粗酶液中的蛋白质质量(单位: mg)。
过氧化物酶(Peroxidase, POD)比活性测定采用愈创木酚法。具体步骤如下: 1) 称取羊栖菜气囊1.0g 放入研钵, 加适量磷酸缓冲盐溶液(PBS)研成匀浆。匀浆液全部转入离心管, 4℃、4000r·min–1离心10min, 上清液转入25mL 容量瓶, 沉淀用5mL PBS再提取2 次, 上清液并入容量瓶, 定容至刻度, 低温下保存备用。2) 酶活性测定反应体系: 2.9mL 0.05mol·L–1PBS, 1mL 2% H2O2, 1mL 0.05mol·L–1愈创木酚和0.1mL 酶液。用加热煮沸5min 的酶液作为对照。反应体系加入酶液后, 立即于37℃水浴中保温15min, 然后迅速转入水浴, 并加入2mL 20% 三氯乙酸(TCA)终止反应, 过滤, 适当稀释, 在紫外可见光分光光度计470nm 波长下测定吸光值。3) 结果计算: 以1min 内吸光值在470nm 处变化0.01 的酶量(△470)为一个酶活单位。POD 的比活性(单位: U·g–1·min–1) = △470×V×(m×Va×t)–1。式中: m 为气囊鲜质重(单位: g); t 表示反应时间(单位: min); V 为提取酶液总体积(单位: mL); Va为测定时取用酶液体积(单位: mL)(苍晶 等, 2013)。
过氧化氢酶(Atalase, CAT)比活性的测定参考过氧化氢还原法(Aebi, 1984)。具体步骤如下: 1) 酶液提取: 取气囊0.5g 放入研钵, 加2~3mL 4℃预冷的PBS 和少量石英砂研磨成匀浆, 转入25mL 容量瓶, 用PBS 冲洗研钵数次, 合并冲洗液, 定容至刻度。混合均匀后置5℃下保存备用。取10mL 试管3 支, 其中2 支为样品测定管, 1 支为空白管, 对照管依次加入粗酶液(煮沸) 0.2mL, PBS (pH 7.8) 1.5mL, 蒸馏水1.0mL。2) 酶活性测定: 25℃预热后, 逐管加入0.3mL 0.1mol·L–1H2O2, 每加完1 管立即计时, 并迅速倒入石英比色杯中, 测定其240nm 的吸光值, 每隔1min 读数1 次, 共测4min。3) 结果计算: 以1min内吸光值在240nm 处减少0.1 的酶量(△240)为一个酶活单位。CAT 比活性(单位: U·g–1·min–1) = △240×V×(0.1×Va×t×m)–1, 式中: V 为粗酶液提取总体积(单位: mL); Va为测定用粗酶液体积(单位: mL); m 为气囊鲜重(单位: g); t 为从加入H2O2到读数的时间(单位: min)。
1.4 数据分析
采用SPSS 软件21.0 对数据进行统计分析, 包括采用One-way ANOVA 进行单因素方差分析以及采用Duncan’s 法对平均值进行多重比较。
2 结果
2.1 高温胁迫对羊栖菜气囊细胞膜损伤的影响
质膜透性常可作为逆境伤害的一个生理指标。当质膜的选择透性被破坏时细胞内电解质外渗, 表现为电导率增加。如图1 所示, 高温胁迫使羊栖菜气囊的电导率显著增加(p<0.05), 并且32℃培养比27℃培养增加的幅度更大。在27℃培养时, 培养1、3、5、7d 时, 与对照组相比, 电导率分别增加了30.9%、56.3%、77.7%和97.7%; 在32℃培养时, 培养1、3、5、7d 时, 电导率分别增加了38.3%、93.6%、107%和167.5%。
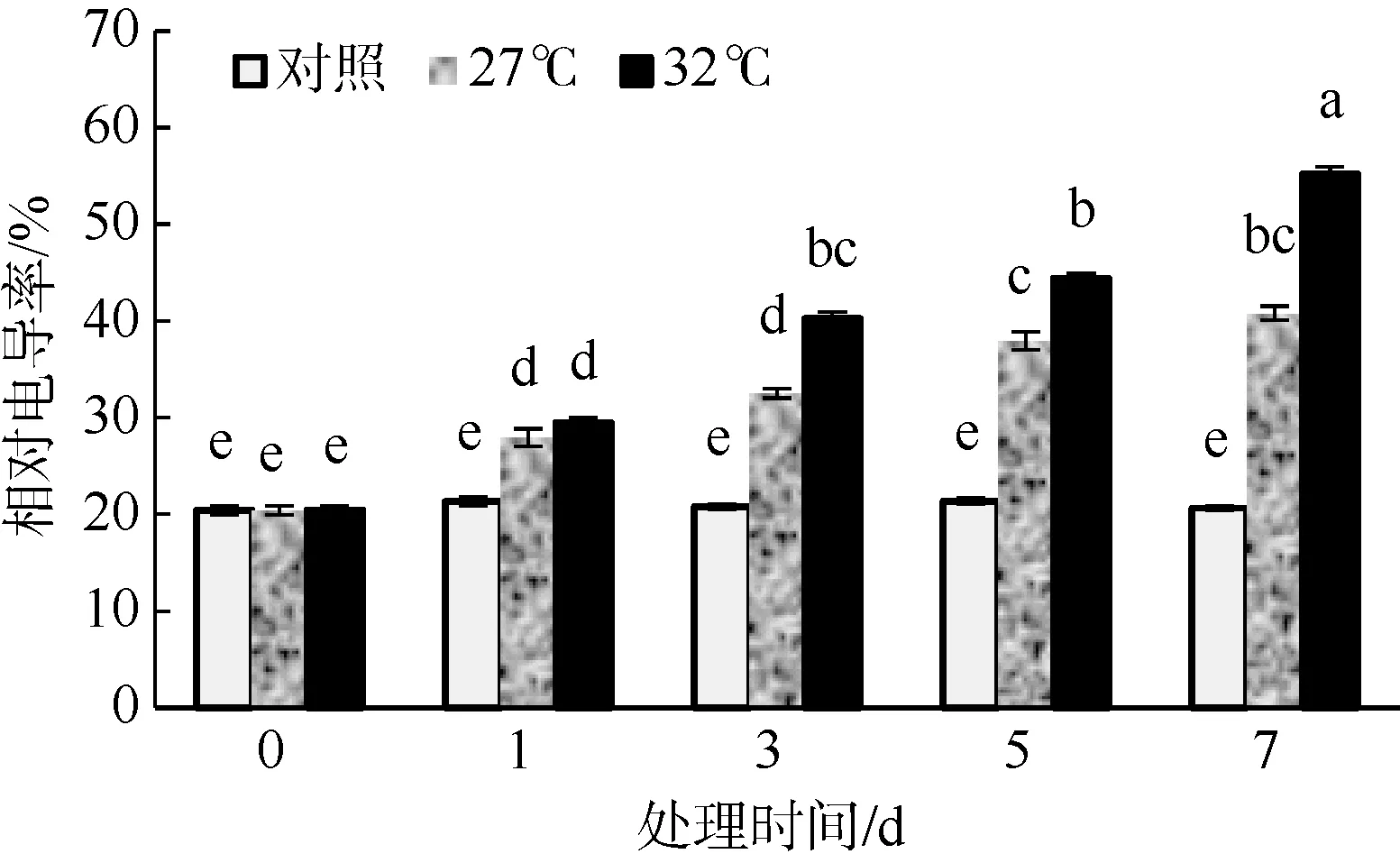
图1 高温环境对羊栖菜气囊相对电导率的影响 图中不同字母代表差异显著 Fig. 1 Effects of high temperature on the relative electrical conductivity of Sargassum fusiforme
在逆境条件下, 植物细胞经常会发生不同程度的膜脂过氧化, 丙二醛(MDA)是膜脂过氧化的分解产物。高温培养的羊栖菜气囊中MDA 质量摩尔浓度呈现先升高后降低趋势(图2), 在培养的前5d, MDA 质量摩尔浓度始终高于对照, 第7 天时则低于对照组。在培养的前5d, 32℃组高于27℃组, 在第5天时, 27℃组和32℃组都显著高于对照组(p<0.05), 分别比对照组增加了20.2%和24.8%, 在第7 天时, 27℃组和32℃组都显著低于对照组(p<0.05), 分别比对照组减少了48.6%和40.2%。
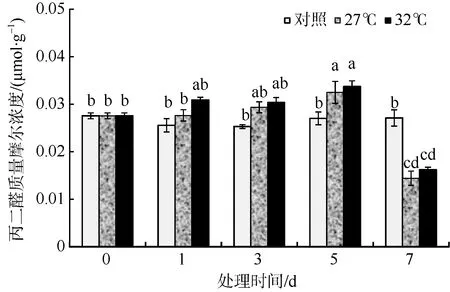
图2 高温环境对羊栖菜气囊中丙二醛(MDA)质量摩尔浓度的影响 图中不同字母代表差异显著 Fig. 2 Effects of high temperature on MDA content of Sargassum fusiforme
2.2 高温胁迫对羊栖菜渗透调节物质的影响
可溶性蛋白是重要的渗透调节物质和营养物质, 其增加和积累能提高细胞的保水能力, 对细胞的生命物质及生物膜起到保护作用。羊栖菜气囊在高温胁迫下的可溶性蛋白质量分数变化如图3 所示。随着培养时间的增加, 27℃组和32℃组可溶性蛋白质量分数增加, 始终高于对照组, 并且32℃组高于27℃组, 在培养第3 天时27℃组和32℃组可溶性蛋白质量分数与对照相比差异显著(p<0.05), 在培养3、5 和7d 后, 27℃组蛋白质质量分数比对照组分别增加了36.7%、32.7%和37.4%, 32℃组蛋白质质量分数比对照组分别增加了40.6%、35.8%和57.8%。
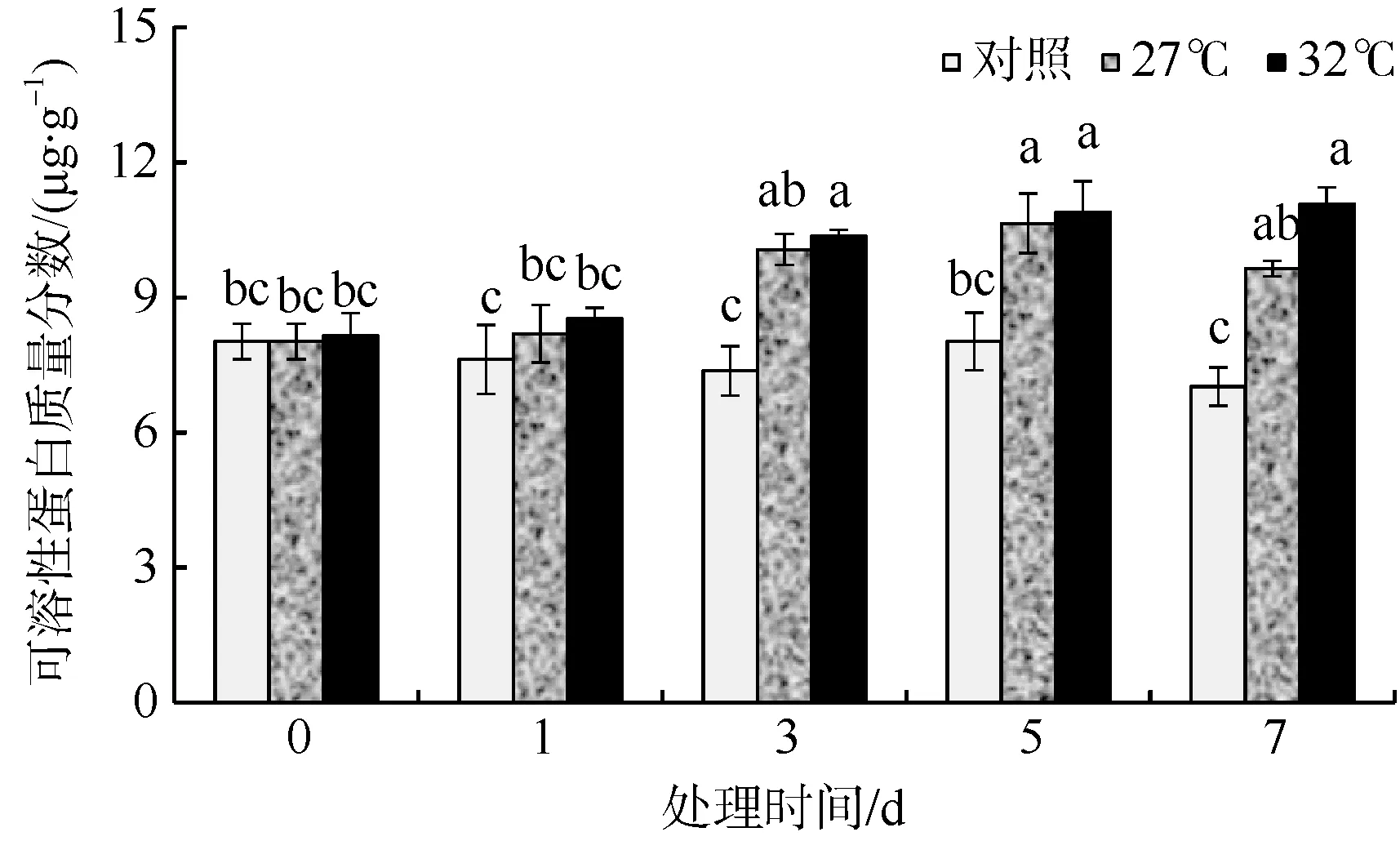
图3 高温环境对羊栖菜气囊中可溶性蛋白质量分数的影响 图中不同字母代表差异显著 Fig. 3 Effects of high temperature on soluble protein content of Sargassum fusiforme
可溶性糖不仅能提供能量而且具有信号功能, 并且参与渗透调节, 因此在羊栖菜的生命活动中极为重要。在本研究中高温胁迫组羊栖菜气囊的可溶性糖质量分数均高于对照组, 且27℃组可溶性糖质量分数高于32℃组。27℃培养羊栖菜至第3 天和第5 天时气囊中可溶性糖质量分数显著高于对照组(p<0.05), 分别比对照组增加了73.0%和34.1%; 而32℃组仅在第3 天时可溶性糖质量分数显著高于对照组, 比对照增加了34.1% (p<0.05)。从图4 可以看出, 随着高温胁迫时间的增加, 可溶性糖含量先增加后减少。
脯氨酸是植物蛋白质的组分之一, 作为植物细胞质内渗透调节物质, 当植物受到逆境胁迫时会积累脯氨酸。在本研究中, 随着高温胁迫时间的增加, 羊栖菜气囊中脯氨酸质量分数呈现先上升后下降的趋势(图5)。27℃和32℃高温胁迫都可以使脯氨酸质量分数显著增加, 且32℃高温胁迫使脯氨酸质量分数增加得更多, 在高温胁迫的第1、3、5、7 天, 27℃组脯氨酸质量分数分别增加了12.5%、40.6%、44.6%、20.1%, 32℃组脯氨酸质量分数与对照组相比分别增加了18.8%、51.7%、63.7%、39.3%。
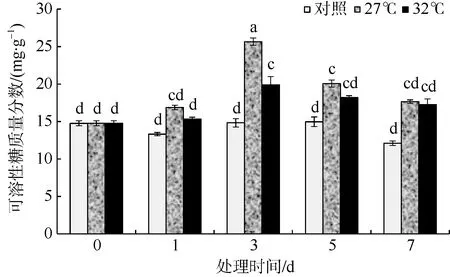
图4 高温环境对羊栖菜气囊中可溶性糖质量分数的影响 图中不同字母代表差异显著 Fig. 4 Effects of high temperature on soluble sugar content of Sargassum fusiforme

图5 高温环境对羊栖菜气囊中脯氨酸质量分数的影响 图中不同字母代表差异显著 Fig. 5 Effects of high temperature on proline content of Sargassum fusiforme
2.3 高温胁迫对羊栖菜气囊抗氧化酶的影响
超氧化物歧化酶(SOD)是生物体系中抗氧化酶系的重要组成成员, 是生物体内存在的一种抗氧化金属酶。随着高温胁迫时间的增加, 羊栖菜气囊的SOD 比活性逐渐增强。27℃和32℃组SOD 比活性均高于对照组, 并且32℃组SOD 比活性最强。培养3d 以后27℃和32℃组均显著高于对照组(p<0.05)。在高温胁迫的第3、5、7 天, 27℃组SOD 比活性分别增加了73.3%、35.4%、92.2%, 32℃组SOD 比活性分别增加了79.1%、47.9%、132.1% (图6)。
过氧化物酶(POD)是由植物所产生的一类氧化 还原酶, 能催化很多反应。随着高温胁迫时间的增加羊栖菜气囊中POD 比活性先降低后升高, 培养至第3 天时达到最低值。在高温胁迫的前5d 高温培养组的POD 比活性均低于对照组, 并且32℃组低于27℃组。到胁迫第7 天时27℃组和32℃组POD 比活性均高于对照组, 但差异不显著。27℃组在高温培养的第1、3、5 天时POD 比活性与对照组相比显著降低(p<0.05), 分别降低了32.3%、50.6%、24.1%, 32℃组在高温培养的第1、3、5 天时POD 比活性与对照组相比也显著降低(p<0.05), 分别降低了37.2%、54.6%、44.4% (图7)。
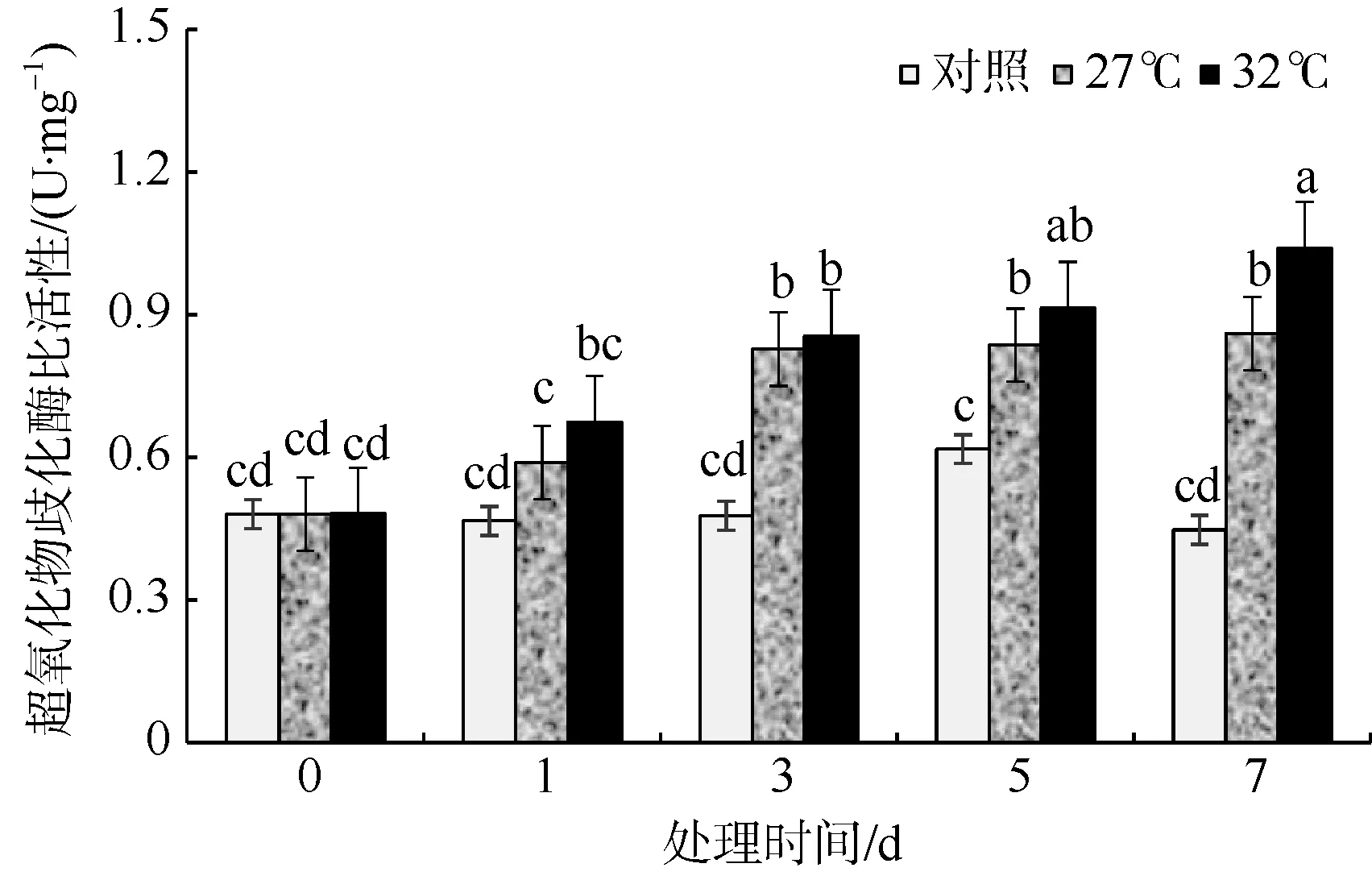
图6 高温环境对羊栖菜气囊中超氧化物歧化酶比活性的影响 图中不同字母代表差异显著 Fig. 6 Effects of high temperature on SOD activity of Sargassum fusiforme
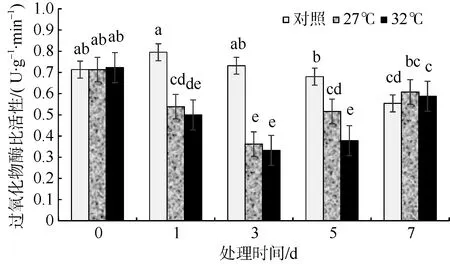
图7 高温环境对羊栖菜气囊中过氧化物酶比活性的影响 图中不同字母代表差异显著 Fig. 7 Effects of high temperature on POD activity of Sargassum fusiforme
过氧化氢酶(CAT)是催化过氧化氢分解成氧和水的酶, 存在于细胞的过氧化物体内。在高温胁迫组和对照组羊栖菜气囊中CAT 活性均呈现先上升后下降的趋势, 在第1 天时达到峰值。27℃培养至第1天和第3 天时CAT 比活性显著高于对照组, 分别增加了25.3%和20.4%, 在第5 天和第7 天时低于对照组, 并且在第7 天时差异达到显著水平(p<0.05), 比对照组减少了23.7%; 而32℃组仅在培养第1 天时CAT 比活性高于对照组, 但差异不显著; 培养后期CAT 比活性均低于对照组, 且在处第5 天和第7 天时差异显著(p<0.05), 分别降低了 29.5%和 16.9% (图8)。

图8 高温环境对羊栖菜气囊中过氧化氢酶比活性的影响 图中不同字母代表差异显著 Fig. 8 Effects of high temperature on CAT activity of Sargassum fusiforme
3 讨论
正常情况下植物体内各项生理代谢过程都是比较稳定而协调的。当植物遇到逆境胁迫时, 其体内的各种代谢活动会受到影响而失调, 使植物对逆境作出反应(赵昕 等, 2001)。当植物受到高温胁迫后, 细胞膜系统会受到一定的损伤, 使膜的孔隙变大, 造成细胞内的离子外渗, 最终导致细胞的相对电导率增加(禄鑫, 2012)。羊栖菜的正常生长温度为4~25℃, 在本研究中, 27℃和32℃高温培养使羊栖菜气囊的电导率显著增加, 并且32℃培养显著高于27℃培养, 说明高温胁迫使羊栖菜气囊的膜系统受到了伤害, 导致其体内的离子外渗, 并且温度越高, 伤害越大, 离子外渗越多。MDA 是细胞膜脂过氧化程度的体现, MDA 质量摩尔浓度的多少可以反应逆境下植物受伤害的程度, MDA 的质量摩尔浓度越高, 表明植物细胞膜受到的伤害越严重(Tartoura et al, 2011)。有研究表明, 植物受到高温胁迫时, MDA 质量摩尔浓度随温度升高而增加(Liu et al, 2000; Xu et al, 2006)。本研究中, 高温培养前5d, MDA 质量摩尔浓度高于对照, 在胁迫的第5 天达到最高值, 显著高于对照, 与前人的研究结果基本一致, 并且32℃培养高于27℃培养, 表明此时羊栖菜气囊的细胞膜脂已经发生了过氧化, 膜系统受到了损伤; 但到了胁迫第7 天时, 高温培养组却显著低于对照, 推测可能在高温胁迫培养7d 时, 羊栖菜已经达到了生存的极限, 其体内代谢已经紊乱, 并且部分藻体已经死亡, 也可能是试验时存在一定的误差, 最终导致MDA 质量摩尔浓度下降。
高温胁迫下植物细胞内会积累一些渗透调节物质来维持细胞膨压对一些生理功能的调控(Bajguz, 2000), 这些渗透调节物质含量的高低可以反映植物对逆境胁迫的适应程度。本研究发现, 高温促进了可溶性蛋白的积累, 温度越高, 培养时间越长, 积累的可溶性蛋白越多, 这与赵勇竣等(2019)的研究结果一致, 他们发现番茄在高温胁迫时可溶性蛋白积累增加。但也有学者发现马尾藻和龙须菜在高温胁迫后可溶性蛋白质量分数下降(贺亮, 2017; 付峰 等, 2017), 可见不同植物在高温逆境下积累的渗透调节物质并不一致, 推测可溶性蛋白可能起到了渗透调节和防止细胞质过度脱水的作用(杨华庚 等, 2011)。高温也使羊栖菜气囊的脯氨酸和可溶性糖的质量分数增加, 温度越高, 脯氨酸和可溶性糖质量分数越高, 可溶性糖含量在高温胁迫培养第3 天达到峰值, 脯氨酸在高温胁迫第5 天达到峰值, 这与番茄在高温胁迫后可溶性糖质量分数先升高后降低的趋势一致(赵勇竣 等, 2019), 与龙须菜在高温胁迫时脯氨酸质量分数先升高后降低的趋势一致(孙雪 等, 2013)。说明脯氨酸能提高原生质的亲水性, 有利于保护细胞; 可溶性糖是植物在逆境条件下不可缺少的能量储存, 同时也是渗透调节物质, 可以减少逆境胁迫对植物造成的伤害(赵勇竣 等, 2019)。到高温胁迫第5 天后由于羊栖菜藻体部分死亡, 所以可溶性糖和脯氨酸的质量分数均下降。
当植物遭受高温胁迫时, 细胞内活性氧大量积累, 使其代谢失衡, 最终造成细胞膜系统发生严重的氧化损伤(Mallick et al, 2000; Gill et al, 2010)。高温胁迫会使植物体内抗氧化防御系统活性增强, 从而防止细胞内过量积累的活性氧对植物造成的氧化伤害。SOD 能将超氧阴离子自由基转化为过氧化氢, 成为植物细胞的第一道抗氧化防线。在本研究中, 高温培养后SOD 活性增加; 温度越高, 培养时间越长, SOD 活性越高, 说明羊栖菜气囊在受到高温胁迫时, 能将过多的超氧阴离子自由基转化为H2O2, 通过抗氧化酶SOD 活性增强来降低高温胁迫对羊栖菜带来的伤害。POD 和 CAT 能够将过氧化氢(H2O2)分解, 从而缓解由于活性氧积累对细胞带来的伤害, 但在本研究中POD 活性在高温胁迫时并没有显著增加, 说明没有更多的POD 参与到H2O2分解, 而CAT 活性也仅在27℃培养前3d 时高于对照, 说明温度过高时, 超过羊栖菜所能承受的极限时, CAT 活性也因活性中心被破坏而下降。研究者可通过高温胁迫下抗氧化酶活性来判断植物的耐热性强弱, 不同植物的抗氧化酶活性在高温逆境时变化趋势并不相同(王凯红 等, 2011; 朱静 等, 2012), 耐热强的植物其抗氧化酶活性都明显升高(李荣华 等, 2012)。
4 结论
羊栖菜对温度的变化比较敏感, 特别是高温对羊栖菜气囊的生理代谢影响更大。高温胁迫导致羊栖菜气囊的膜系统受到了损伤, 造成了体内的离子外渗, 细胞膜脂发生了过氧化现象; 细胞内积累了可溶性蛋白、可溶性糖和脯氨酸等渗透调节物质; 并且通过抗氧化酶SOD 比活性增强来降低高温胁迫对羊栖菜带来的伤害。温度越高, 处理时间越长, 羊栖菜受到的伤害越大。
