OPAHs对斑马鱼胚胎的急性毒性预测
2021-03-25金玲敏徐童乔显亮
金玲敏,徐童,乔显亮
大连理工大学环境学院,工业生态与环境工程教育部重点实验室,大连 116024
含氧多环芳烃(oxygenated polycyclic aromatic hydrocarbon, OPAHs)是由化石燃料不完全燃烧,或多环芳烃(polycyclic aromatic hydrocarbon, PAHs)化学氧化、光化学氧化或生物氧化形成的一类新污染物[1-3]。OPAHs表现出致癌性、致突变性和发育毒性等毒性[4-7]。一些OPAHs产生的毒性效应比母体化合物更强。例如,Mattsson等[7]通过人肝癌细胞实验,发现一些OPAHs对DNA的损伤显著强于PAHs。Chibwe等[8]的研究表明,PAHs污染土壤经好氧生物修复后致突变性增强,认为与OPAHs等转化产物的生成有关。迄今,越来越多OPAHs在环境中被检出[9],但是很多OPAHs的毒性数据仍然缺失。
采用实验方法获取OPAHs的毒性数据需要消耗大量的人力、经费和时间。为了减少动物实验和高效地获取毒性数据,计算模拟方法被越来越多地用于化学品的毒性预测。其中,定量构效关系(QSAR)方法可以通过揭示有机化合物分子结构和毒性之间联系,已经被成功用于多种有机污染物(如PAHs、呋喃、二噁英以及多氯联苯等)的毒性预测[10-12]。目前,关于OPAHs急性毒性的预测模型还鲜有报道。
本研究参照经济合作与发展组织(OECD)关于QSAR模型构建和评估的导则[13],基于Knecht等[4]通过斑马鱼胚胎急性毒性实验得到的32种OPAHs的毒性数据(logEC50)(表1),采用多元线性逐步回归法筛选OPAHs的描述符,建立OPAHs斑马鱼胚胎急性毒性的QSAR模型,验证其预测能力,表征了模型的应用域,为OPAHs的生态风险评估提供数据支持。
1 材料与方法(Materials and methods)
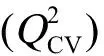
2 结果(Results)
2.1 模型的建立
本研究分别采用Dragon描述符、量子化学描述符以及综合以上2类描述符建立了3个QSAR模型(表2)。基于2 629种OPAHs Dragon描述符,采用多元线性逐步回归法筛选出模型(1)的R2为0.524,表明模型的拟合优度不高。使用多元线性逐步回归法筛选量子化学描述符和logKow,建立了模型(2)的R2为0.436,模型的拟合优度也不高。本研究综合了量子化学描述符和Dragon描述符,得到模型(3),统计学参数表明,模型(3)的拟合优度较好,筛选出4种描述符包括化学势(μ)、最大电拓扑参数(MAXDP)、Moriguchi正辛醇-水分配系数(MLOGP)和芳香性指数(AROM),说明量子化学描述符和Dragon描述符可以从不同的角度表征OPAHs的分子属性,更有利于揭示分子结构与其毒性的关联。由于模型(1)和(2)不能满足预测的参数要求,下文重点对模型(3)进行了详细讨论。OPAHs的斑马鱼胚胎急性毒性实验数据(logEC50)和最优模型的预测数据以及筛选出4种描述符的具体数值分别如表1和表2所示。
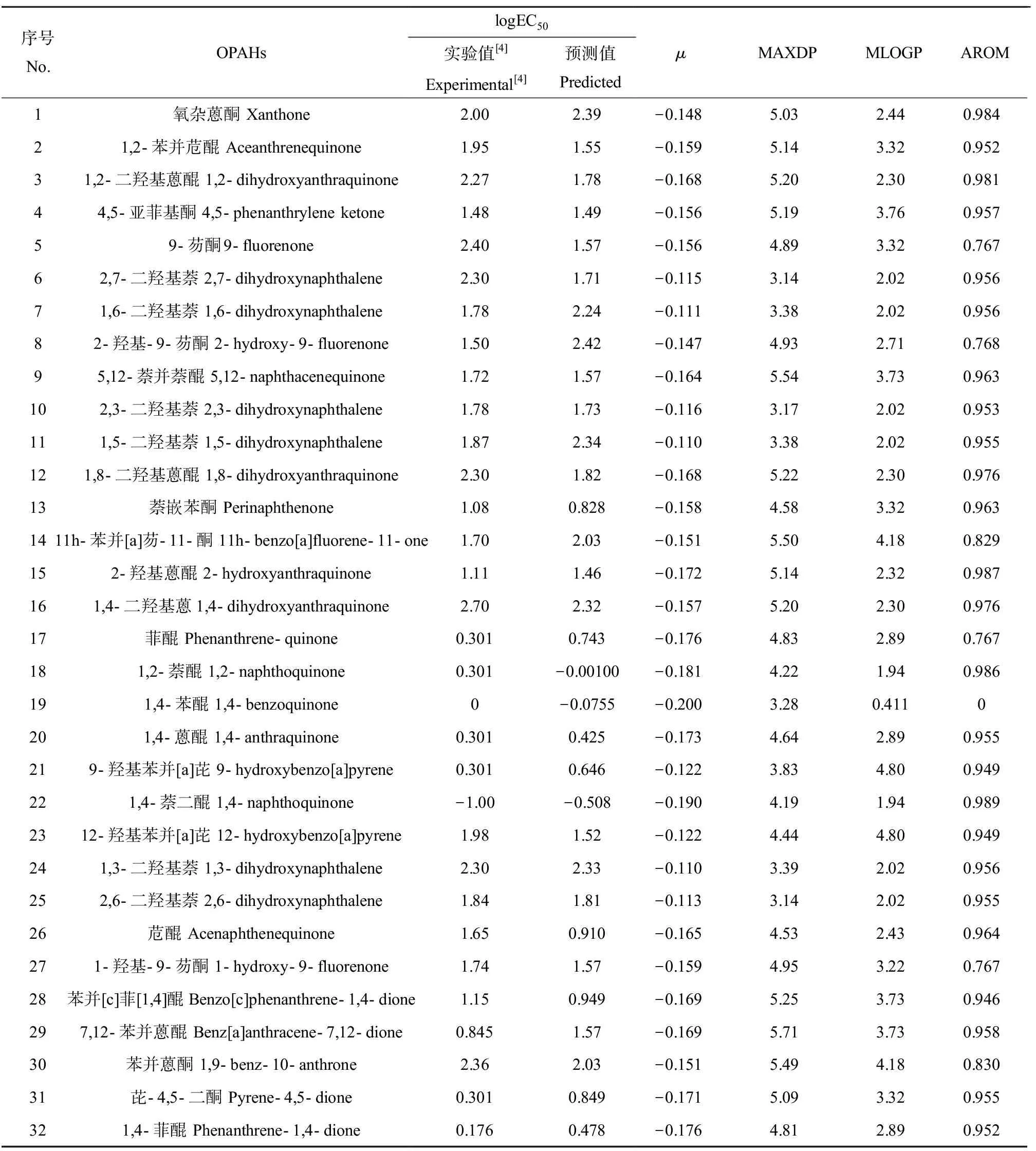
表1 OPAHs的logEC50实验值与预测值及模型筛选出的分子描述符计算值Table 1 The experimental and predicted values of logEC50 for OPAHs and molecular descriptors values
2.2 模型的解释
模型(3)的4个描述符中,μ与logEC50的相关性最高,相关系数为0.554。μ可以表征分子失电子的能力,μ值越小,分子越不稳定,容易失去电子[22-23]。OPAHs是一类含氧的PAHs衍生物,含氧基团的存在使得电子密度发生显著的变化(图1),也会影响其得失电子的能力[24]。OPAHs的μ与logEC50呈正相关,说明OPAHs越不稳定,其斑马鱼胚胎急性毒性越大。MAXDP、MLOGP和AROM都为拓扑描述符。MAXDP可以表征分子的亲电性[25],OPAHs的亲电性越强,其毒性越强。MLOGP表征分子的疏水性[20],MLOGP与logEC50表现出负相关,说明OPAHs疏水性越强毒性也越强。AROM表征了分子的芳香性,其值越大表明OPAHs共轭结构越稳定,其毒性越小[26]。综上所述,OPAHs的得失电子能力和疏水性是影响其毒性的主要因素。

表2 OPAHs的logEC50 QSAR模型参数Table 2 Parameters of QSAR models for OPAHs logEC50 values
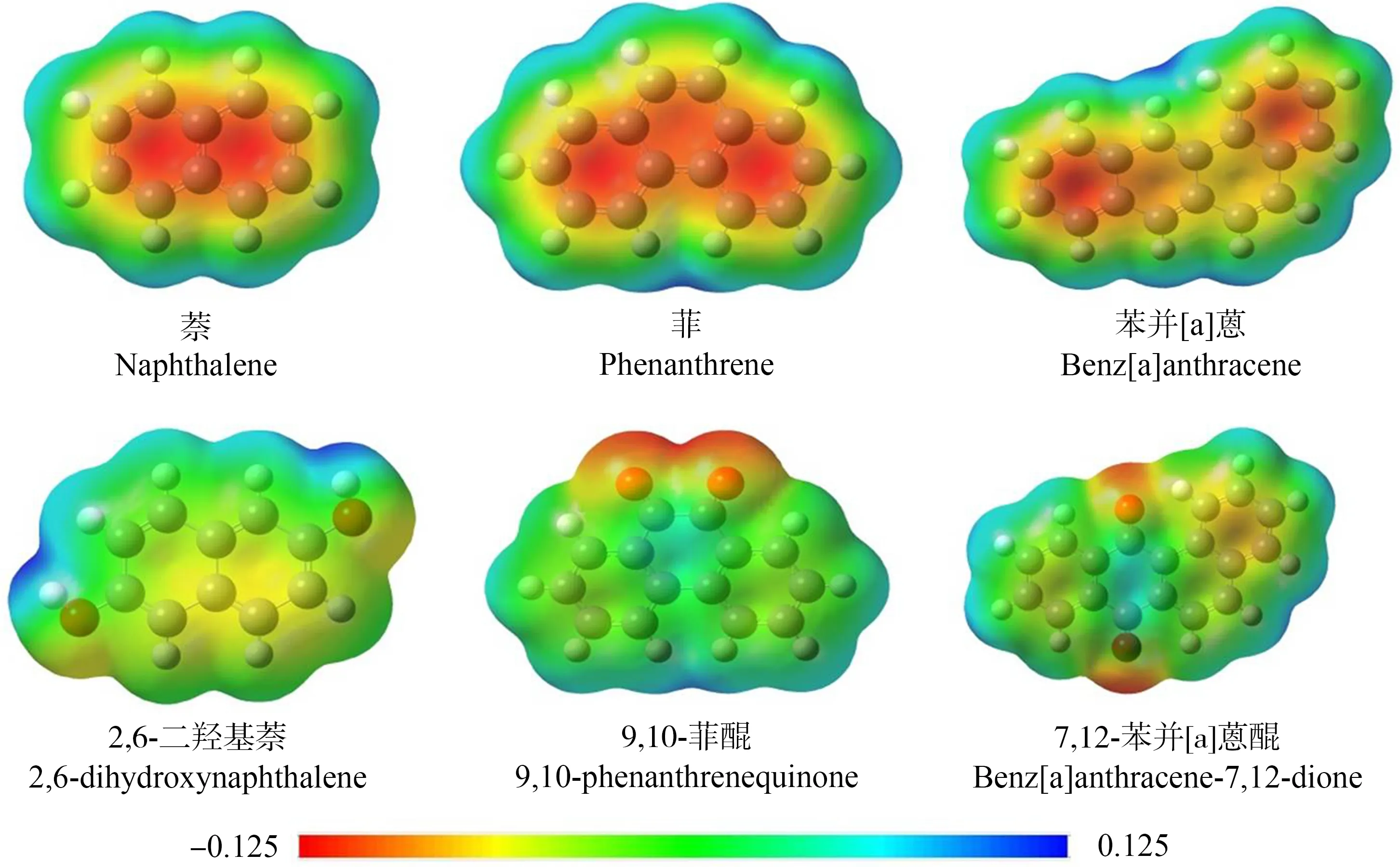
图1 含氧多环芳烃(OPAHs)特征化合物的电子密度图Fig. 1 The electron density maps of typical oxygenated polycyclic aromatic hydrocarbon (OPAHs)
2.3 模型的验证
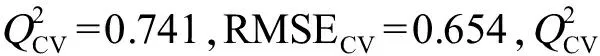
3 讨论(Discussion)
前人开展的QSAR模型研究也表明,PAHs及其衍生物的毒性与其得失电子能力和疏水性有关。Li等[27]建立了24种羟基PAHs与DNA损伤的QSAR模型(R2=0.751),发现羟基PAHs与DNA的静电相互作用影响二者的结合能力;分子对接分析表明氢键、π-π作用会显著影响羟基PAHs与DNA的结合能力。本文所研究的化合物中除了羟基PAHs也存在酮羰基PAHs,化合物的毒性除了与分子的得失电子能力有关,还与分子的疏水性存在一定关联。Gbeddy等[28]建立了30种PAHs及其衍生物致癌性毒性当量因子的QSAR模型(R2=0.720),发现分子量越大、疏水性越强,其毒性越强。Chlebowski等[29]通过分子对接研究硝基取代和杂环结构的PAHs发育毒性,表明疏水性更强的化合物,如7-硝基苯[k]荧蒽和二硝基芘,发育毒性更强。这与本研究模型(3)筛选出的表征疏水性的MLOGP值与斑马鱼胚胎急性毒性呈正相关的结果一致。
综上所述,本研究采用B3LYP/6-31G(d,p)方法优化OPAHs分子结构,计算了量子化学描述符和Dragon描述符,使用多元线性逐步回归法建立了斑马鱼胚胎logEC50的QSAR模型,发现OPAHs的得失电子能力和疏水性是影响OPAHs斑马鱼胚胎急性毒性的重要原因。所建立最优模型的R2为0.781,内部验证和外部验证说明该模型具有较好的稳健性和预测能力。采用Williams图表征了模型的应用域,表明模型具有良好的适应性和延展性,通过模型预测的斑马鱼胚胎急性毒性可以为OPAHs的生态风险评价提供毒性数据支持。
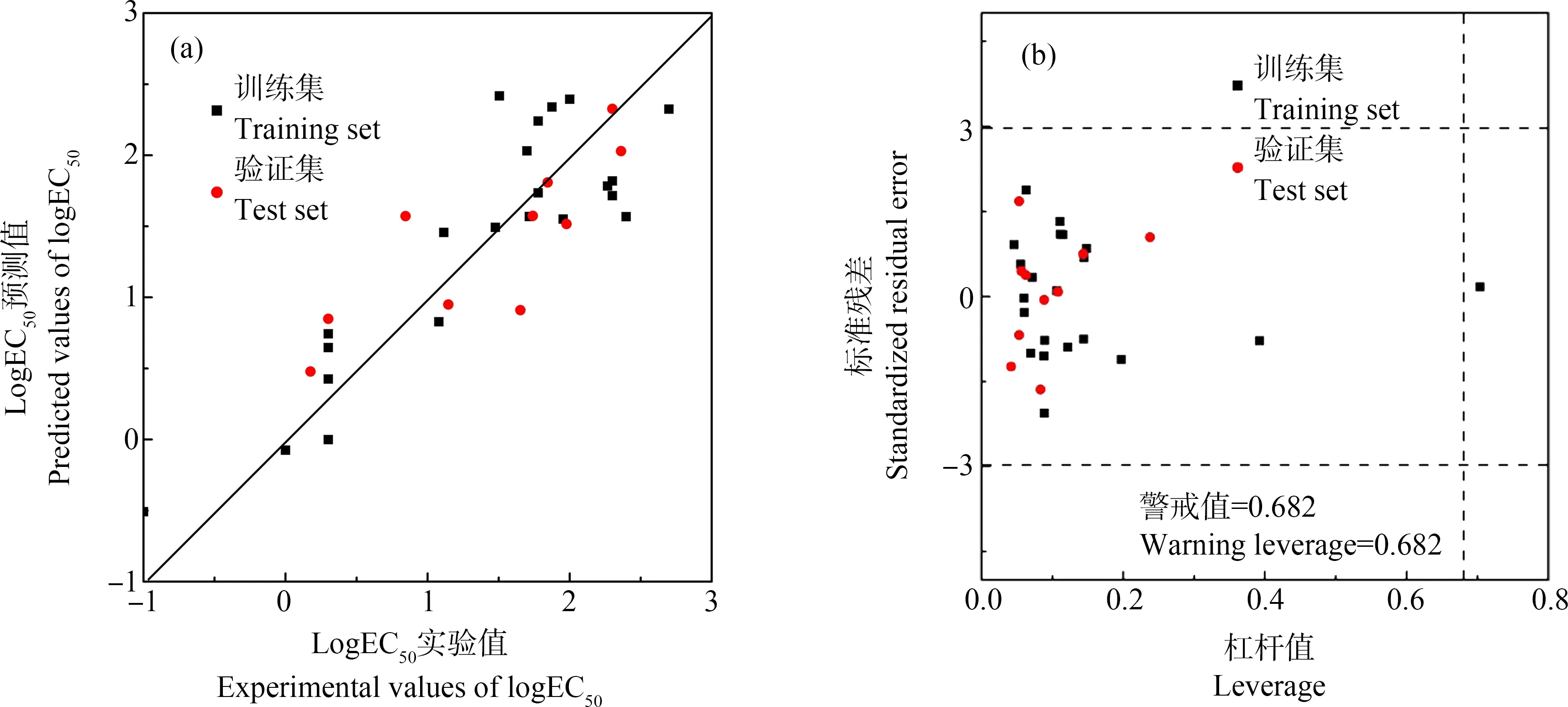
图2 OPAHs斑马鱼胚胎logEC50实验值和预测值的拟合(a)和Williams图表征的模型(3)应用域(b)Fig. 2 The fitting diagram of the experimental and predicted values of zebrafish embryos logEC50 for OPAHs (a) and the application domain of the model (3) based on Williams diagram (b)
