松果体区肿瘤的显微手术分析
2021-03-25步星耀王新军王瑞星
孙 勇 步星耀 王新军 王瑞星
1)河南省人民医院,河南 郑州450003 2)郑州大学第五附属医院,河南 郑州450052 3)河南省直第三人民医院,河南郑州450000
松果体区肿瘤的发病率较低,占颅内肿瘤的0.4%~1%,儿童发生率是成年人的10 倍,男性多于女性。松果体区肿瘤虽然少见,但其病理类型繁多,一般可分为三大类:(1)生殖细胞源性肿瘤,为松果体区最常见肿瘤,约占60%,包括生殖细胞瘤、畸胎瘤、绒毛膜癌、精原细胞瘤、内胚窦瘤及混合性生殖细胞瘤。(2)松果体实质细胞肿瘤,约占松果体区肿瘤的25%,包括松果体细胞瘤和松果体母细胞瘤。(3)其他来源肿瘤或肿瘤样变,包括胶质瘤、上皮样或皮样囊肿、脑膜瘤、转移瘤等[1]。儿童和青少年松果体区最常见生殖细胞瘤和畸胎瘤,老年人多见转移瘤。从解剖层面来看,在颅内松果体区所处部位较深,有较多重要血管、神经围绕,尤其是深静脉系统[2]。松果体处在颅内中心部位,前界为第三脑室后缘,中脑在前下部,上界为胼胝体压部和中间帆,上部及后部有多支深静脉包绕,下界为四叠体板,后界为小脑上蚓部[3]。这些结构都可能受松果体肿瘤占位效应的影响。顶盖前方的中脑导水管可能受到肿瘤占位压迫影响,导致梗阻性脑积水,这是松果体区肿瘤最常见的症状。不同类型的松果体区病变在选择合理的治疗方案上差别较大,非手术治疗或手术全切病变,而且单从影像学作出精确的诊断是困难的。松果体区所处位置深,有着复杂的结构,位于其部位的病变切除较麻烦,术后可能出现严重的并发症,因此松果体区肿瘤外科手术切除的风险较大,对于神经外科医生来说极具挑战性。有多种手术入路到达松果体区,选择手术入路时可以根据病变的具体位置、特征和术者的经验来决定。
Poppen入路是目前应用较为广泛的一种手术入路。合适手术入路的选择应让术者在保护重要神经、血管的同时有利于肿瘤的全切。该入路到达松果体区相对较近,手术操作时居高临下,直视病变,容易显露和保护重要结构,大多数松果体区肿瘤都能够选择该入路进行切除手术[4-5]。本研究回顾分析2015-09—2020-04 河南省人民医院21 例松果体区肿瘤术后患者的临床资料。
1 资料与方法
1.1 临床资料选取2015-09—2020-04 河南省人民医院21 例松果体区肿瘤患者,其中男12 例,女9例,年龄6~29岁,平均21.5岁;病程6 d~2(4.6±2.1)个月;主要临床症状:头痛、恶心、呕吐、视乳头水肿等高颅压表现15 例,4 例表现为Parinaud 综合征,4例出现意识障碍,3例有视力下降,1例出现共济失调症状。术前给予KPS评分56~87(75.3±4.1)分。
1.2 影像学资料所有患者术前行头颅MRI 平扫+增强(图1~2)、头颅MRA(或头颅CTA)及MRV,明确病变位于松果体区和三脑室后部。肿瘤直径1.5~5.3 cm,平均3.2 cm,提示幕上脑积水13例。影像学资料高度提示生殖细胞瘤的患者,术前检查血绒毛膜促性腺激素(HCG)和甲胎蛋白(AFP),联合血清学检查结果诊断单纯生殖细胞瘤患者,建议放疗,对于拒绝放疗的患者沟通后给予手术治疗[6]。
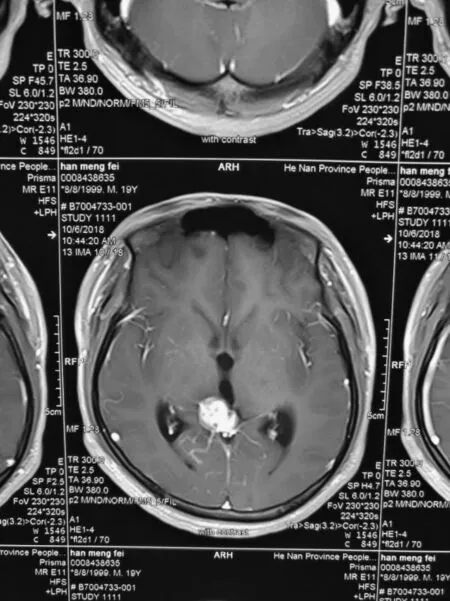
图1 松果体区肿瘤患者增强磁共振(轴位)Figure 1 Pineal region tumor enhanced magnetic resonance (axial view)
1.3 诊疗方案临床诊断为松果体区肿瘤的患者,往往合并脑积水出现颅内压升高,因此临床上治疗的首要目的是针对脑积水、缓解高颅压,既往针对脑积水主要采用侧脑室-腹腔分流术[7]。根据术前头颅MRI、CT 等影像学资料,考虑肿瘤的大小、部位、生长方向和临近组织的关系,选取经典的经枕小脑幕切开(Poppen)入路,该入路能有效利用生理条件和肿瘤形成的自然通道,在保护患者正常组织结构的基础上,尽量大地显露病变区域,达到最大限度的肿瘤切除[8]。
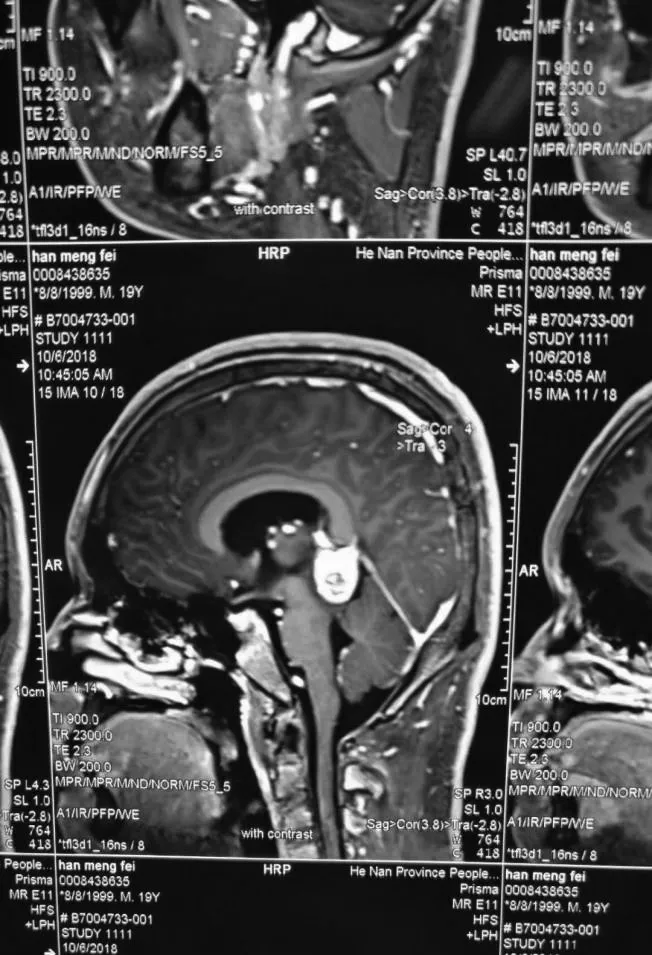
图2 松果体区肿瘤患者增强磁共振(矢状位)Figure 2 Pineal region tumor enhanced magnetic resonance (sagittal view)
针对肿瘤则采用Poppen 入路开颅手术,显微镜下行松果体区肿瘤切除术,全麻下患者取侧俯卧位,头架固定,骨窗边缘显露矢状窦及横窦边缘,硬膜悬吊后剪开,如果颅压较高可以采用甘露醇脱水或侧脑室枕角穿刺释放脑脊液降压,应用自动牵开器、脑压板轻柔抬起枕叶,切开小脑幕缘,显露病变和临近重要血管等结构,小心分离蛛网膜界面及组织粘连,可以低功率电凝肿瘤外壁使之缩小,注意病变周围重要血管尤其是深部静脉及供血动脉,重要血管可以显微镜下小心分离后予以保护,切瘤时可以先瘤内减压,分块吸除或切除肿瘤组织,努力全部切除肿瘤,病变切除后,给予彻底止血,去除术中产生的破损组织和血凝块,达到冲洗水清亮,严密缝合硬膜,留置皮瓣下引流管,常规关颅。术后依据送检组织的病理结果,必要时行辅助放化疗。
2 结果
所有患者术后复查头颅CT和磁共振MRI示,16例患者肿瘤全切(图3~4),4 例患者肿瘤次全切,1例患者部分切除。1 例患者术后局限性视野缺损。未全切的5例患者术后酌情给予伽玛刀治疗,9例病理结果提示恶性肿瘤患者行放化疗。术后随访3 个月~4 a,平均1.3 a,术后4 例复发(2 例生殖细胞瘤,2 例胶质瘤),1 例胶质瘤患者在术后18 个月死亡。本组21例患者术后病理结果显示,10例生殖细胞肿瘤(图5),4例松果体细胞瘤,3例胶质瘤,2例脑膜瘤,1例转移瘤及1例囊肿。在这10例生殖细胞肿瘤中,5例是单纯生殖细胞瘤,其中4例患者是男性,1 例患者是女性,年龄5~28 岁,平均15.5 岁。回顾患者手术前的影像学资料表现较为典型,多为均匀一致性表现,T1WI 为略低信号、T2WI 为稍高信号,肿瘤增强扫描多为强化明显,术前检查血绒毛膜促性腺激素(HCG)和甲胎蛋白(AFP),联合血清学检查结果也考虑单纯生殖细胞瘤。
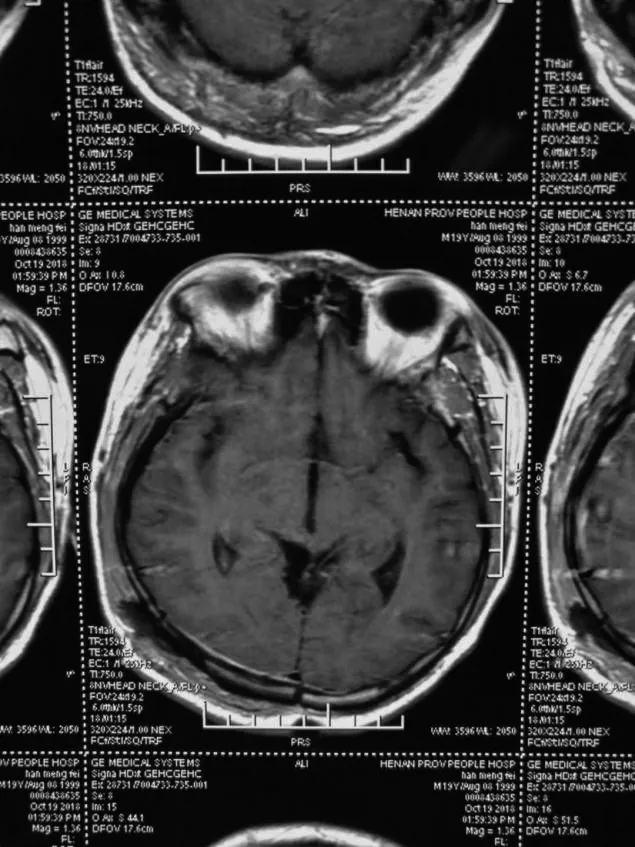
图3 松果体区肿瘤术后增强磁共振(轴位)Figure 3 Enhanced magnetic resonance imaging after resection of pineal region tumors(axial view)
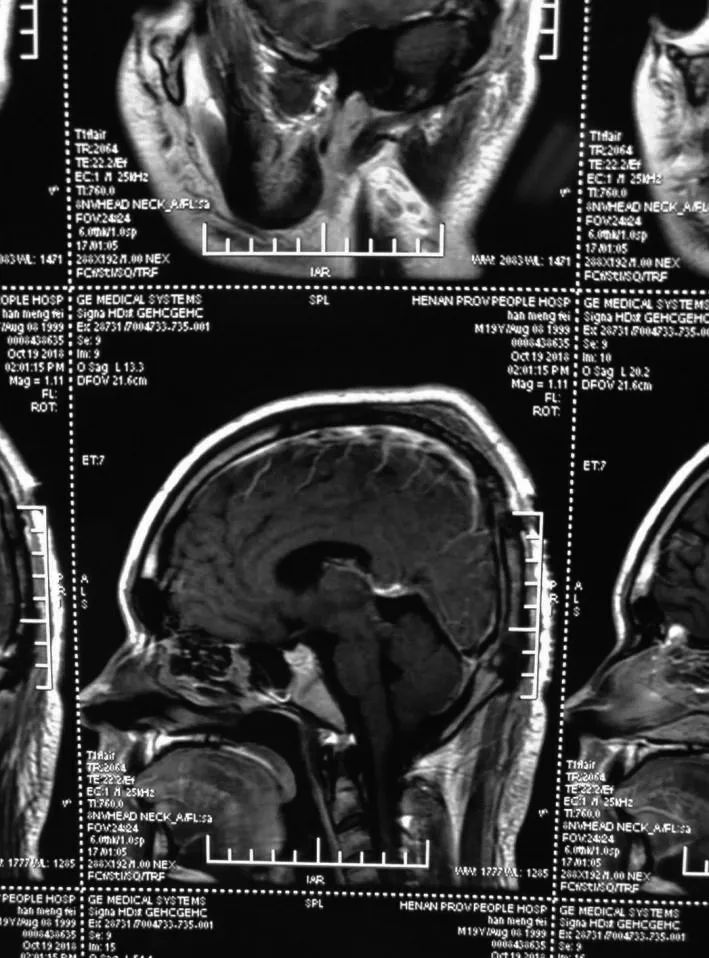
图4 松果体区肿瘤术后增强磁共振(矢状位)Figure 4 Enhanced magnetic resonance imaging after resection of pineal region tumors(sagittal view)
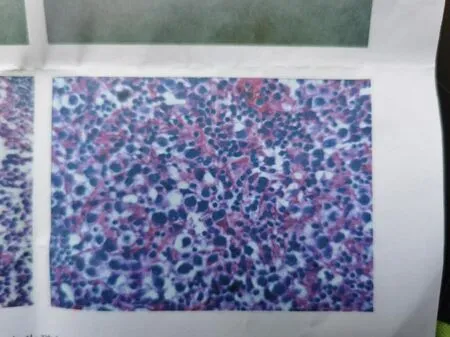
图5 病理结果符合生殖细胞瘤Figure 5 Pathological findings were consistent with germ cell tumor
3 讨论
一般来说,75%左右松果体区肿瘤是恶性肿瘤,一部分为良性病变。在松果体区肿瘤中生殖细胞瘤发生率较高,占该部位病变的50%以上[9]。本组21例松果体区肿瘤中生殖细胞瘤10 例,也提示在松果体区肿瘤中生殖细胞瘤发生率较其他病变高。松果体区病变位置较为特殊,松果体区肿瘤能导致中脑导水管受压,或者位于第三脑室后部使得导水管开口受阻,肿瘤如果继续往前下生长会导致中脑导水管狭窄,甚至完全堵塞,所以松果体区肿瘤经常伴阻塞性脑积水[10-11]。松果体区肿瘤患者相当一部分以高颅压表现为首发症状[12]。本组病例临床症状为头痛、恶心、呕吐、视乳头水肿等高颅压表现15例,其临床表现为多样性,无明显特异性。
松果体区肿瘤手术目前多采用适应证广泛的Poppen或Krause入路,手术采用经典的Poppen入路,该入路是目前应用较为广泛的一种手术入路[13]。术中到达松果体区相对较近,手术操作时居高临下,直视病变,容易显露和保护重要结构,手术操作安全,对组织的骚扰不重[14]。重要的静脉血管,如大脑内静脉、基底静脉、大脑大静脉及四叠体区静脉系统可以直视观察,容易显露和保护血管,而且松果体区肿瘤合并阻塞性脑积水,经Poppen 入路能够方便术中行侧脑室枕角穿刺释放脑脊液减压,利于轻松抬起枕叶向松果体区探查,不必再另作切口行外引流术[15]。大多数松果体区肿瘤都能够选择该入路进行切除手术,对于主体位于幕上、体积较大、大部分位于一侧的松果体区肿瘤,可以优先考虑该入路[16]。由于松果体区位置较深,周围往往环绕重要的神经、血管,对于神经外科医生来说具有挑战性,应注意术中不要损伤枕叶视觉皮质,术中应用甘露醇脱水,同时要保护枕内静脉以防损伤视觉皮质而导致的偏盲[17]。
一部分松果体区肿瘤瘤体大且向幕下生长,可以通过小脑幕切开,达到瘤体的充分暴露,尽可能地全部切除瘤体[18]。相对来说,Poppen 入路手术操作时切开小脑幕,增加幕下间隙,有助于充分利用基底静脉下空间。天幕窦隐藏于小脑幕内,包括直窦、下矢状窦,松果体区肿瘤压迫侵及静脉系统,影响静脉回流,天幕窦可能成为重要回流支,侧支回流静脉可能与瘤体的病理引流静脉分不清,术中天幕窦切断能导致静脉系统回流障碍,可能出现脑肿胀等相关术后并发症[19-20]。一般小脑幕中后部存在天幕窦的情况不多,为了避免静脉回流障碍,术中天幕切开常常在距离直窦1 cm左右的位置[21]。
本组21例患者术后病理结果显示,10例生殖细胞肿瘤,4例松果体细胞瘤,3例胶质瘤,2例脑膜瘤,1例转移瘤及1例囊肿。在这10例生殖细胞肿瘤中5例是单纯生殖细胞瘤。病理类型不同的松果体区肿瘤对放化疗的敏感性明显不一样,临床发现术后放化疗对生殖细胞瘤、绒毛膜癌、内胚窦瘤有明显效果,而对未成熟畸胎瘤、松果体母细胞瘤、胶质瘤疗效一般,对脑膜瘤和成熟畸胎瘤的效果很差[21-22],所以说松果体区肿瘤的临床治疗是结合影像学、放化疗以及手术切除在内的综合治疗,也正是当今医学所倡导的个体化治疗[23-26]。
鉴于松果体区肿瘤病理类型的分类繁多,尤其生殖细胞肿瘤所占比例较大,因此应结合患者术前影像学,术前积极检查HCG和AFP,联合血清学检查结果指导下一步治疗方案,生殖细胞瘤可以考虑先行放化疗,而其他肿瘤则多需行开颅手术切除[27-28]。
针对临床上高度怀疑松果体区生殖细胞瘤的患者,中西方的诊疗主张尚存在一定差异,欧美国家主张行神经内镜下肿瘤组织活检术并明确病理活检结果,后续行放化疗。而亚洲国家多尝试诊断性放化疗来明确诊断,因生殖细胞瘤对放化疗敏感,如病灶明显缩小或消失,临床即诊断为生殖细胞瘤[29],前提是需要充分与患者及家属沟通,得到其知情同意后进行。诊断性放化疗可使松果体区肿瘤体积缩小,脑积水自然得到缓解,并不需要单独针对脑积水提前进行干预治疗,从而减少患者痛苦,通过诊断性放化疗对生殖细胞瘤高度疑似者的诊断准确率不低[30]。
松果体区生殖细胞肿瘤不分泌血清肿瘤标志物,包括AFP、β-人绒毛膜促性腺激素(β-hCG),一般情况下血清β-hCG 和(或)AFP 水平升高即可确诊为生殖细胞肿瘤,但此类血清肿瘤标志物升高的肿瘤一般成分复杂,提示肿瘤组织包含绒毛膜癌、内胚窦瘤或未成熟畸胎瘤等成分,如果血清肿瘤标志物升高的此类患者对放化疗反应较差,而是表现为稳定或进展,则需进一步手术行肿瘤切除术[31]。
现有部分观点认为单纯生殖细胞肿瘤在生殖细胞瘤中占比不高,个别放化疗效果也不理想,特异性的检查手段欠充分,术前也无法明确诊断,与患者沟通后可以考虑手术切除治疗[32]。本组10例生殖细胞肿瘤中5 例是单纯生殖细胞瘤,其中4 例患者是男性,1 例女性,回顾患者术前影像学资料表现较为典型,多为均匀一致性表现,T1WI 为略低信号、T2WI 为稍高信号,肿瘤增强扫描多为强化明显,术前检查HCG 和AFP,联合血清学检查结果也考虑是单纯生殖细胞瘤。据文献报道青少年和儿童是原发性颅内生殖细胞肿瘤的高发人群,以男性好发,男女发病比例约为3∶1[3],颅内生殖细胞肿瘤常发于松果体区,14 岁以前发病者占35%~40%,20 岁以前发病者约90%。除外以上松果体区生殖细胞瘤以及分泌血清β-hCG 和(或)AFP 的生殖细胞肿瘤,其他病理类型的松果体区占位多需采用开颅手术将肿瘤切除,术后根据病理结果行进一步的辅助放化疗或仅需进一步随访观察[33]。
综合考虑,松果体区肿瘤的临床诊疗是一个综合的、个体化的治疗方案,应根据术前影像学、血清肿瘤标志物等进行甄别、筛选决定,选择合适的治疗方式,显微手术切除是松果体区肿瘤的主要治疗手段,根据术前检查结果选择合适的手术入路,可以使患者获得满意的手术效果。
