环状RNA100395对甲状腺乳头状癌潜在的诊断和治疗价值
2021-03-25王兵兵
王兵兵,杨 爽
(吉林大学第一医院1.普外科;2.神经内科,吉林 长春130021)
甲状腺肿瘤是目前最为常见的一种内分泌肿瘤,其中甲状腺乳头状癌是甲状腺癌中最常见的亚型,其死亡率大约为(0.2-0.6)/10万[1]。目前诊断甲状腺癌的主要方法为细针抽吸细胞学检查,此项检查主要用于结节性甲状腺疾病的鉴别诊断,成功率大约在70%左右[2]。但是此种检查方法有创并且价格昂贵,虽然已广泛应用于临床,但是非侵袭性的、简单、快捷、安全的诊断方法仍需要不断的被探索。非编码RNA目前已被大量研究证实具备诊断许多疾病的价值,环状RNA(circRNA)被认为最有可能成为新一代血清学诊断标志物[3]。其闭合的环状结构使其较普通的线性RNA能够抵抗RNA酶的降解,更加稳定的存在于组织和体液中,尤其是其能在血液中广泛的存在给血清学诊断创造了基础[4-5]。因此,本文通过实验验证环状RNA 100395在甲状腺乳头状癌组织中低表达,并且circRNA100395能够抑制TPC-1细胞的增殖和迁移,有可能成为甲状腺乳头状癌新的血清学诊疗标志物。
1 资料与方法
1.1 细胞培养及转染甲状腺癌细胞系TPC-1培养在含有10%血清浓度的1640培养基中。CircRNA100395质粒及干扰物质由吉玛有限公司(上海,中国)合成。将2 μl质粒或干扰物质连同2 μl Lipofectamine转染试剂共同转染入TPC-1细胞中,转染5小时后,更换新的1640培养基。48小时后获取细胞RNA进行转染效率的验证或供后续细胞增殖以及迁移实验使用。其中转染circRNA100395质粒的TPC-1命名为ov-TPC-1组,转染circRNA100395干扰物的TPC-1命名为RNAi-TPC-1组,另将未处理的TPC-1细胞命名为control组。
1.2 细胞增殖实验大约3×103细胞铺板于96孔培养板。24小时后将Cell Counting Kit 8(CCK8)试剂加入到ov-TPC-1组、RNAi-TPC-1组以及control组的培养基中共培养。分别在1,2,3,4小时检测细胞450 nm的吸光度。
1.3 平板克隆实验将3组细胞用0.25%胰蛋白酶消化使之成为单细胞并将细胞密度调整至细胞数为1×105个/mL,按照500-1000 个细胞/孔铺种 6孔培养板中,每隔 3 天进行更换培养液并观察细胞状态,显微镜下观察克隆大小。当六孔板中出现肉眼可见的克隆时终止培养,4%多聚甲醛固定,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
1.4 细胞器迁移实验(transwell)取24孔康宁transwell细胞侵袭实验板。将20 μl基质凝胶涂覆于透孔室,并在37℃下孵育45-60 min。将3组细胞按照每孔105个细胞铺于上腔,同时将含20%FBS的1640培养基注入下腔。最终对下孔进行苏木精染色并计数。
1.5 MMP2及MMP9检测实时定量聚合酶链反应(qRT-PCR)检测三组细胞中MMP2及MMP9的差异表达倍数。引物序列详见表1。
1.6 circRNA100395对甲状腺癌诊断价值预测随机选取10例甲状腺癌组织以及10例癌旁正常组织手术标本,手术切除后立即置入液氮中保存。应用TRIzol法对液氮保存的组织进行RNA提取,经浓度和纯度的检测并进行逆转录以及实时定量聚合酶反应(qRT-PCR),每个样本重复3次实验。本实验经吉林大学伦理委员会审核并批准,全部患者签署知情同意书。
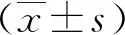
2 结果
2.1 转染效率验证首先对3组细胞进行qRT-PCR实验检测转染效率,其中ov-TPC-1组circRNA100395表达量明显增加,是对照组表达量的2.37倍,而RNAi-TPC-1组表达量明显下降,是对照组表达量的0.025倍(图1A),转染效率良好。
2.2 细胞增殖实验CCK8实验显示,3组细胞的增殖程度在不同的时间段呈现出差异表达(P<0.05)。其中ov-TPC-1组细胞增殖程度较对照组在第2,3,4小时明显减低而RNAi-TPC-1组细胞增殖程度明显增加(图1B)。平板克隆实验显示RNAi-TPC-1组克隆形成率(30.2±4.4)明显较对照组(20.2±4.4)增加,而ov-TPC-1组(10.3±4.2)克隆形成率明显较对照组下降(图1C)。
2.3 细胞迁移实验Transwell实验结果显示,RNAi-TPC-1组细胞数(287.1±10.4)较control组(187.3±10.3)细胞数量显著增加,ov-TPC-1组的TPC细胞(132.3±11.1)较对照组的TPC细胞数量显著降低(图2A)。MMP2和MMP9是被用来评估细胞迁移能力的2种基因表型标志物,其高表达通常提示细胞迁移能力增加。qRT-PCR显示MMP2(0.23±0.11)和MMP9(0.21±0.13)在ov-TPC-1组的TPC细胞较对照组表达降低,而在RNAi-TPC-1组MMP2(4.33±1.05)和MMP9(4.72±1.21)表达升高(图2B)。
2.4 circRNA100395对甲状腺癌诊断价值预测10例甲状腺癌患者circRNA100395表达量明显降低(2.34±0.32),较癌旁正常组织表达低4.86倍,诊断阳性率为100%。

表1 引物的具体序列
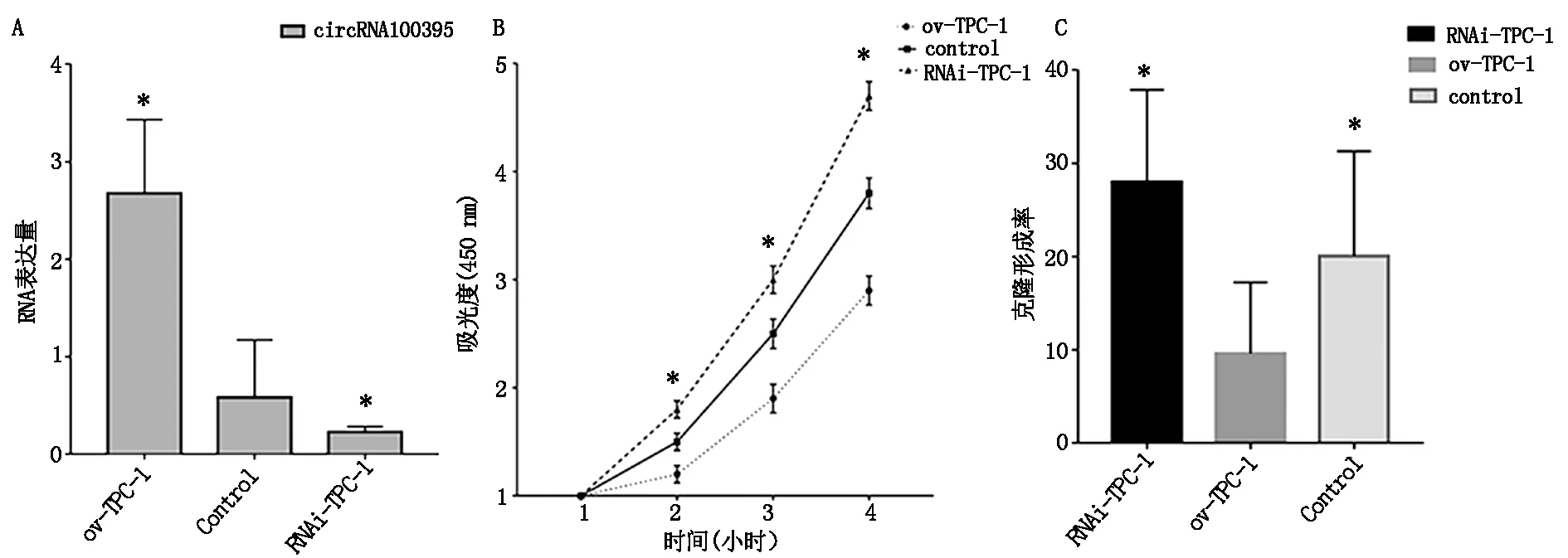
图1 细胞增殖实验
3 讨论
甲状腺乳头状癌约占全部甲状腺恶性肿瘤的80%左右,是一种起自甲状腺滤泡上皮细胞的恶性肿瘤[6]。既往在甲状腺癌分子发病机制方面的研究主要围绕蛋白质组学分析来寻找发病过程中呈现差异表达的蛋白质。而新近研究逐渐开始关注基因组学在发病机制中的研究,其中miRNA是研究最早的一种非编码RNA,如miR-220,miR-221和miR-222已被证实和甲状腺癌有关并可以作为血清学诊断的标志物[7]。但是miRNA较容易降解,在体液中表达并不稳定,因此更加稳定存在于血清中的非编码RNA仍在被探索。环状RNA的发现被认为是血清学快速诊断疾病的新希望。CircRNA具有独特的闭环式结构,其能稳定的存在于人体的体液中包括血液、尿液、脑脊液等[4]。因此检验体液中circRNA含量的改变能够对一些疾病起到诊断性作用。故本文试图通过检测circRNA100395在甲状腺癌组织中的表达量,并研究其具体作用机制以及潜在的诊断价值。
图2 细胞迁移实验
通过对甲状腺乳头状癌组织和癌旁正常组织进行检测发现,circRNA100395呈现差异性低表达。在既往的研究中,circRNA100395被认为是一种抑癌基因参与到许多肿瘤的发病过程中。最早报道其在肺癌组织中呈现出差异性低表达,并且和肺癌细胞的表型改变也有密切关系[8]。随后Chen等人[9]也发现circRNA100395在肝癌组织中呈现低表达,并且能够抑制肝癌细胞的增殖和转移能力。Li等人[10]发现circRNA100395在卵巢癌中呈现低表达,其可以通过miR-1228/p53/上皮间质转化轴来抑制卵巢癌细胞的增殖和迁移。但是circRNA100395是否也在甲状腺乳头状癌发病过程中起到抑癌基因的作用目前报道较少。
通过对甲状腺癌组织circRNA100395实时定量检测发现,circRNA100395呈现差异性低表达,差异表达倍数为4.86倍。为了进一步研究circRNA100395在甲状腺癌细胞中的作用机制,本研究构建了circRNA100395的质粒以及干扰物质。通过转染TPC-1细胞后发现,低表达circRNA100395的TPC-1细胞获得更高的增殖能力,同时TPC-1细胞的克隆能力也得到了增强。相反在高表达circRNA100395的TPC-1细胞表现出了较低的增殖能力,说明circRNA100395能够抑制TPC-1细胞的增殖。而迁移实验证明低表达circRNA100395的TPC-1细胞能够更多的通过transwell上腔最终迁移到下腔,表明迁移能力获得了提升。对MMP2和MMP9的检测发现低表达circRNA100395的TPC-1细胞表达更多的MMP2和MMP9,侧面说明TPC-1细胞迁移能力获得了提升,说明circRNA100395能够抑制TPC-1细胞的迁移。
综上,circRNA100395作为肿瘤细胞中的抑癌基因,可以抑制TPC-1细胞的增殖和迁移,有望成为甲状腺乳头状癌新的靶向治疗手段。而其在甲状腺乳头状癌患者中呈现特异性低表达有望成为甲状腺乳头状癌新的血清学诊疗标志物。
