丹参治疗缺血性脑卒中潜在效应机制的网络药理学研究
2021-03-25朱德才张昌林廖映迪
朱德才,张昌林,廖映迪
脑卒中是一种急性脑循环障碍导致的局限性或弥漫性神经功能缺损的脑血管疾病,包括缺血性脑卒中(ischemic stroke,IS)和出血性脑卒中[1]。据2016 年全球疾病负担研究显示,脑卒中已成全球第二大死亡原因,患脑卒中人数达8 010 万人,其中缺血性脑卒中占84.4%[2]。在我国,脑卒中是伤残调整寿命年增加的主要原因之一[3],脑卒中防控形势严峻,未来随着我国人口老龄化速度的加快,脑卒中疾病负担仍可能进一步增加。因此,探索更多积极、有效防治脑卒中发生发展的措施显得尤为必要。
缺血性脑卒中属中医学“中风”的范畴,中风的发病与风、火、痰、虚、瘀等因素密切相关,其中瘀贯穿缺血性脑卒中发病发展的全过程[4]。因此,活血化瘀的法则在中风病的治疗中占据相当重要的分量[5]。中药丹参始载于《神农本草经》,其味苦,性微寒,归心、肝经,具有活血祛瘀、通经止痛等功效[6]。现代药理学研究表明,丹参具有改善血液循环、抗血小板聚集、保护血管内皮细胞、抗动脉粥样硬化、抗炎、抗氧化应激、抗肿瘤等多种药理作用,目前主要用于治疗冠心病、心肌梗死、缺血性脑卒中等心脑血管疾病[7-8]。因此,探究中药丹参治疗缺血性脑卒中潜在效应机制,对发挥中医药治疗缺血性脑卒中的优势具有重要意义。
网络药理学是一门融合了系统生物学、生物信息学及计算机技术等的新兴学科,这一概念由Hopkins首次提出,他指出对于多成分、多靶点药物的研发,需要用系统思维,从网络层面去分析药物效应机制[9]。这种从网络层面阐释药物效应机制的方法,是对既往“一药、一靶、一病”还原论药物研发模式的有效补充。中药具有多成分、多靶点、多效应途径的特征,这与网络药理学的思想及研究方法相吻合,由此网络药理学很快为中药研究者所接受并应用在中药药理研究中,提出了中药网络药理学的研究策略与路线[10]。本研究基于网络药理学分析方法,从系统层面以及分子、蛋白水平揭示丹参治疗缺血性脑卒中的潜在效应机制,为中药丹参的进一步药理研究和临床应用提供。
1 资料与方法
1.1 丹参化学成分及成分作用靶标预测 BATMANTCM(http://bionet.ncpsb.org/batman-tcm/)数据库具有中药成分靶标预测、基因功能分析、通路富集分析等诸多功能[11],通过药物相似性原则,预测中药成分作用靶标[12]。本研究在BATMAN-TCM 平台“Cluster name”中输入中药丹参的拼音“DANSHEN”,并以P<0.05、Score cutoff=20 为阈值收集中药丹参的成分信息及预测成分作用靶标。
1.2 缺血性脑卒中靶标收集 本研究以ischemic stroke,brain ischemia,cerebral infarction,cerebral ischemia 作为缺血性脑卒中的关键词,通过检索DisGe NET(http://www.disgenet.org)[13]、NCBI (https://www.ncbi.nlm.nih.gov/gene/)、Human Phenotype Ontology(https://hpo. jax. org/app/)[14]、Gene Cards (https://www.genecards.org/)[15]等数据库,获取已知的与缺血性脑卒中相关的靶标,并删除重复靶标,构建缺血性脑卒中疾病靶标数据库。
1.3 丹参治疗缺血性脑卒中的蛋白质-蛋白质相互作用网络构建 将丹参成分预测靶标及缺血性脑卒中疾病靶标上传至Venny 2.1.0 (http://bioinfogp.cnb.csic.es/tools/venny/index.html)在线分析工具,获取两者共同靶标,绘制Venn 图。STRING(https://string-db.org/)数据库是一个在线搜索蛋白质相互作用关系的数据库,该数据库收录大量实验数据、文献挖掘数据及生物信息学预测数据等[16]。在本研究中,将丹参成分预测靶标与缺血性脑卒中的共同靶标导入STRING 数据库,选择研究对象为“Homo sapiens”,构建丹参治疗缺血性脑卒中的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络。
1.4 PPI网络分析 网络拓扑特征中的度中心性(degree)、介度中心性(betweenness centrality)及紧密度中心性(closeness centrality)是衡量网络节点重要程度的指标[17]。网络节点在网络中的重要性与该指标数值的大小呈正相关。本研究采用Cytoscape3.6.1 软件中“Network Analyzer”对丹参-缺血性脑卒中靶标PPI 网络进行网络拓扑学特征分析,获取其度中心性、介度中心性及紧密度中心性等网络拓扑特征值,并以同时满足大于度中心性、介度中心性和紧密度中心性的中位数作为基准,筛选丹参治疗缺血性脑卒中的核心靶标。
1.5 丹参治疗缺血性脑卒中的基因本体(GO)及京都基因和基因百科全书(KEGG)分析 GO 分析广泛应用于基因功能的注释,其可提供细胞组分、分子功能及生物学过程等生物学信息[18]。KEGG 是国际上最常用的生物信息学数据库之一,从分子水平方面为了解生物高级功能及生物系统提供参考信息[19]。DAVID(the database for annotation,visualization and integrated discovery)数据库整合了包括GO、KEGG 在内的多个权威数据库资源,为大规模的基因或蛋白提供生物信息方面的注释[20]。本研究将丹参治疗缺血性脑卒中的核心靶标上传DAVID 数据库,对丹参治疗缺血性脑卒中的核心靶标进行GO 基因功能和KEGG 通路富集分析,并依据P-vaule 值结果排序,以图表形式展示。
2 结 果
2.1 丹参化学成分及成分靶标预测 通过BATMANTCM 数据库,获得中药丹参化学成分38 个,包括丹参素、丹参酚、丹参酚酸类、丹参酮类、丹参醌类、咖啡酸等化合物(见表1)。通过“药物相似性”原则,计算并筛选出丹参化学成分的作用靶标,除去重复靶标后,共获得770 个靶标。对中药丹参成分作用靶标进行生物信息学分析,以了解靶标基因功能、通路富集以及疾病表型方面信息,图1 为简化的中药丹参“有效成分-靶标-通路-疾病”关联网络图。结果提示中药丹参可参与环磷酸鸟苷(cGMP)-环磷酸鸟苷依赖的蛋白激酶(PKG)信号通路、Rap1 信号通路、钙离子信号通路、催乳素信号通路、甲状腺激素信号通路、逆行神经信号、刺激型态成形因子信号等。疾病表型方面显示,中药丹参对于精神类疾病(焦虑、抑郁)、神经系统疾病(神经变性、脑损伤)、心血管疾病以及妇科相关疾病(痛经、子宫内膜异位)可能具有较好的疗效。

表1 丹参化学成分信息汇总表
(续表)
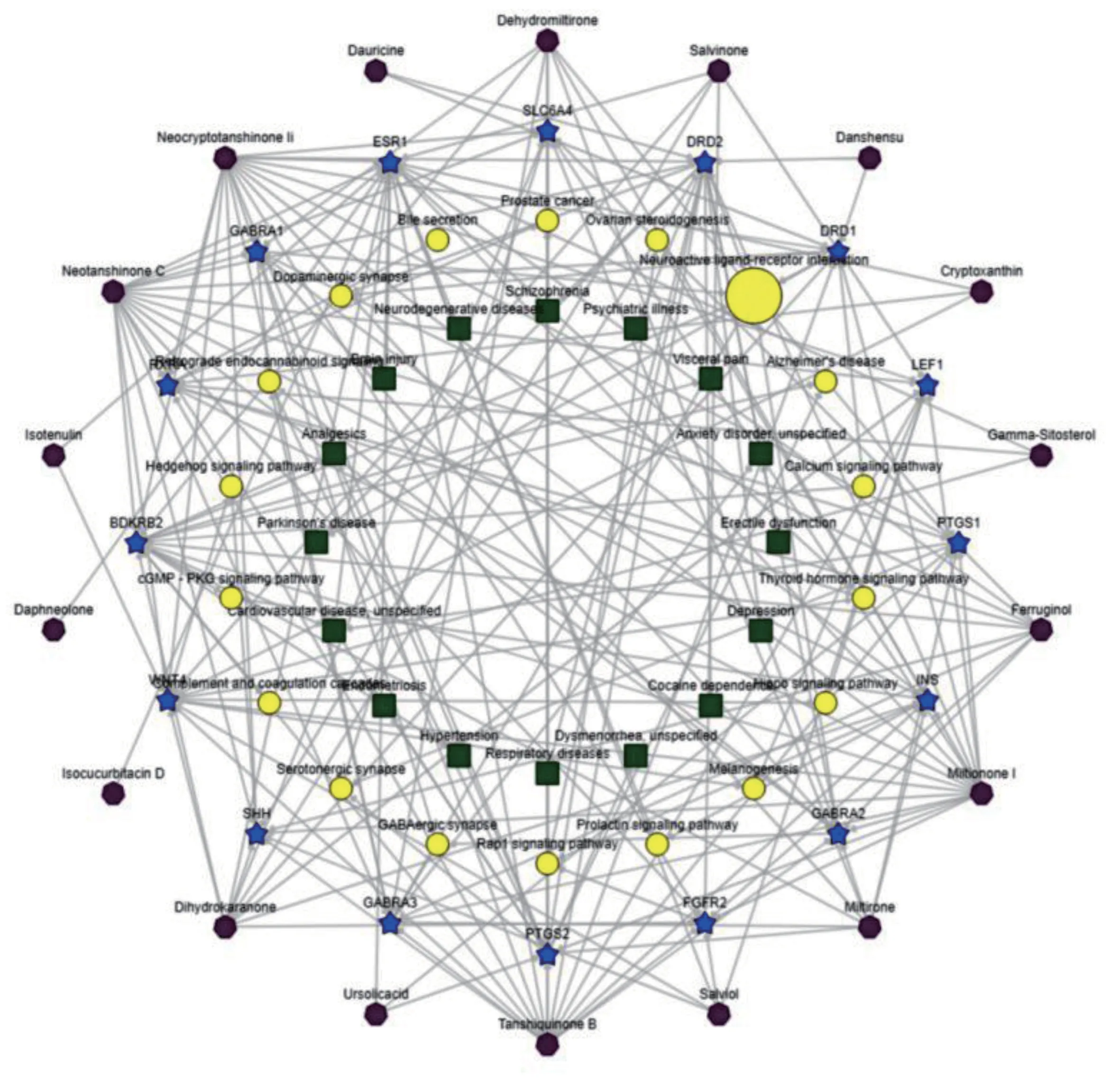
图1 中药丹参“有效成分-靶标-通路-疾病”关联网络图
2.2 缺血性脑卒中相关靶标 通过DisGeNET、NCBI、HPO、Gene Cards 数据库检索缺血性脑卒中关键词(ischemic stroke、brain ischemia、cerebral infarction、cerebral ischemia),获取相关靶标,其中DisGeNET中737 个,NCBI-Gene 中642 个,HPO 中67 个,Gene Cards 中296 个,去除重复靶标后,共获取缺血性脑卒中相关靶标1 216 个。
2.3 丹参治疗缺血性脑卒中的PPI 网络构建及分析 将丹参成分作用靶标及缺血性脑卒中疾病相关靶标上传至Venny 2.1.0 分析工具,获得共同靶标205 个,作为丹参治疗缺血性脑卒中的候选靶标(见图2)。将丹参治疗缺血性脑卒中的候选靶标上传至STRING 数据库,构建丹参治疗缺血性脑卒中的PPI 网络。通过计算PPI 网络特征值,选取同时满足度中心性、介度中心性和紧密度中心性3 者中位数的靶标作为丹参治疗缺血性脑卒中的关键靶标,本研究共获取关键靶标83个。对丹参治疗缺血性脑卒中关键靶标相互作用网络进行可视化,节点大小及颜色深度反映该靶标度中心性的值(见图3)。研究显示丹参治疗缺血性脑卒中与白介素6(IL-6)、肿瘤坏死因子(TNF)、TP53、SRC、白介素1β(IL-1β)、FOS、PTGS2、EDN1、JUN、白介素10(IL-10)等靶标密切相关。
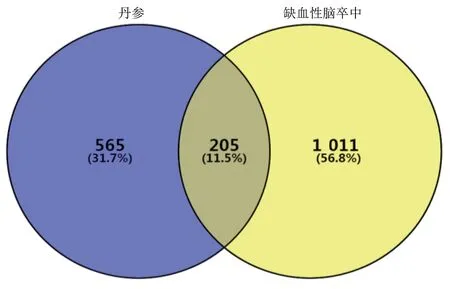
图2 丹参成分靶标与缺血性脑卒中疾病靶标的Venn 图
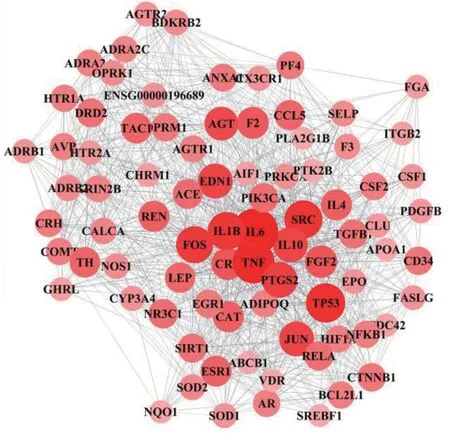
图3 丹参治疗缺血性脑卒中核心靶标相互作用网络图
2.4 丹参治疗缺血性脑卒中核心靶标基因功能及通路富集分析 通过DAVID 数据库对丹参治疗缺血性脑卒中核心靶标进行GO 基因功能及KEGG 通路富集分析,以了解其核心靶标所发挥的生物学功能。研究结果显示,在生物学过程中,丹参治疗缺血性脑卒中与一氧化氮生物合成过程的正调控、对药物的反应、炎症反应、细胞增殖的阳性调节、衰老、DNA 模板转录正调控、血压调节、ERK1 和ERK2 级联的正调节、基因表达正调控、RNA 聚合酶Ⅱ启动子对转录的正调节作用等过程相关;其分子功能方面涉及了蛋白质杂化活性、酶结合、细胞因子活性、受体结合、生长因子活性、蛋白结合、转录因子结合、蛋白质同源活性、相同蛋白质结合、肾上腺素结合等;在细胞层面其作用部位集中在细胞外间隙、胞外区、细胞膜、细胞表面、神经元投射、细胞膜有机组成部分、细胞膜外侧面、溶酶体、蛋白质复合物、细胞质核周区等。详见图4。
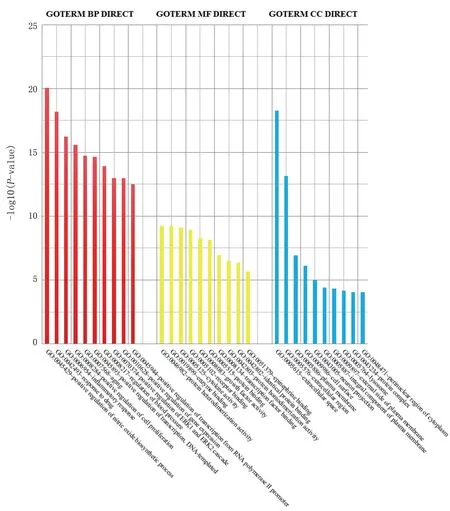
图4 丹参治疗缺血性脑卒中核心靶标GO 分类图
结合KEGG 通路富集分析及文献研究结果见图5,丹参治疗缺血性脑卒中可能通过以下信号通路发挥作用,包括TNF 信号通路、神经活性配体-受体相互作用、T 细胞受体信号通路、细胞因子-细胞因子受体相互作用、环磷酸腺苷(cAMP)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、Toll 样受体信号通路、Ras信号通路、造血细胞系以及细胞凋亡等,提示丹参治疗缺血性脑卒中是通过多途径效应机制发挥疗效的。
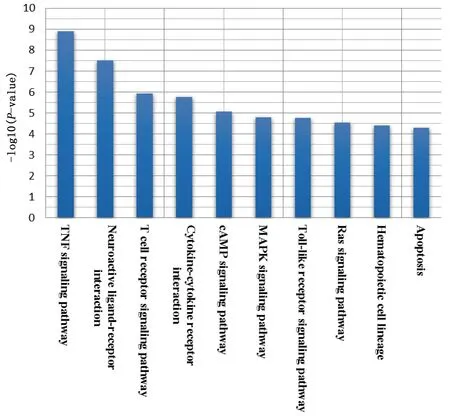
图5 丹参治疗缺血性脑卒中核心靶标KEGG 通路富集图
3 讨 论
中药丹参在我国得到广泛的应用,尤其在心脑血管领域,如冠心病、高血压、急性缺血性脑卒中等[21]。本研究通过BATMAN-TCM 数据库,共获得中药丹参化学成分38 个,其中包括丹参素、丹参酚、丹参酚酸类、丹参酮类、丹参醌类、咖啡酸等化合物。动脉新生和侧支循环增加是脑卒中病人恢复再灌注和预后的重要因素。研究表明,丹参素可以增加血管内皮生长因子(VEGF)、基质源性因子-1(SDF-1)、脑源性神经营养因子(BDNF)和内皮型一氧化氮合酶(eNOS)的表达,增加卒中后侧支动脉的直径,促进局部脑血流恢复[22]。丹参酚酸具有较强的血小板凝聚作用,其可降低血液中血栓素B2(TXB2)水平,从而发挥抗积聚作用[23]。此外,研究还表明丹参酚酸B 具有抗炎、抗氧化、抗细胞凋亡等诸多作用,减轻脑缺血性损伤,改善神经功能缺失症状[24]。此外,相关研究也表明丹参酮ⅡA 可通过抑制炎性反应及细胞凋亡发挥神经保护作用,降低脑梗死体积及神经功能缺损评分[25-26]。
网络拓扑特征分析表明,丹参治疗缺血性脑卒中与IL-6、TNF、TP53、SRC、IL-1β、FOS、PTGS2、EDN1、JUN、IL-10 等靶标密切相关。免疫炎症反应在缺血性脑卒中的发生发展中具有重要作用。IL-6 在急性期炎症反应中具有重要地位,研究表明,急性缺血性脑卒中发生后,释放的IL-6 可通过N-甲基-D-天冬氨酸(NMDA)受体的激活,上调内皮素-1(ET-1)和JUN 的表达,介导海马区神经元的死亡以及脑自动调节能力的受损[27]。脑卒中后IL-6 水平与磁共振弥散加权成像(MR-DWI)中急性损害面积、脑灌注缺损、最终梗死面积等参数密切相关[28],并且IL-6 也与脑卒中病人感染(如肺部感染)呈独立相关,对预测病人是否发生感染具有参考价值[29]。TNF-α具有活化小胶质细胞,促进黏附及趋化因子表达的作用,进而提高炎性相关细胞的迁移能力,是缺血性脑卒中后神经细胞损伤的关键原因之一[30]。此外,动物研究发现,对于TNF 受体基因缺乏小鼠,脑缺血后的脑梗死体积和脑损伤程度均明显高于野生型小鼠,这一定程度上提示TNF 具有一定的神经保护作用[31]。SRC 是一种具有酪氨酸蛋白激酶活性的蛋白质,其可通过氧化还原作用,调节缓激肽、偶联因子6、血管内皮生长因子等,改变血管的结构和功能,在心脑血管疾病如高血压、脑卒中中发挥重要作用[32]。IL-1β是重要的炎症反应细胞因子之一,其可启动白介素1(IL-1)受体,进而激活核因子κB(NF-κB)、JUK、MAPA 等炎性相关通路,产生IL-6 等促炎细胞因子,造成局部脑组织损伤[33]。
在生物学过程方面,本研究发现丹参治疗缺血性脑卒中与一氧化氮生物合成过程的正调控、炎症反应、衰老、血压调节、ERK1 和ERK2 级联的正调节、基因表达正调控等过程相关。近年来,一氧化氮作为一种气体信号分子逐渐为大家所认识,其主要生理功能包括维持血管张力、减少炎症反应、维持血栓-溶栓系统平衡以及调节细胞生长等[34]。一氧化氮与脑卒中关系密切,一氧化氮的产生主要来源于诱导型一氧化氮合酶(iNOS)、神经元型一氧化氮合酶(nNOS)以及eNOS。其中,eNOS 在缺血性脑卒中早期及晚期起着脑保护作用,研究表明,一氧化氮作为一种自由基通过修饰线粒体功能,降低线粒体功能障碍,从而介导缺血再灌注损伤后的细胞保护作用[35]。炎症反应贯穿缺血性脑卒中的整个过程。脑卒中发生后,病灶组织中损伤或死亡的神经细胞会释放损伤相关模式分子,进而激活炎症反应的发生,早期炎症反应的发生会加重脑肿胀的发生以及氧化应激反应,进而造成继发性的脑损伤[36]。衰老是脑卒中发生的重要因素之一,研究表明随着年龄的增长,脑卒中危险因素逐渐增加,并且心血管疾病的风险累积效应也不断上升,这导致了缺血性脑卒中的发生及发病风险显著提高[37]。此外,高血压是导致脑卒中发生的高危因素之一[38],多项研究证实,对脑卒中病人及时进行降压治疗,能明显降低脑卒中的复发率及血管事件的发生率[39]。
结合相关文献研究,本研究结果显示丹参治疗缺血性脑卒中可能通过TNF 信号通路、神经活性配体-受体相互作用、T 细胞受体信号通路、cAMP 信号通路、MAPK 信号通路、Toll 样受体(TLR)信号通路以及细胞凋亡等信号通路发挥疗效。TNF-α主要表达于巨噬细胞、自然杀伤细胞、T 细胞以及B 细胞,中枢神经系统中的神经元及胶质细胞也可以表达TNF-α。研究表明,急性缺血性脑卒中病人血清中TNF-α水平会升高,并且与病人神经功能的缺损程度和梗死范围密切相关[40]。此外,TNF-α 可诱导促炎型小胶质细胞形成,参与了缺血性脑损伤的发生[41]。丹参酚酸B 可抑制星形胶质细胞和小胶质细胞的过度激活,降低TNF-α的表达,发挥脑保护作用,从而缩小脑梗死面积,并改善神经功能[42]。T 细胞受体在T 细胞功能的发挥和免疫突触的形成中起着重要作用,其可激活许多信号级联发生,调节细胞因子的产生、细胞的增殖和分化等。通过比较动脉粥样硬化、脑梗死、心肌梗死病人中TCR 表达情况,研究者发现体内T 细胞受体信号通路表达下降是其共性的变化,而DNA 甲基化是导致TCR 信号下调的关键调节因子[43]。cAMP 是细胞内重要的第二信使之一,其通过激活PKA 信号通路,介导cAMP 反应元件结合蛋白CREB,调节神经元再生突触的形成,发挥脑保护作用[44]。缺血性脑卒中发生后,MAPK 可被激活,对神经细胞凋亡起着重要作用[45]。抑制MAPK 信号通路,可减少神经细胞凋亡,减轻脑组织损伤[46]。Toll 样受体是参与非特异性免疫中重要的一类蛋白质分子,研究表明,缺血后小胶质细胞及神经元细胞中TLR2 的表达升高,而敲除TLR2 基因后的小鼠则神经细胞的损伤减轻,并且白细胞及小胶质细胞的浸润亦减少[47]。
综上所述,本研究通过网络药理学分析方法,阐述了中药丹参治疗缺血性脑卒中的多成分、多靶点、多途径的效应机制,为进一步的实验研究和临床实践提供一定参考依据和思路。中药丹参可通过调控IL-6、TNF、SRC、IL-1β、JUN、IL-10 等关键靶标,参与一氧化氮生物合成、炎症反应、衰老、血压调节等生物学过程,抑制缺血性脑卒中后神经组织的坏死、凋亡,发挥脑保护作用,改善神经功能;其作用机制涉及TNF 信号通路、cAMP 信号通路、MAPK 信号通路、Toll 样受体信号通路等。然而,本研究尚存在一定的局限性,药物成分的理化特性以及剂量和煎服法对疗效结果的影响未能进一步阐述。因此,本研究结果仍需进一步研究证实。
