姜荷花品种红火炬的组织培养技术
2021-03-25王健蓉陈桂玲杨碧兰郑丹虹
陈 丽 王健蓉 陈桂玲 杨碧兰 郑丹虹
(汕头市农业科学研究所,广东 汕头 515021)
姜荷花(Curcuma alismatifoliaGagnep.)属姜科、姜黄属多年生球根草本植物,原产于泰国清迈一带。姜荷花花形独特,花色鲜艳,花期长,因其苞片酷似荷花而得名[1]。作为一种新型的花卉种类,姜荷花是姜黄属植物中极具观赏性的高档鲜切花之一,是国际上流行的鲜切花材料,其在“花卉王国”荷兰常作为一种稀有高档的花卉品种,被誉为“热带郁金香”,既可丰富我国的高档鲜切花品种,也可作为盆栽观赏或应用于园林绿化,观赏价值较高,品质优良,具有很高的经济效益,开发利用前景广阔。姜荷花的花期一般在夏秋季,正好可以弥补此时其他花卉资源相对较少的空缺,在园林应用方面有着十分明显的优势[2]。姜荷花生长快,一般在种植后100 d左右开花;栽培容易,管理简便;其对栽培环境大多没有特殊要求,掌握好栽培季节和水肥管理方法,即可保证其正常生长和开花。姜荷花主要在海南省、广东省和福建省种植,且规模不大,有很大的发展空间。红火炬株高35 cm左右,5片叶同时开花,花形似火炬,花序长19 cm,苞片约90枚,苞片深红色,黄色小花生于苞片腋部,花形独特,花色艳丽,而且粗生易种,抗病力强[3]。其观赏部位主要为苞叶,上部苞片观赏价值高,紫红色,下部苞片深红色,与花序轴合成蜂窝状排列。单支花作切花时观赏期约15 d[4]。目前,只能用常规的球根对其进行培养繁殖,但这种方法繁殖速度慢且种球品质下降,不能满足市场需求。采用组织培养快速繁殖技术,可获得优质整齐的种苗,能够为红火炬的种苗快速繁殖开辟一条有效途径,但目前关于红火炬的组织培养相关研究未见报道。
之前的试验存在以下问题:①由于多采用地下根茎上生长的顶芽或芽作外植体进行组织培养,消毒灭菌较难,组织培养污染率较高;②不定芽的繁殖系数较低;③生产的组培苗根茎较细长,质量下降且生长缓慢。本试验通过催芽和在MS培养基中进行无菌培养,降低了组织培养过程中的污染率,同时以MS培养基为基础,通过不同的处理方式与外源激素,实现了红火炬组织培养中根茎的快速生长。该方法操作简单、根茎的快速生长效果显著。本试验中利用组培快繁技术,对红火炬进行离体组织培养,通过快速繁殖获得红火炬种苗,以满足市场需求[5]。选用健康、壮实的红火炬的花轴作为外植体,比较不同处理方式、不同激素及浓度对其丛生芽诱导、增殖、分化、壮苗生根的影响,探索适合的培养方法,达到快速获得大量种苗的目的。
1 材料与方法
1.1 材料准备
选取健壮、无病虫害的红火炬花轴,先用75%的酒精擦拭其表面灰尘。在超净工作台上将长段的材料于无菌盘中切成3段,针对3段材料分别采用不同的处理方式,比较不同处理方法的污染率及死亡率:①置于三角瓶中用0.1%升汞溶液浸泡消毒6 min后用无菌水冲洗3次,再用0.1%升汞溶液浸泡消毒3 min后用无菌水冲洗3次;②用0.1%升汞溶液浸泡消毒10 min后用无菌水冲洗3次,再用0.1%升汞溶液浸泡消毒5 min后用无菌水冲洗3次;③用0.1%升汞溶液浸泡消毒15 min后用无菌水冲洗3次,再用0.1%升汞溶液浸泡消毒8 min后用无菌水冲洗3次。处理过程中应持续振荡或摇晃,使红火炬的花轴与消毒液充分接触,将处理好的外植体置于无菌盘中,用过滤纸擦干水分,剥去表面红色鳞片,鳞片切除后将材料切成长1.0~1.5 cm、宽1.0~1.5 cm、厚0.5 cm的小块外植体[6]。
1.2 诱导培养
诱导培养基设定为6种,每瓶培养基中的基质为蔗糖25.0 g/L、琼脂5.5 g/L,pH值为5.5~5.8。使用圆菌(103.4 kPa、121 ℃、20~30 min,下同),将外植体接于下列诱导培养基中:①MS+6-BA 0 mg/L;②MS+6-BA 2 mg/L;③MS+6-BA 4 mg/L;④MS+6-BA 6 mg/L;⑤MS+6-BA 8 mg/L;⑥MS+6-BA 10 mg/L。每瓶培养基接种三四块,每种培养基接种10瓶,室温(26±2) ℃黑暗培养40 d后观察诱导情况[7]。
1.3 继代培养
不同激素6-BA浓度对继代增殖的影响。将诱导出的不定芽分成单株,分别接种于下列继代培养基中:①MS+6-BA 0 mg/L;②MS+6-BA 2 mg/L;③MS+6-BA 4 mg/L;④MS+6-BA 6 mg/L;⑤MS+6-BA 8 mg/L;⑥MS+6-BA 10 mg/L。每瓶培养基接种三四个芽,每种培养基接种10瓶。培养30 d后,调查芽的增殖情况[8]。
1.4 生根培养
将继代培养中的芽分成单株,分别接种于下列生根培养基中:①MS+ NAA 0 mg/L;②MS+ NAA 0.2 mg/L;③MS +NAA 0.4 mg/L;④MS+ NAA 0.6 mg/L;⑤MS+NAA 0.8 mg/L;⑥MS+ NAA 1 mg/L。每瓶培养基接种三四个芽,每种培养基接种10瓶。培养30 d后,统计生根条数[9]。
1.5 炼苗和栽培
将经过生根培养的玻璃瓶苗放入玻璃棚(光照低于7 000 lx),进行驯化培养20 d后,选取高6~9 cm、有三四片叶、根5条以上的瓶苗洗净,泡药5 min后晾干,植入5 cm深栽培基质泥炭土塑料杯中,露天栽培14 d根系强壮后,可下地栽培。
2 结果与分析
2.1 不同消毒灭菌时间对姜荷花外植体诱导污染率、成活率和死亡率的影响
外植体经过消毒灭菌,黑暗培养40 d后,由表1可知,第一种处理方式灭菌时间较短,污染率100%;第二种方式效果相对合适,达到45%的成活率;第三种处理方式灭菌时间较长,死亡率100%,外植体全部失活。因此,把握外植体的灭菌处理方式对外植体污染率与死亡率有较大影响。
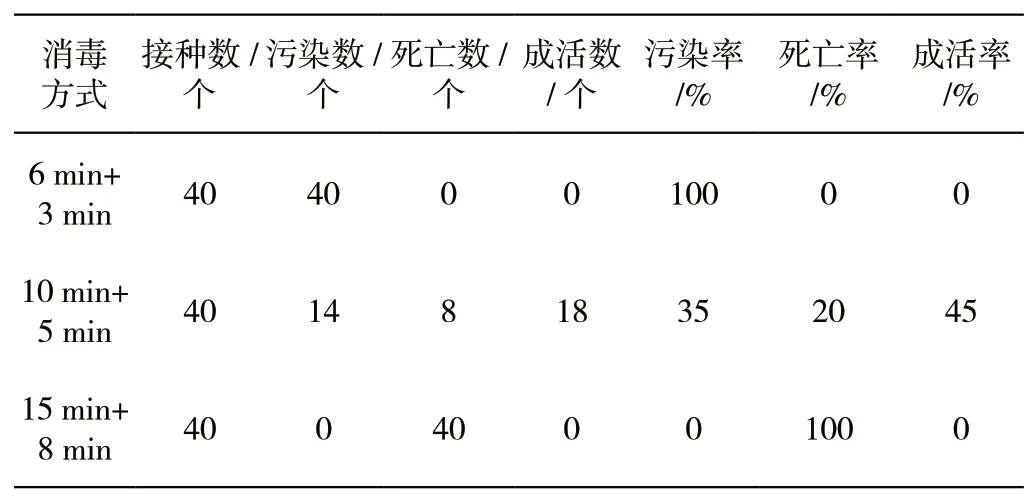
表1 不同外植体处理方式的污染率与死亡率
2.2 不同6-BA浓度对诱导率的影响
外植体经过培养40 d后,由表2可知,当6-BA浓度低于8 mg/L时,外植体未进行分裂生产,诱导率为0;6-BA浓度在8 mg/L时,不定芽较短且难伸长,效果不理想,诱导率为2.5%;6-BA浓度在10 mg/L时的外植体诱导率较高,诱导率达到30%,不定芽的效果最理想(如图1所示)。因此6-BA浓度10 mg/L培养基较适合外植体的诱导。

图1 单芽诱导成功情况
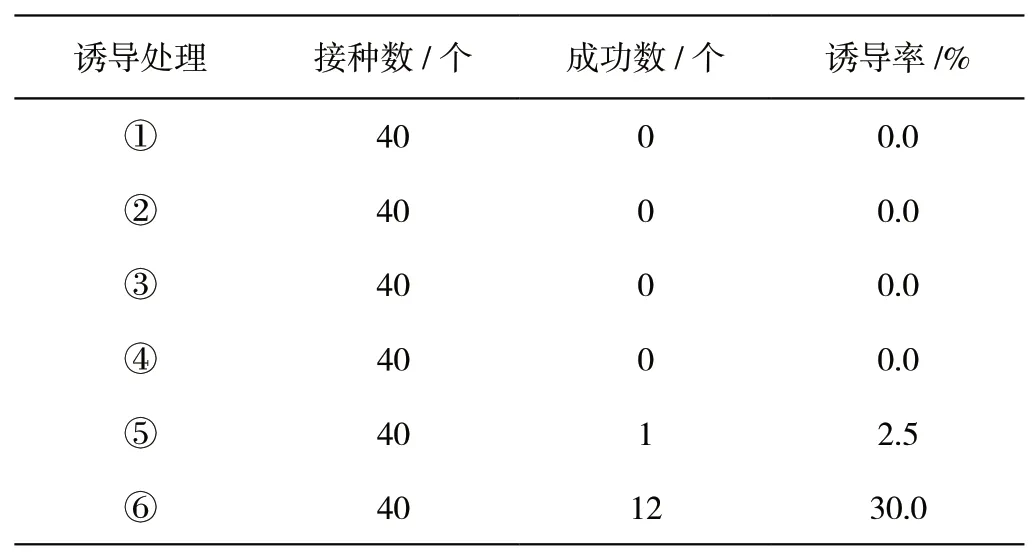
表2 不同培养基对诱导率的影响
2.3 不同6-BA浓度对继代增殖的影响
不定芽经过培养30 d后,由表3可知,不定芽在不同6-BA浓度的培养基上,20 d后可见丛芽长出。30 d后调查,6-BA浓度大于6 mg/L时增殖效果好(如图2所示),芽的增殖率约为3.6且芽的状态良好,可用于生根培养。随着6-BA浓度的增加,芽的数量增多,当6-BA浓度大于6 mg/L时,芽的增殖缓慢,芽的增长率与浓度为6 mg/L时持平。

表3 不同培养基对继代增殖的影响
图2 单芽增殖情况
2.4 不同NAA对生根培养的影响
芽苗经过培养30 d后,在不同NAA浓度的培养基中均能生根。由表4可知,根的数量随NAA浓度的提高而增加,NAA浓度小于0.2 mg/L时生根条数较少,平均每株生根数为5条。NAA浓度大于0.2 mg/L时生根条数比较多,且根系强壮、数量较多,平均每株生根数为11条。当NAA浓度大于0.2 mg/L时,生根条数与NAA浓度为0.2 mg/L时持平。

表4 不同培养基对生根培养的影响
2.5 栽培技术要点
红火炬喜温暖、湿润的环境,喜欢较充足的光照,适宜的遮光有利于植株长高和花茎抽长。红火炬喜排水良好、富含有机质的沙质弱酸性土壤,生产适温为25~32 ℃,夜温为20~22 ℃,切花生产时采用地栽方式。各种有机物质都可以用作姜荷花的栽培基质。要求基质结构粗糙,且富含有机质、渗水性好(见图3)。

图3 幼苗在基质中生长
3 小结与讨论
试验结果表明,不同的处理方式与外源激素培养基对红火炬不定芽的生长具有一定影响。采用10 min+5 min的0.1%升汞溶液消毒方式比较适合,污染率与死亡率较低;当6-BA浓度为10 mg/L时,诱导效果较好,诱导出的不定芽最理想。当6-BA浓度为6 mg/L时,增殖效果较好;且随着6-BA浓度增加至10 mg/L时增殖的效果与6-BA浓度为6 mg/L时持平。当NAA浓度为0.2 mg/L时,生根效果较好且根系强壮。红火炬通过花轴的组织培养,可提高增殖率,且生长良好,规格统一,对规模化商品化生产具有一定的指导作用。笔者初步探索了姜荷花工厂化快速育苗的方法,为姜荷花优良新品种的保存和快速繁育提供了可行途径。
