VCC-1在胰腺癌组织中的表达及意义
2021-03-25宋剑锋白明辉
宋剑锋 白明辉



【摘要】 目的:探討血管内皮生长因子相关性趋化因子-1(VCC-1)在胰腺癌组织中的表达及意义。方法:应用免疫组织化学方法测定VCC-1在52例胰腺癌及52例对应癌旁正常胰腺组织中的表达情况,并分析VCC-1和胰腺癌临床相关指标之间的关系。结果:VCC-1蛋白在胰腺癌组织中阳性表达率为76.92%高于癌旁组织的28.85%,差异有统计学意义(P<0.05)。VCC-1在Ⅰ、Ⅱ期胰腺癌组织的阳性表达率为69.23%(27/39)低于Ⅲ期的100%(13/13),差异有统计学意义(P<0.05)。VCC-1在有淋巴结转移的阳性表达率为91.67%(22/24)高于无淋巴结转移的64.29%(18/28),差异有统计学意义(P<0.05)。VCC-1在肿瘤直径≤2 cm中的阳性表达率为60.71%(17/28),低于肿瘤直径>2 cm的95.83%(23/24),差异有统计学意义(P<0.05)。VCC-1在低分化癌中的阳性表达率为83.33%(10/12),在中分化癌中的阳性表达率为87.88%(29/33),在高分化中的阳性表达率为14.29%(1/7),差异有统计学意义(P<0.05)。VCC-1与患者的年龄、性别及肿瘤部位无关(P>0.05)。VCC-1阴性表达组PC患者的中位生存期为26.9个月长于阳性表达组的16.3个月,差异有统计学意义(P<0.05)。结论:VCC-1在胰腺癌组织中呈高表达,VCC-1的表达可能在胰腺癌的发生、发展中起重要作用。
【关键词】 胰腺肿瘤 血管内皮生长因子相关性趋化因子-1 肿瘤标记
Expression and Significance of VCC-1 in Pancreatic Cancer Tissue/SONG Jianfeng, BAI Minghui. //Medical Innovation of China, 2021, 18(23): -163
[Abstract] Objective: To investigate the expression and significance of VCC-1 in pancreatic cancer tissue. Method: The VCC-1 expressions in 52 specimens of pancreatic cancer tissues and 52 specimens of their adjacent normal pancreatic tissues were determined by immunohistochemical staining, and the relationship between VCC-1 and clinical indicators of pancreatic cancer were analyzed. Result: The positive expression rate of VCC-1
protein in pancreatic cancer tissues was 76.92%, higher than 28.85% in paracancer tissues, the difference was statistically significant (P<0.05). The positive expression rate of VCC-1 in stage Ⅰ, Ⅱ pancreatic cancer tissues was 69.23% (27/39), which was lower than 100% (13/13) in stage Ⅲ, the difference was statistically significant (P<0.05). The positive expression rate of VCC-1 with lymph node metastasis was 91.67% (22/24), which was higher than 64.29% (18/28) without lymph node metastasis, the difference was statistically significant (P<0.05). The positive expression rate of VCC-1 in tumor diameter ≤2 cm was 60.71% (17/28), which was lower than 95.83% (23/24) in tumor diameter >2 cm, the difference was statistically significant (P<0.05). The positive expression rate of VCC-1 in low differentiation carcinoma was 83.33% (10/12), the positive expression rate of VCC-1 in medium differentiation carcinoma was 87.88% (29/33), and the positive expression rate of VCC-1 in high differentiation carcinoma was 14.29% (1/7), the difference was statistically significant (P<0.05). VCC-1 was not associated with age, gender or tumor site (P>0.05). The median survival time of PC patients in VCC-1 negative expression group was 26.9 months, which was longer than 16.3 months in positive expression group, the difference was statistically significant (P<0.05). Conclusion: The VCC-1 expression is increased in pancreatic cancer and its expression may be closely connected to the occurrence and development of pancreatic cancer.
[Key words] Pancreatic neoplasms VEGF correlated chemokine-1 Tumor markers
First-author’s address: Foresea Life Insurance Guangzhou General Hospital, Guangzhou 511300, China
doi:10.3969/j.issn.1674-4985.2021.23.039
胰腺癌(pancreatic cancer,PC)早期症状不明显,且发展快,预后差,其5年生存率为8%,有淋巴结转移者5年生存率为3%[1-8]。目前PC被诊断时多为中晚期,手术切除是最有效的治疗方法,但复发率比较高[9-13]。而导致PC发生和进展是多种基因及因素共同作用的结果[14]。已经有研究表明血管内皮生长因子相关性趋化因子-1(vsacular endothelial growth factor correlated chemokine 1,VCC-1)與乳腺癌、直肠癌及肝细胞癌的发生、发展有关[15]。笔者通过试验研究VCC-1在PC中的表达及意义,现报道如下。
1 材料与方法
1.1 材料与试剂 选取本院2019年10月-2020年
2月及郑州大学附属洛阳中心医院2011年2月-2019年12月存档的PC组织蜡块52例及与其相对应的癌旁正常胰腺组织52例。其中男38例,女14例;年龄32~77岁,平均(56.40±2.02)岁;TNM分期:Ⅰ期11例,Ⅱ期28例,Ⅲ期13例。病理分级:高分化癌7例,中分化癌33例,低分化癌12例。所有入选的PC患者术前均没有接受放疗、化疗及生物治疗等,均可以找到完整的临床病例资料。鼠抗人VCC-1单克隆抗体购自美国R&D Systems公司,兔抗人VEGF单克隆抗体试剂盒和通用型二抗PV-6000购自北京中杉金桥生物技术有限公司。PBS缓冲液,DAB显色试剂盒及抗原修复液均购自福州迈新生物技术开发有限公司。其他试剂及设备均由郑州大学附属洛阳中心医院提供。
1.2 方法 免疫组化采用Elivision二步法,将蜡块制成3 μm厚度的切片,常规脱蜡、脱水;室温放置10 min以灭活内源性酶;加pH=6.0的柠檬酸盐缓冲液中档微波处理10 min;加1滴3%的H2O2阻断内源性过氧化物酶10 min;加一抗(1︰100稀释)室温孵育2 h;PBS冲洗;加亲和素1滴,室温孵育2 h;PBS冲洗;加羊抗兔IgG二抗,室温孵育2 h;DAB显色5 min;苏木素复染2 min;脱水、透明,封片,阅片。
1.3 结果判定 每张切片随机取5个视野,每个视野计数100个左右细胞,在相同放大倍数(×400)及光强度等的条件下由两位经验丰富的病理科医师阅片判定。将细胞膜或细胞质出现棕黄色颗粒定义为阳性。根据阳性细胞数及染色强度进行综合判定。
1.4 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计数资料以率(%)表示,比较采用χ检验;采用log-rank的统计检验比较VCC-1阴性组和阳性的中位生存期;采用GraphPad Prism绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
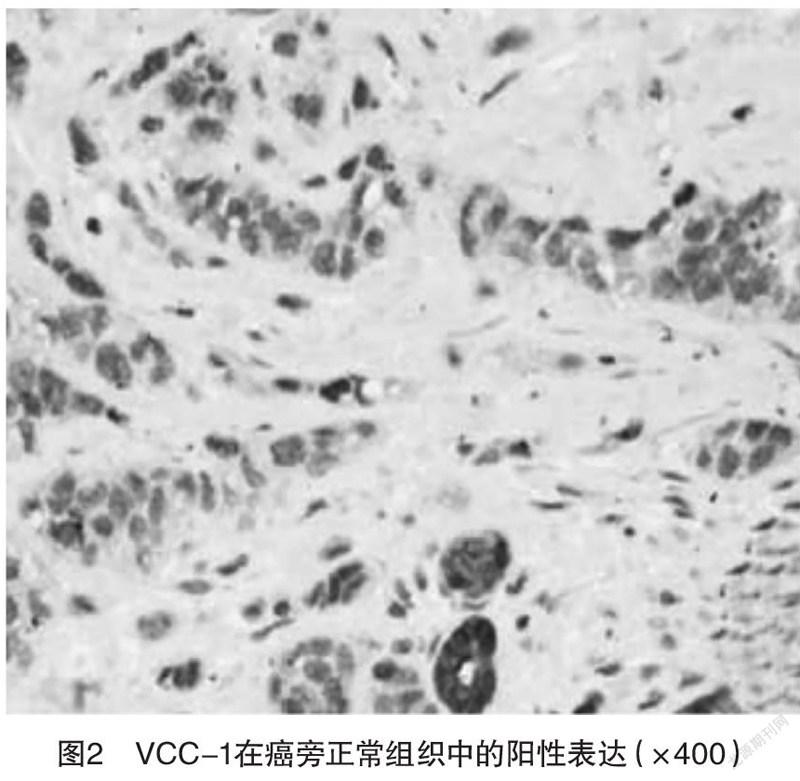
2.1 VCC-1在PC组织及癌旁组织中的表达 阳性颗粒为棕黄色,位于细胞质或细胞膜中,VCC-1在胰腺癌组织中的表达比在癌旁组织中强,见图1、2。VCC-1蛋白在胰腺癌组织中阳性表达率为76.92%高于癌旁组织的28.85%,差异有统计学意义(χ=24.12,P<0.05),见表1。
2.2 VCC-1表达与PC临床相关指标的关
系 VCC-1在Ⅰ、Ⅱ期胰腺癌组织的阳性表达率为69.23%(27/39)低于Ⅲ期的100%(13/13),差异有统计学意义(P<0.05)。VCC-1在有淋巴结转移的阳性表达率为91.67%(22/24)高于无淋巴结转移的64.29%(18/28),差异有统计学意义(P<0.05)。VCC-1在肿瘤直径≤2 cm中的阳性表达率为60.71%(17/28),低于在肿瘤直径>2 cm中的95.83%(23/24),差异有统计学意义(P<0.05)。VCC-1在低分化癌中的阳性表达率为83.33%(10/12),在中分化癌中的阳性表达率为87.88%(29/33),在高分化中的阳性表达率为14.29%(1/7),差异有统计学意义(P<0.05)。VCC-1与患者的年龄、性别及肿瘤部位均无关(P>0.05)。见表2。
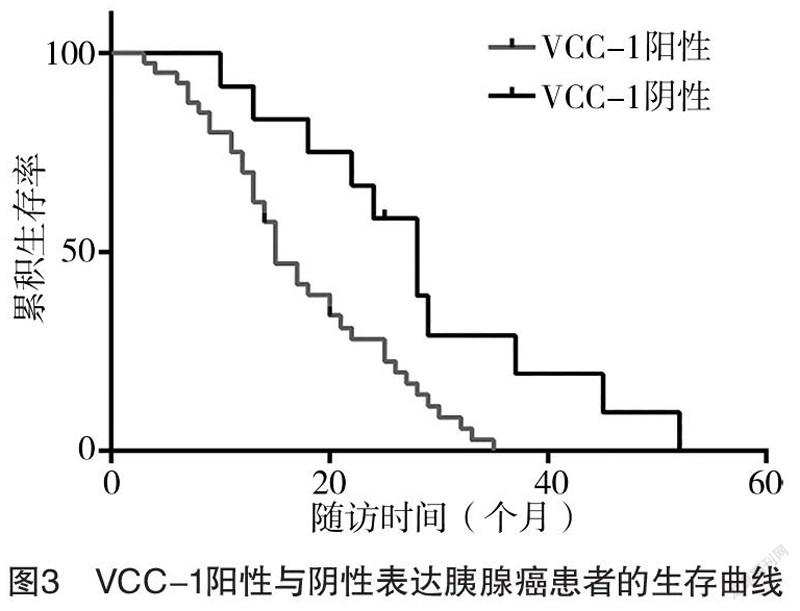
2.3 VCC-1表达与PC患者的远期预后的关系 在40例VCC-1阳性表达的PC患者随访中失访2例,在12例VCC-1阴性表达的PC患者随访中失访1例。VCC-1阴性表达组PC患者的中位生存期为26.9个月,长于阳性表达组的16.3个月,差异有统计学意义(χ=7.62,P<0.05)。见图3。
3 讨论
VCC-1基因编码119个氨基酸,有6个半胱氨酸残基,其中有4个分别位于2个CXC结构域,其包括4个外显子,15 kb大小,位于人19q11染色体上[16-17]。研究表明,VCC-1通过上调VEGF-A表达,来参与新生血管的形成,进而促进肿瘤的转移及进展[17]。
本研究结果显示,VCC-1蛋白在胰腺癌组织中阳性表达率为76.92%高于癌旁组织的28.85%,差异有统计学意义(P<0.05)。说明VCC-1可能作为一种促癌基因导致了PC的发生。VCC-1在低分化癌中的阳性表达率为83.33%(10/12),在中分化癌中的阳性表达率为87.88%(29/33),在高分化中的阳性表达率为14.29%(1/7),差异有统计学意义(P<0.05)。说明VCC-1参与了PC的增殖及分化。VCC-1在VCC-1在Ⅰ、Ⅱ期胰腺癌组织的阳性表达率为69.23%(27/39)低于Ⅲ期的100%(13/13),差异有统计学意义(P<0.05)。VCC-1在有淋巴结转移的阳性表达率为91.67%(22/24)高于无淋巴结转移的64.29%(18/28),差异有统计学意义(P<0.05)。VCC-1在肿瘤直径≤2 cm中的阳性表达率为60.71%(17/28),低于在肿瘤直径>2 cm中的95.83%(23/24),差异有统计学意义(P<0.05)。VCC-1与患者的年龄、性别及肿瘤部位无关(P>0.05)。提示VCC-1促进了PC的发展、侵袭及转移。研究已经证实,VEGF与多种恶性肿瘤的发生、发展及侵袭有关[18-20]。笔者推测VCC-1的高表达上调了VEGF的表达,进而导致肿瘤新生血管的形成,来促进肿瘤的发展、侵袭及转移。VCC-1阴性表达的胰腺癌患者的中位生存期长于阳性表达患者,差异有统计学意义(P<0.05)。说明VCC-1是PC患者预后的一个独立危险因素。
综上所述,VCC-1在PC的发生、发展、侵袭中发挥着重要作用。在PC患者中VCC-1的阳性表达提示预后不良。
参考文献
[1]王奕智,郭俊超.胰腺癌基础研究新进展[J].中华实验外科杂志,2019,36(4):599-602.
[2]刘梦奇,吉顺荣,徐晓武,等.2019年胰腺癌研究及诊疗新进展[J].中国癌症杂志,2020,30(1):1-8.
[3]沈臻,郭世伟,金钢.胰腺癌临床研究进展:从“切除”到“治愈”[J].中华外科杂志,2019,57(1):72-76.
[4]钟志惟,殷香保.胰腺癌的分子靶向治疗研究进展[J].中国普通外科杂志,2016,25(9):1351-1355.
[5] Kuroczycki S S,Grzeszczuk A,Zwierz Z W,et al.Prevention of pancreatic cancer[J].Contemporary Oncology (Pozn),2017,21(1):30-34.
[6]白雪莉,梁廷波.胰腺癌综合治疗新进展[J].中华消化外科杂志,2019,18(7):634-639.
[7]陈小艳,贾建新.胰腺癌侵袭转移作用机制的研究进展[J].天津医药,2018,46(8):899-904.
[8] Siegel R L,Miller K D,Jemal A.Cancer statistics,2019[J].CA Cancer Journal Clinicians,2019,69(1):7-34.
[9] Zhang L,Sanagapalli S,Stoita A.Challenges in diagnosis of pancreatic cancer[J].World Journal Gastroenterology,2018,24(19):2047-2060.
[10] Benzel J,Fendrich V.Chemoprevention and treatment of pancreatic cancer:update and review of the literature [J].Digestion,2018,97(4):275-287.
[11]杨尹默.胰腺癌外科治疗的现状、存在问题与展望[J].中国普通外科杂志,2016,25(9):1231-1235.
[12]杨永超,李宜雄.胰腺癌外科治疗的历史和现状[J].中国普通外科杂志,2018,27(3):269-280.
[13]白雪莉,李想,梁廷波.可切除胰腺癌新辅助治疗进展及争议[J].中华外科杂志,2020,58(7):486-489.
[14] King J,Bouvet M,Singh G,et al.Improving theranostics in pancreatic cancer[J].Journal Surgical Oncology,2017,116(1):104-113.
[15]黄帆,耿小平,朱立新,等趋化因子VCC-1在肝细胞癌中的表达及其意义[J].中华肝胆外科杂志,2011,17(12):994-997.
[16]牟霞,李明.siRNA沉默新趋化因子VCC-1抑制SMMC7721肝癌细胞体外克隆形成能力和体内成瘤性[J].中国免疫学杂志,2013,29(4):347-349.
[17]刘振生,赵红川,黄帆.VCC-1在肝癌患者血、尿和癌组织中的表达及其意义[J].肝胆外科杂志,2014,22(6):471-473.
[18] Fujii T,Hirakata T,Kurozumi S,et al.VEGF-A is associated with the degree of TILs and PD-L1 expression in primary breast cancer[J].In Vivo,2020,34(5):2641-2646.
[19] Shen X C,Zhan S H,Xu S T,et al.Prognostic and clinicopathologic significance of PAQR3 and VEGF-A expression in pulmonary adenocarcinoma[J].International Journal Clinical Experimental Pathology,2020,13(7):1676-1681.
[20] Mei X,Shu J,Huang R,et al.Expression of VEGF,CD73 and their relationship with clinical pathology,microvessel density,and prognosis in renal cell carcinoma[J].Translation Andrology Urology,2020,9(3):1366-1373.
(收稿日期:2020-09-15) (本文編辑:张明澜)
