与稻瘟病抗性基因Pigm紧密连锁的分子标记的设计和应用
2021-03-24朱先飞张志清李婧婧
朱先飞 张志清 李婧婧


摘 要:利用已克隆的Pigm基因的核酸序列在基因功能区设计新引物,鉴定到不育系材料FD1712的功能区序列差异,开发了基于PCR的新的插入/缺失(insert-deletion, InDel)标记,标记与基因功能紧密连锁。通过扩增和电泳检测,表明引物扩增稳定;通过稻瘟病菌的接种鉴定,表明新开发的标记能有效鉴别稻瘟病抗性,可用于分子标记辅助育种。
关键词:水稻;稻瘟病;抗性基因;分子标记辅助育种
中图分类号 S435.111.4+1;S503.53文献标识码 A文章编号 1007-7731(2021)04-0020-04
Abstract: Using the nucleic acid sequence of the cloned Pigm, new primers were designed in the gene functional region to identify the difference of functional region sequence of sterile line FD1712, and a new insert deletion (indel) marker based on PCR was developed, which was closely linked with gene function. The results of amplification and electrophoresis showed that the primer amplification had stable polymorphism. The results of inoculation and identification of Magnaporthe grisea showed that the newly developed markers could effectively identify blast resistance and could be used in molecular marker assisted breeding.
Key words: Rice; Rice blast; Resistance gene; Molecular marker assisted selection breeding
水稻是世界上最重要的糧食作物之一,全球约50%的人口都以稻米为主食[1]。稻瘟病是由子囊菌(Magnaporthe oryzae)引发的水稻真菌性病害,是一种世界性的水稻病害,严重威胁着水稻的高产、稳产[2]。我国稻瘟病的年发生面积均在380万hm2以上,由稻瘟病导致的水稻减产量占总产的10%~30%[3]。实践表明,解决稻瘟病危害最有效、最经济环保的策略是发掘和利用广谱持久抗性基因,选育和推广抗病品种[4,5]。分子标记辅助选择(Marker-assisted selection,MAS)育种技术具有可靠、高效、安全等优点,在植物分子育种实践中,尤其是作物个别性状改良中应用越来越广泛[6]。
利用与基因连锁(或基因内)标记,在育种过程中对目标单株进行标记基因型鉴定和选择,尤其是共显性分子标记还能有效鉴定纯合基因型,可大大提高育种效率,缩短育种周期,常用于连续回交育种定向改良受体目标性状,是现代分子育种的重要手段[7,8]。显性广谱持久抗瘟基因Pigm来源于四川地方水稻品种谷梅4号,已被克隆[9],被广泛证明是非常有效的稻瘟病抗性基因,利用其育成和改良了多个水稻品种[10-12]。
1 材料与方法
1.1 水稻材料 携带抗性基因Pigm的谷梅4号是四川省农业科学院植物保护研究所选育的常规籼稻,FD1712是安徽丰大种业选育的优良不育系,但是在稻瘟病高感地区表现感病。本研究以谷梅4号和FD1712分别为供体和受体材料,以及谷梅4号×FD1712的F1、F2为测试材料。
1.2 DNA提取 采用碱煮法提取[13],切取1/10的水稻籽粒胚乳,加入40mL的0.2mol/L氢氧化钠水溶液,在100℃条件下水浴3min,再加入60mL的0.17mol/L tris-HCL,在100℃条件下水浴1min,取出后置于4℃冰箱备用。
1.3 PCR扩增 含Mg2+的10x Buffer 2μL,10mmol的dNTP 0.4μL,5μmol的如SEQ ID NO:3所示的核苷酸序列和5μmol的如SEQ ID NO:4所示的核苷酸序列各2μL,从待测水稻中提取的基因组DNA 1μL,5U/μL的taq酶0.5μL,其余为超纯水,反应体积为20μL,滴加1滴矿物油覆盖;PCR扩增反应程序为:94℃、5min,94℃、60s,53.5℃、60s,72℃、60s,35个循环;72℃、10min。
1.4 聚丙烯酰胺电泳、银染和记录 用6%的聚丙烯酰胺变性凝胶电泳检测PCR产物,主要包括3步:(1)制胶:称取9.6g尿素,加45mL蒸馏水和8mL 10×TBE,搅拌溶解,加入12mL 40%丙烯酰胺溶液,混匀后加入0.8mL 10%过硫酸胺和35?L TEMED,搅拌均匀后立即注入已用琼脂糖凝胶封口的玻璃板中,注满后倾斜放置。插入梳子,静置,使胶凝固;(2)点样:待胶完全凝固后,小心拔出梳子,尽量保持点样孔完整。将玻璃板固定垂直电泳槽上,加入适量的1×TBE电泳缓冲液;取PCR扩增产物,每管PCR产物中加入4?L上样缓冲液(0.25%溴酚蓝、0.25%二甲苯氰、50%甘油),混匀后用微量进样器吸5?L注入点样孔;(3)电泳:调电压至200V,电泳时间3~4h。
电泳完毕后,将玻璃板从电泳槽上拆下,取出凝胶,在蒸馏水中漂洗2次;转移至0.1% AgNO3溶液中染色,在摇床上轻摇约10min;然后将凝胶转移至蒸馏水中漂洗2次;最后转入显色液(6g氢氧化钠、0.076g四硼酸钠、1.6mL甲醛,加水定容至400mL)中显色约10min,着色后用水漂洗2次,终止显色反应并去除附着的显色液。用凝胶成像系统记录结果。
1.5 引物设计
1.5.1 双亲基因组扩增和测序 采用碱煮法提取谷梅4和FD1712叶片的基因组DNA,以Yiwen Deng[9]公布的序列设计引物,由核苷酸序列5′-gccgatgccgattctagccg-3,和核苷酸序列5,-gagttcaaggaggatacgac-3,组成,委托北京梓熙生物公司合成后进行PCR扩增。PCR扩增产物送北京梓熙生物公司进行测序。
1.5.2 引物设计 测序结果在NCBI网站进行在线比对,结果见图1。图中虚线区域表示20bp的缺失,其中query代表父本谷梅4,高抗稻瘟病的序列;sbjct代表母本FD1712,不抗稻瘟病的序列,说明FD1712在此区域少了20bp碱基。根据图1的测序比对结果,利用在线引物设计软件Primer3.0设计引物,在跨越2个序列有20bp插入缺失差异区域设计引物。设计完成的新引物命名为Pigm-1712,上游引物核苷酸序列为5′-ggacctaaccgatgcaacac-3′,下游引物核苷酸序列为5′-ttgttcaaggctgcattgct-3′。委托北京梓熙生物公司合成。上游引物和下游引物均位于基因Pigm内部功能区域。
1.6 稻瘟病病菌接种与调查 种子浸种催芽后分别播种于32孔塑料垫板中,育苗基质为盆栽花卉培养基,幼苗在26~28℃的人工气候室内12h光照、12h黑暗培养至3~4叶期。采用混合生理小种约1×105/mL浓度的稻瘟菌孢子悬浮液活体喷雾接种,于26℃黑暗保湿24h后,继续保持光照高湿5~7d,参照Bonman[14]的0~5级标准调查病情(0~2级为抗病,3~5级为感病)。接种结果见图2,左边为感病材料,发病明显;右边为抗病材料,表现抗病。
2 结果与分析
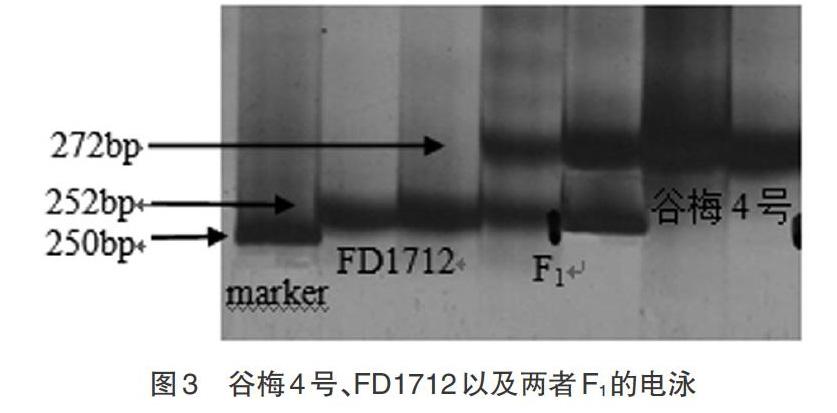
2.1 引物效果验证 利用新合成的引物扩增谷梅4和FD1712,以及两者的杂交种F1。PCR扩增产物用6%聚丙烯酰胺凝胶电泳分析,快速银染法染色并观察拍照,如图3所示。FD1712、谷梅4和杂交种各2个重复,Marker大小为250bp。对PCR扩增产物进行测序,从扩增产物的电泳图可以清晰看出,谷梅4只有1条电泳带,经测序所述电泳带对应的扩增产物为272bp碱基片段;FD1712只有1条电泳带,经测序所述电泳带对应的扩增产物为252bp碱基片段;杂交品种有2条电泳带,经测序所述电泳带对应的扩增产物为272bp和252bp碱基片段(图3)。由此可见,新设计的引物扩增效果好,电泳带型清晰无杂带,引物可用于2种基因型的鉴别。
2.2 扩增产物与水稻稻瘟病抗性性状的相关性 以高抗稻瘟病材料谷梅4和不抗稻瘟病材料FD1712作亲本,两者杂交后自交的432个F2 代材料为试验对象。PCR扩增产物用6%聚丙烯酰胺凝胶电泳分析,银染法染色并观察拍照记录,其中纯合272bp的105株,纯合252bp的97株,杂合带型的220株,同时对这432株材料进行接种鉴定。由表1可知,供试水稻样本中存在纯合272bp的105株,其中102株表现为抗病,3株感病;而不帶有272bp片段的97个材料中92株感病,5株抗病;杂合的220株中,216株表现为抗病,4株感病;两者的一致性达到97.1%。由此可见,新设计的引物Pigm-1712是与稻瘟病抗性性状相关位点紧密连锁的分子标记,完全可用于水稻分子标记辅助育种。
3 结论与讨论
分子标记辅助选择育种以其准确、快速且不受环境影响等优点,已被广泛应用于作物育种实践中[15-17],在水稻稻瘟病抗性分子育种方面已成功选育出多个优良抗病新品系或新材料[18-20]。水稻稻瘟病抗性是典型的质量数量性状,易受环境影响,常规育种中的表型选择往往不准确,育种效率低。分子标记辅助育种是通过标记基因型分析和选择代替表型选择,可大大提高选择准确性和育种效率[21]。Pigm是一个广谱抗稻瘟病基因,比公认的广谱抗性基因Pi1、Pi2、Pi3的抗谱更广。Pigm的供体谷梅4号对收集自不同地区和国家的30个强致病菌株中的29个表现高抗或免疫[22]。何祖华团队自2002年开始广泛筛选抗瘟种质,从起源于我国农家品种的育种材料中鉴定了1个广谱抗瘟性新位点Pigm。利用Pigm选育的品种就既有广谱抗病性又不影响最终的产量[9]。
本研究中设计的分子标记位于抗性基因Pigm的基因内部,与水稻稻瘟病抗性基因Pigm紧密连锁。与非基因内部标记相比,新设计的InDel分子标记不会与基因功能出现分离,可以更有效地提高育种效率。本研究中设计的分子标记可以很好地扩增经过简单处理所得到的从待测水稻中提取的基因组,克服了现有技术中与该基因紧密连锁的其他分子标记需要依靠CTAB等较为繁琐的方法提取基因组的问题,更加简便实用,进一步提高了育种效率。本研究筛选获得的分子标记在 F1群体中的抗瘟表型选择效率达97.1%。由于稻瘟病菌具有多样性和快速变异性,导致抗病水稻品种在不同环境条件下表现出抗瘟性的不稳定[23]。实践证明,将多个抗菌谱不同的抗瘟基因聚合到同一个水稻品种中,是培育广谱持久抗瘟品种的有效策略[24]。本研究中选用的抗病亲本谷梅4号虽然抗瘟性较强,抗菌谱较广,但也存在极少数基因与接种抗性不一致的情况,推断其原因是由于生理小种不同引起,因此今后可尝试加强Pigm基因与其他广谱抗瘟基因(如Pi9、Pi2等)的分子聚合育种工作。
参考文献
[1]杨勤忠,林菲,马淑杰,等.水稻稻瘟病抗性基因的分子定位及克隆研究进展[J].中国农业科学,2009,42(5):1601-1615.
[2]姚南,罗安才,赵正武,等.利用Pi-1基因邻近SSR标记鉴定稻瘟病抗性[J].分子植物育种,2010,8(5):861-866.
[3]吴俊,刘雄伦,戴良英,等.水稻广谱抗稻瘟病基因研究进展[J].生命科学,2007,19(2):233-238.
[4] Zeigler RS,Tohme J,Nelson J,et al. Linking blast popula-tion analysis to resistance breeding: A proposed strategy for durable resistance[A]. In: Zeigler RS,Leong SA,Teng PS. Rice Blast Disease [C]. Wallingford,UK: CAB International and IRRI,1994:16-26.
[5]Fomba SN,Taylor DR. Rice blast in West Africa: its na-ture and control [A].In: Zeigler RS,Leong SA,Teng PS. Rice Blast Disease [C].Wallingford,UK: CAB Inter-national and IRRI,1994:343-355.
[6]冯建成.分子标记辅助选择技术在水稻育种上的应用[J].中国农学通报,2006,22(2):43-47.
[7]危文亮,赵应忠.分子标记在作物育种中的应用[J].生物技术通报,2000(2):12-16.
[8]冯建成.分子标记辅助选择技术在水稻育种上的应用[J].中国农学通报,2006,22(2):43-47.
[9]Yiwen Deng, Keran Zhai, Zhen Xie,et al.Epigenetic regulation of antagonistic receptors confers rice blast resistance with yield balance[J].Science,2017,355(6328):962.
[10]梁毅,杨婷婷,谭令辞,等.水稻广谱抗瘟基因Pigm紧密连锁分子标记开发及其育种应用[J].杂交水稻,2013,28(4):63-68,74.
[11]向聪.分子标记辅助选择改良水稻骨干不育系和恢复系稻瘟病抗性[D].长沙:湖南农业大学,2018.
[12]赵国超,王冬翼,张珍,等.分子标记辅助选育含有抗稻瘟病基因和软米基因两系不育系水稻新品系[J].上海师范大学学报(自然科学版),2019,48(5):591-596.
[13]付求来,吴洁,朱先飞,等.不同碱煮时间对玉米快速提取DNA效果的影响[J].安徽农学通报,2019,25(12):22-24.
[14]Bonman JM,Vergel D,Dios TI,et al. Physiologic speciali-zation of Pyricularia oryzae in the philippines [J].Plant Dis,1986,70:767-769.
[15]陈志伟,郑燕一,吴为人,等抗稻瘟病基因Pi-2(t)紧密连锁的SSR标记的筛选与应用[J].分子植物育种,2004,2(3):321-325.
[16]Fjellstrom Robert,McClung Anna M,Shank Robert.SSR markers closely linked to the Pi-z locus are useful for selection of blast re-sistance in a broad array of rice[J].Molecular Breeding,2006,17(2):149-157.
[17]Hayashi K,Yoshida H,Ashikawa I.Development of PCR-based allele-specific and InDel marker sets for nine rice blast resistance genes[J].Theoretical and Applied Genetics,2006,113(2):251-260.
[18]Yokoo Masao.Introduction of Piz-t and Pib genes for blast disease resistance from indica varieties and their utilization for genetic re- searches in rice[J].Japan Agricultural Research Quarterly,2005,39(4):239-245.
[19]姜潔锋,兰玉,牟同敏.抗稻瘟病水稻光温敏核不育系华1037S的选育[J].杂交水稻,2014,19(2):11-12,62.
[20]李伟荣,李永青,黄春毓,等.优质水稻光温敏核不育系昌S的选育与应用[J].杂交水稻,2020,35(3):26-29.
[21]行璇,刘雄伦,陈海龙,等.分子标记辅助选择Pi9基因改良R288的稻瘟病抗性[J].作物研究,2016,30(5):287-292.
[22]Y Deng,X Zhu,Y Shen,et al. Genetic characterization and fine mapping of the blast resistance locus Pigm(t) tightly linked to Pi2 and
Pi9 in a broad-spectrum resistant Chinese variety[J].Theoretical and Applied Genetics, 2006, 113(4):705-713.
[23]莫惠栋.p×q交配模式的配合力分析[J].江苏农学院学报,1982(3):51-57.
[24]罗志祥,丁超尘,陈多璞,等.几个水稻不育系的亲和性及配合力、遗传力研究[J].安徽农业科学,1999(5):425-428.
(责编:徐世红)
