HPLC 法测定曲安奈德益康唑乳膏中的有关物质
2021-03-24郭盛合
郭盛合
华润三九(南昌)药业有限公司,江西 南昌 330012
曲安奈德益康唑乳膏,每克分别含曲安奈德1.0 mg 和硝酸益康唑10 mg,曲安奈德为肾上腺皮质激素类药,具有抗炎抗过敏作用,硝酸益康唑为咪唑类抗真菌药,两者联合用于治疗伴有真菌感染或有真菌感染倾向的皮炎、湿疹;由皮肤癣菌、酵母菌、霉菌所致的炎症性皮肤真菌病;由真菌、细菌所致的皮肤混合感染等。目前国外药典均未收载曲安奈德益康唑乳膏,《中国药典》二部(2015 年版)[1]已收载但无有关物质检查项。因此,笔者参考各国药典原料药质量标准和相关文献[2-12],建立了高效液相色谱法(HPLC)梯度洗脱测定曲安奈德益康唑乳膏中有关物质的方法,以便更好地控制产品的质量。
1 材料
1.1 仪器
Waters e2695 高效液相色谱仪、梅特勒XS205电子分析天平、S220B 酸度计。
1.2 药品与试剂
曲安奈德益康唑乳膏[华润三九(南昌)药业有限公司,国药准字 H20074155,规格:1 g ∶曲安奈德1 mg ∶硝酸益康唑10 mg,批号:161201、161202、161203];曲安奈德杂质A(即曲安西龙,编号E-Y0001459)、曲安奈德(编号100055)、硝酸益康唑(编号100214)、苯甲醇(编号100419)均为中检院对照品,曲安奈德杂质B(编号T-T-5318)、曲安奈德杂质C(编号L-MM0198.05)、硝酸益康唑杂质A(编号T-I-292)、硝酸益康唑杂质B(编号T-E-543)、硝酸益康唑杂质C(编号T-E-544)均为TLC 标准品。
甲醇、乙腈均为色谱纯,其他试剂为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱以十八烷基硅烷键合硅胶为填充剂(Kromasil 100-5 C18,4.6 mm×250 mm,5 μm),柱温为45 ℃;以0.077%醋酸铵缓冲液(用磷酸调节pH 值至3.0)-甲醇(80∶20)为流动相A;甲醇-乙腈(40∶60)为流动相B;流速为1.0 mL/min;按下表进行梯度洗脱;检测波长为240 nm 和225 nm。
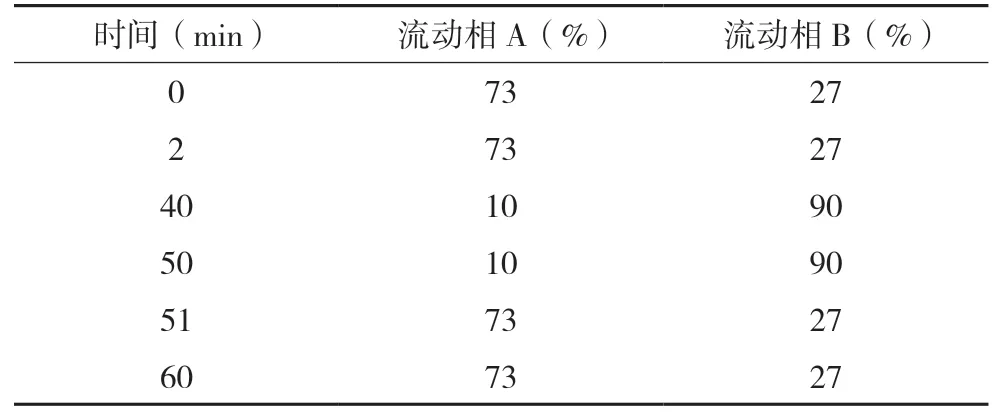
表1 HPLC梯度洗脱程序
2.2 系统适用性
另取本品于105 ℃干燥箱中放置2 h,取出后照供试品溶液制备法操作,作为系统适用性溶液。精密量取系统适用性溶液20 μL,注入液相色谱仪,记录色谱图,在240 nm 下曲安奈德峰保留时间约为15~17 min,在相对曲安奈德峰tR 约0.45 处应有杂质峰,该杂质峰与苯甲酸峰(相对曲安奈德峰tR约0.5)之间的分离度应不低于1.5。
2.3 溶液的制备
取本品,精密称定,置100 mL 具塞锥形瓶中,加入甲醇20 mL,60 ℃水浴加热并振摇使其溶解,冰浴30 min,趁冷滤过,取续滤液作为供试品溶液。精密量取供试品溶液1 mL,置100 mL 量瓶中,用甲醇稀释至刻度,摇匀,作为对照溶液。
2.4 测定法
精密量取供试品溶液、对照溶液各20 μL,分别注入液相色谱仪,记录色谱图。
结果判定:240 nm 下,供试品溶液色谱图中在相对曲安奈德峰保留时间约0.45 和0.88~1.16 间如有杂质峰,除曲安奈德峰外,单个杂质峰面积不得大于对照溶液曲安奈德峰面积的0.5 倍(0.5%),各杂质峰面积的和不得大于对照溶液曲安奈德峰面积的2.0 倍(2.0%);225 nm 下,供试品溶液色谱图中相对曲安奈德峰保留时间0.25~2.5 之间如有杂质峰,除溶剂梯度峰、苯甲酸峰(相对曲安奈德峰保留时间约0.5)、曲安奈德峰(15~17 min)、益康唑峰、二丁基羟基甲苯峰(相对曲安奈德峰保留时间约2.4)外,单个杂质峰面积不得大于对照溶液益康唑峰面积的0.2 倍(0.2%),各杂质峰面积的和不得大于对照溶液益康唑峰面积的1.0 倍(1.0%)。
2.5 辅料干扰及杂质定位分离试验
取主药双阴性样品、曲安奈德单方制剂样品、硝酸益康唑单方制剂样品、自制样品照2.3 供试品溶液的制备方法制成供试品溶液;另取曲安奈德及其已知杂质对照品、硝酸益康唑及其已知杂质对照品加甲醇溶解并稀释制成混合对照品溶液;另取自制样品供试品溶液加入混合杂质对照品溶液,制成加杂质的供试品溶液。精密吸取上述溶液各20 μL,注入液相色谱仪,记录色谱图,计算各峰分离度。
2.5.1 辅料干扰与杂质分离 供试品溶液和加杂质的供试品溶液有关物质色谱图见图1。

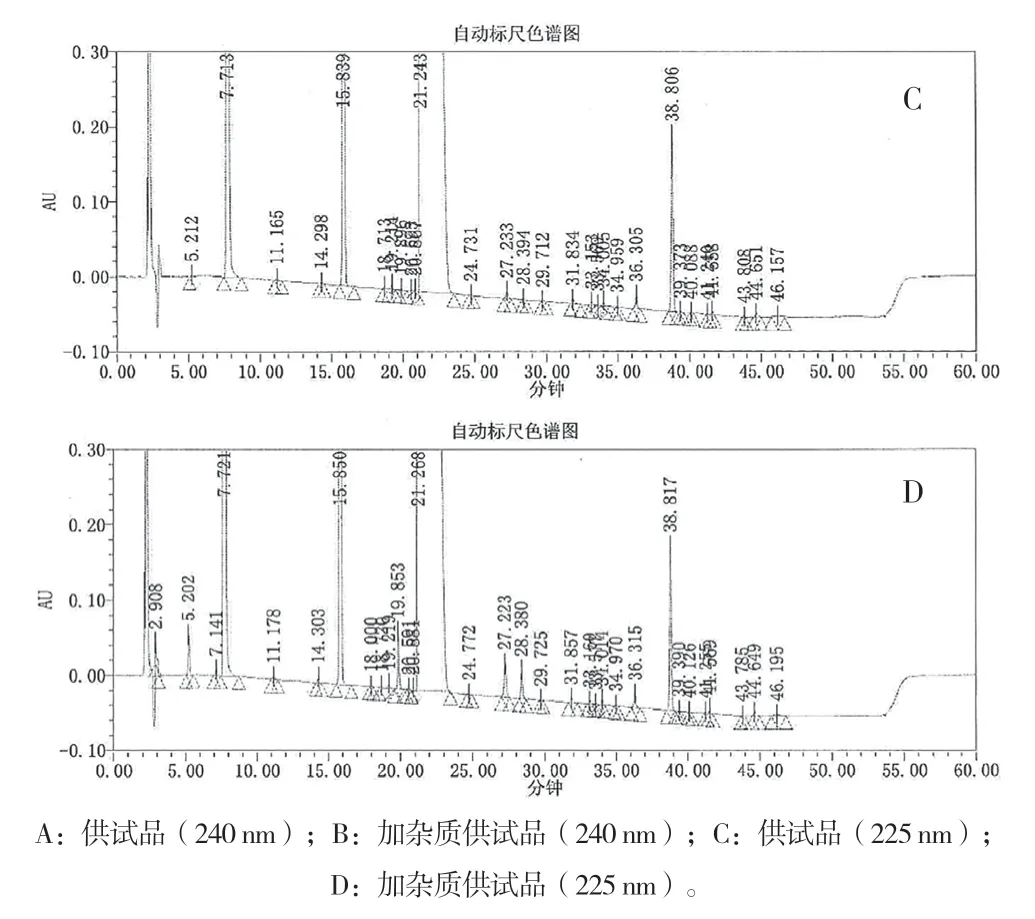
图1 供试品和加杂质供试品的有关物质色谱图
加杂质的供试品溶液在240 nm 下,阴性样品、硝酸益康唑及其杂质在曲安奈德主峰、曲安奈德杂质峰、硝酸益康唑单方制剂出峰位置处无色谱峰干扰,表明阴性样品、硝酸益康唑及其杂质色谱峰对曲安奈德及其杂质检测无干扰;曲安奈德及其杂质与相邻色谱峰分离度符合要求,表明240 nm 下曲安奈德及其杂质分离度良好,见表1。
加杂质的供试品溶液在225 nm 下,阴性样品、曲安奈德及其杂质(RRT 在0.45~0.70,0.90~1.18)在硝酸益康唑主峰、硝酸益康唑杂质对照品、硝酸益康唑单方制剂出峰位置处无色谱峰,表明对硝酸益康唑及其杂质检测无干扰;硝酸益康唑及其杂质与相邻色谱峰分离度大部分均符合要求。其中,仅在RRT 1.32 处杂质峰和益康唑峰的分离度为0.34,主要是硝酸益康唑浓度过载导致,但该杂质为非降解杂质,杂质量仅为0.01%,可以忽略不计。上述结果表明225 nm 下硝酸益康唑及其杂质分离度良好,见表2。
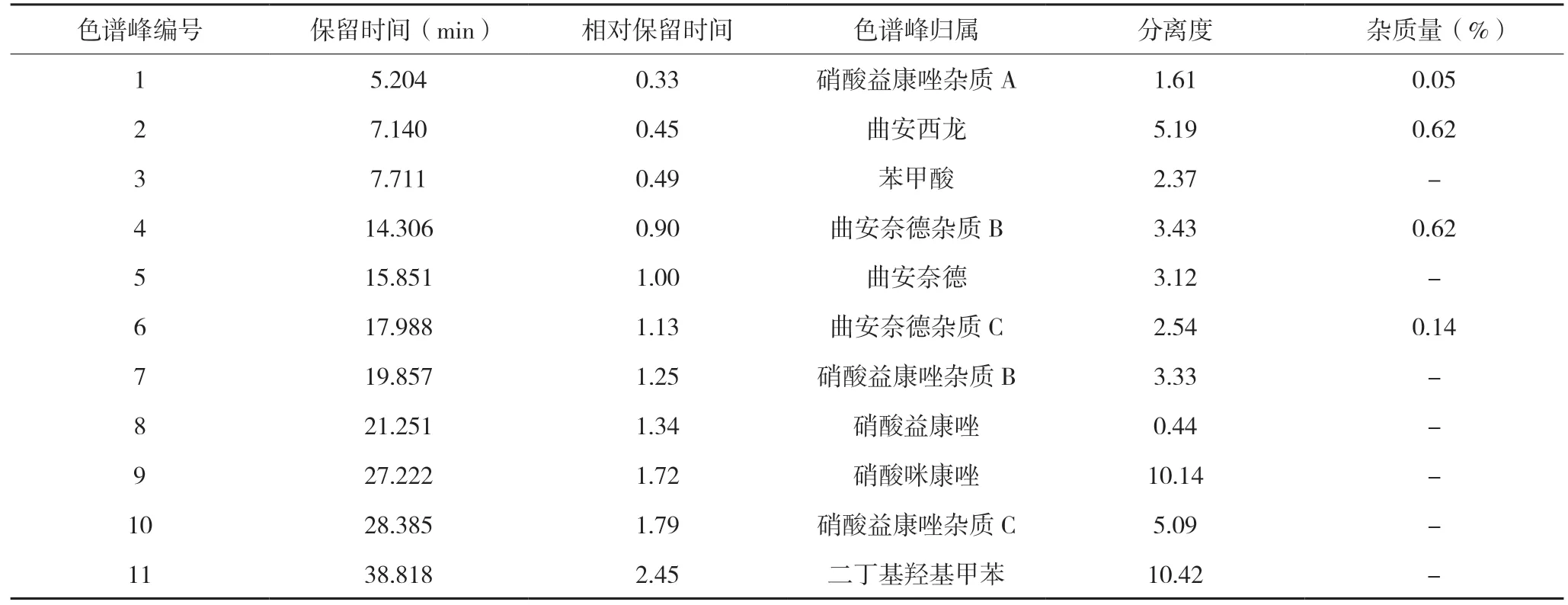
表1 加杂质的样品曲安奈德有关物质检查结果(240 nm)
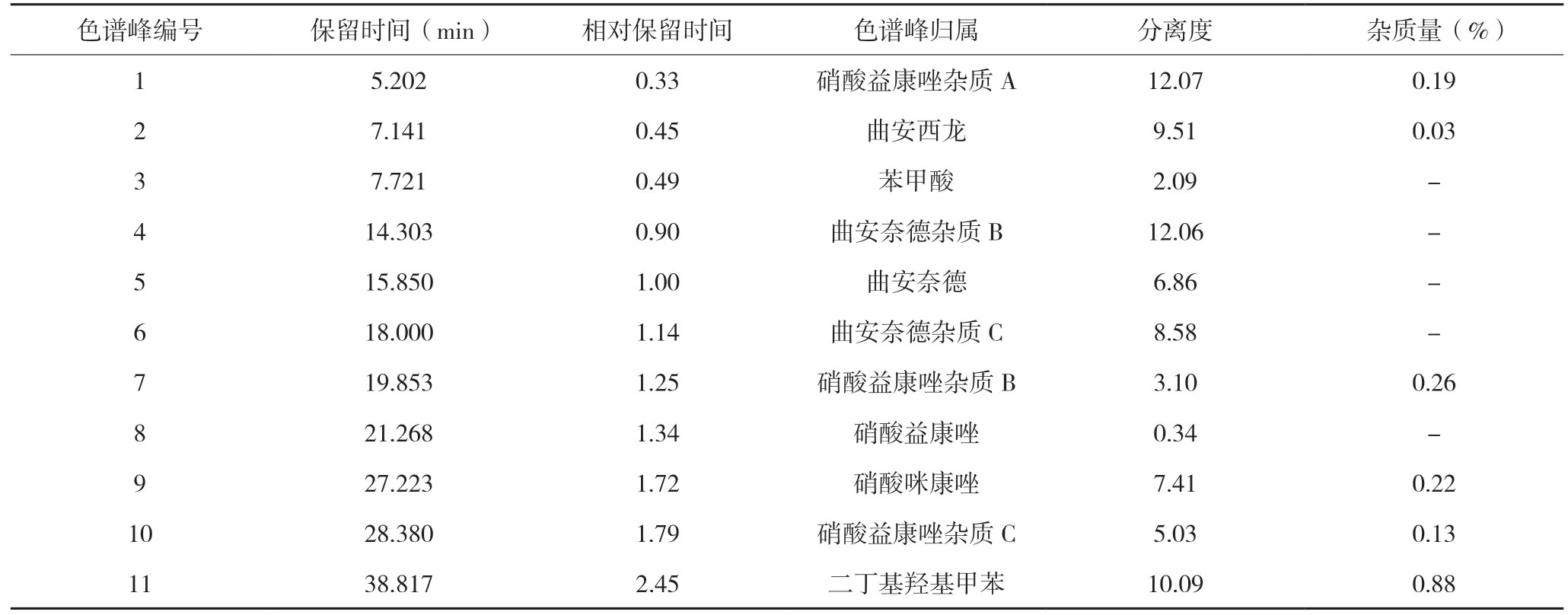
表2 加杂质的样品益康唑有关物质结果(225 nm)
2.5.2 杂质定位 对照品溶液杂质定位结果见表3。
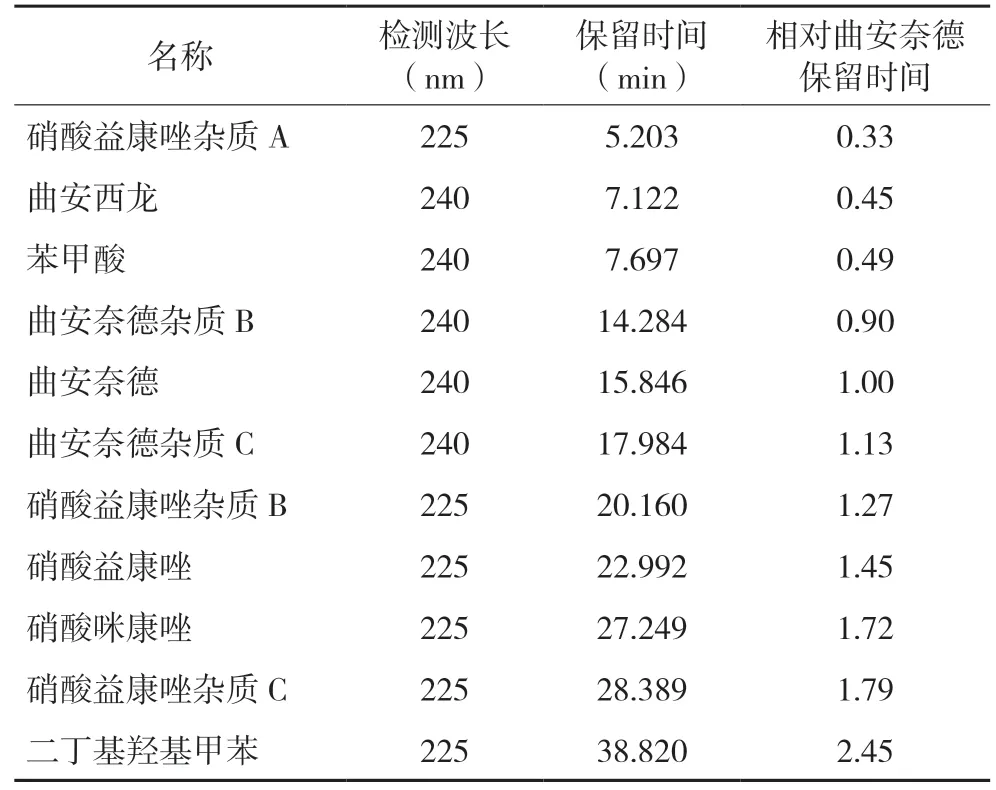
表3 杂质定位结果
该方法下曲安奈德和硝酸益康唑的杂质能被有效分离和检出,方法专属性良好。
2.6 检测限
分别取曲安奈德对照品溶液、硝酸益康唑对照品溶液、各单个已知杂质对照品溶液,逐级稀释,照拟定的有关物质检查法测定,直至对应的色谱峰信噪比符合规定,见表4。
曲安奈德1%对照溶液的进样量为0.1 μg,报告限度0.05%的进样量为5 ng;硝酸益康唑1%对照溶液的进样量为1 μg,报告限度0.05%的进样量为50 ng。由上表可知,硝酸益康唑各杂质检测限均低于报告限度,曲安奈德除杂质C 检测限浓度约相当于0.06%外,也均低于报告限度,表明本方法能有效检出已知杂质。
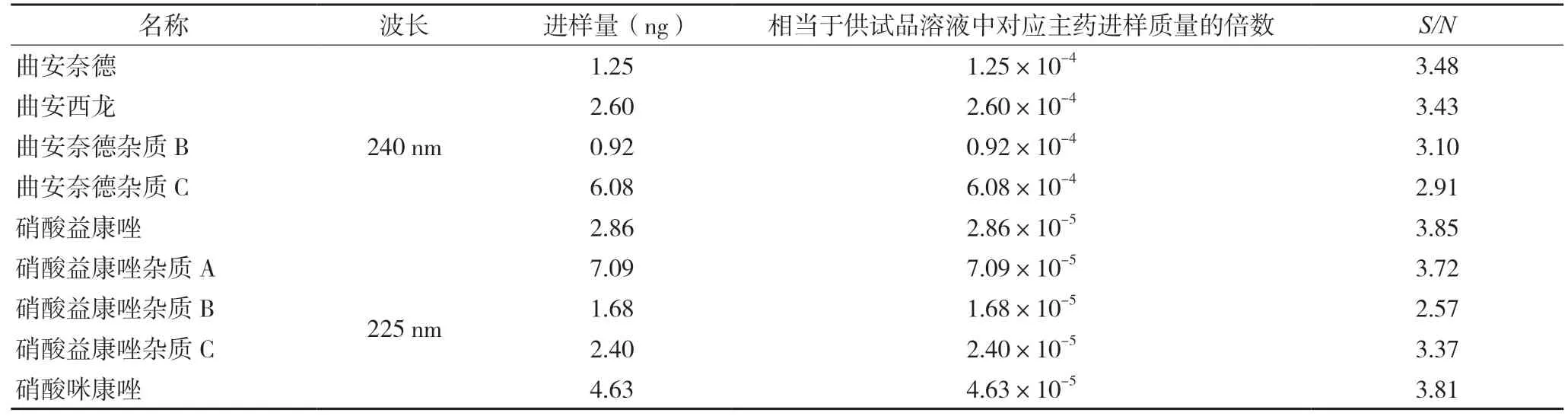
表4 检测限结果表
2.7 样品有关物质测定
采用主成分自身对照法测定样品中的有关物质。取3 批样品(30 ℃±2 ℃,65%±5% RH 加速试验6 个月),按照“2.3”项下方法制备供试品溶液和对照溶液。取上述供试品溶液、对照溶液和“2.2”项下系统适用性溶液适量,按“2.1”项下色谱条件进样。结果表明,3 批样品有关物质均符合规定,见表5。

表5 样品有关物质测定结果
3 讨论
3.1 供试品溶液浓度的确定
本品为复方制剂,曲安奈德和硝酸益康唑规格分别为0.1%和1%。查阅国内外药典同品种质量标准获悉,《中国药典》(2015 年版)曲安奈德原料药、注射剂、USP36 曲安奈德原料药有关物质检查项下供试品浓度均为0.5 mg/mL,进样体积20 μL;《中国药典》(2015 年版)、EP 8.0、BP 2013 硝酸益康唑原料药有关物质检查项下供试品浓度为10 mg/mL,进样体积10 μL。为确保供试品溶液进样质量与上述标准接近,经过实验考察,本品取样10 g,用甲醇20 mL 溶解,进样体积为20 μL 时,曲安奈德和硝酸益康唑进样质量与国内外标准相当(忽略基质体积下),且样品前处理简便。继续提高浓度,样品则无法除基质,无法操作。
3.2 供试品溶液处理方法的确定
本品首先采用加热法提取主药和杂质,取样品10 g,加甲醇20 mL,在60 ℃水浴下振摇,可使膏体溶解分散均匀。冰浴30 min 后,大量基质析出,此时趁冷用滤纸滤过可有效去除基质,减小对色谱柱的损害。由于该步骤基质较多,直接用0.45 μm过滤器难以滤过,故先用滤纸过滤。
3.3 系统适用性
本品曲安奈德主要降解杂质之一为曲安西龙,为曲安奈德高温降解产物(制剂在105 ℃加热2 h后生成约1%),其保留时间与本品中的防腐剂苯甲酸接近,两者最难分离(分离度约为1.5~2.0),故在系统适用性试验中规定曲安西龙与苯甲酸色谱峰之间的分离度不低于1.5。本品中曲安奈德和硝酸益康唑浓度相差10 倍,紫外吸收光谱差别较大,曲安奈德及其主要杂质最大吸收为240 nm,硝酸益康唑及其杂质最大吸收为200 nm 左右,在225 nm 左右有肩峰。国内外药典同品种有关物质检查项下,《中国药典》(2015 年版)曲安奈德原料药、注射剂采用240 nm 作为杂质检查波长,EP8.0 原料药则采用254 nm 为杂质检查波长。《中国药典》(2015 年版)、EP8.0 和BP2013 硝酸益康唑原料药均采用225 nm作为杂质检查波长,制剂多未收载有关物质检查或仅用TLC 法。因此,本品在方法开发过程中采用225、240、254 nm 三波长和190~400 nm 全波长扫描进行杂质研究。结果表明,曲安奈德在240 nm 下检出杂质个数最多,硝酸益康唑在225 nm 下检出杂质最多。故分别设定检测波长225 nm(硝酸益康唑杂质)和240 nm(曲安奈德杂质)。
3.4 杂质归属
本品有关物质检查方法开发过程按照复方制剂有关物质研究思路开展,采用原料药、单方、复方进行杂质谱研究,对产品在贮藏过程中可能产生的杂质进行了归属。对耐用性的考察结果显示,在确定的色谱条件下,各杂质分离良好,相对保留时间较为稳定。故采用相对保留时间法进行杂质定位。本品色谱检查中,溶剂、辅料、主药、杂质的出峰顺序和相对保留时间详见表6。

表6 色谱峰的出峰顺序和相对保留时间
3.5 限度
曲安奈德制剂仅有BP2013 鼻喷雾剂和《中国药典》(2015 年版)注射剂收载了有关物质检查项,BP2013 鼻喷雾剂规定任一色谱峰不得大于1%,《中国药典》(2015 年版)注射剂规定单杂不得过0.5%,总杂不得过1.5%。本品主要参考《中国药典》注射剂的要求,拟定曲安奈德单杂不得过0.5%,由于本品在40 ℃加速2 月时曲安奈德总杂已经接近1.0%,故拟定总杂不得过2.0%。
硝酸益康唑制剂国内外药典多未收载有关物质检查项,因此主要参考原料药有关物质限度规定[EP8.0 已知杂质不得大于0.2%,未知杂质不得过0.1%;《中国药典》(2015 年版)单杂不得大于0.2%],结合本品40 ℃加速2 月有关物质检查结果(单杂0.08%,总杂0.25%),拟定为:单杂不得大于0.2%,总杂不得大于1.0%。
综上所述,本方法灵敏、准确、专属性强、重复性好,可用于曲安奈德益康唑乳膏中有关物质的质量控制。
