高能聚焦超声联合超声引导下清宫术对剖宫产瘢痕妊娠患者月经恢复及再妊娠结局的影响
2021-03-23文颖王雪松张海静周子敬王建爽
文颖,王雪松,张海静,周子敬,王建爽
剖宫产瘢痕妊娠(caesarean scar pregnancy,CSP)临床表现不典型,易被误诊为早孕流产,使治疗延误或处理不当,随着妊娠的不断进展,发生大出血、子宫破裂等严重并发症甚至切除子宫的风险急剧升高。一经确诊,应尽快终止妊娠[1]。目前临床上已有多种CSP治疗策略,但迄今为止仍无最佳方案推荐[2]。高能聚焦超声(high intensity focused ultrasound,HIFU) 是一种利用聚焦超声精确消融治疗CSP而没有皮肤切口的无创疗法。有研究认为,HIFU 联合超声引导下清宫术能够为患者提供良好的预后[3]。本研究通过对HIFU与子宫动脉化疗栓塞术(uterine artery chemoembolization, UACE)的对比分析,探讨HIFU联合超声引导下清宫术治疗CSP的有效性和安全性。
1 对象和方法
1.1 研究对象
回顾性分析2013年1月至 2016年10月廊坊市第四人民医院CSP患者126例的临床资料,年龄22~46岁,平均(31.67±2.91)岁;剖宫产1次94例、2次31例、3次1例。纳入标准:① 有停经史和剖宫产史,伴或不伴阴道出血和腹痛。② 血β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-hCG)检查阳性(正常值:<50 U/L)。③ 孕周≤8 周。④ 腹部和/或阴道超声检查符合CSP诊断标准[4]:宫腔及宫颈管内无孕囊,子宫下段剖宫产切口瘢痕部位有孕囊声像或混合回声团,膀胱与孕囊间子宫肌层变薄、缺失,妊娠物四周血流丰富。⑤ 经磁共振成像确诊为Ⅱ型CSP,孕囊直径<6 cm。CSP分型标准[5]:Ⅰ型为子宫腔内孕囊存活型;Ⅱ型为子宫肌层内孕囊存活型;Ⅲ型为混合包块型、滋养细胞型。⑥ 术后病理检查提示子宫肌层内有绒毛植入或蜕膜组织;⑦ 未进行过相关药物或手术治疗。排除标准: ① Ⅲ型CSP病例。② 严重内外科疾病、凝血障碍、严重贫血。③ 药物过敏史、麻醉禁忌、声通道不通畅患者。④ 生命体征不稳定,伴发阴道或腹腔活动性出血、生殖道急性炎症等。治疗前患者对治疗方案充分知晓,按照患者自愿原则分为两组,采用HIFU病灶消融联合超声引导下清宫术治疗为HIFU组(80例),采用UACE预处理后超声引导下清宫术治疗为UACE组(46例)。
1.2 方法
1.2.1 HIFU组 采用海扶刀RJC 型聚焦超声治疗系统(重庆海扶医疗有限公司),超声照射集中于心管搏动处、孕囊种植部位、植入子宫肌层的绒毛组织等病灶区域,发射功率300~400 W,层间距 3~5 mm,频率由慢到快,行点-线-面照射。引导超声注视治疗区域的灰度变化,照射区域灰度增加提示该处病灶组织已凝固坏死,直至灰度弥漫至整个病灶[6]。术毕以盐水充盈、冷却膀胱。治疗后1~4 d行超声引导下清宫术。
1.2.2 UACE组 超声引导下,行右股动脉穿刺,将导管末端插入左髂内动脉后行数字减影血管造影,明确子宫开口位置后, 将导管置入子宫动脉主干。注入甲氨蝶呤,采用明胶海绵颗粒对子宫动脉进行栓塞。对侧子宫动脉行同法处理。根据病灶血供情况调整甲氨蝶呤用量(30~95 mg)[7]。双侧子宫动脉关闭成功(主干显影而分支不显影为关闭成功)后撤出导管及鞘,压迫止血并加压包扎,术后肢体制动12 h。术后复查血β-hCG及B 超,待血 β-hCG 水平明显下降和B 超提示孕囊处无明显血流信号时,行超声引导下清宫术。
1.3 观察指标
① 两组清宫术中出血量<100 mL比例、术后2周β-hCG 转阴率、住院费用、住院天数、治疗有效率。
② 疗效标准:术后2周血β-hCG转阴,超声检查宫腔内无妊娠物残留,为有效。需中转开腹行病灶或子宫切除术,为无效。术后进行2个月月经恢复情况、血β-hCG转阴率及术后并发症随访;术后3个月行输卵管造影检查输卵管是否通畅;对患者再次妊娠及CSP复发情况进行为期3年的电话随访。
1.4 统计学方法

2 结果
2.1 两组一般资料比较
两组年龄、孕龄、剖宫产次、距末次剖宫产时间、血β-hCG水平、孕囊直径等一般临床资料比较,差异无统计学意义(P>0.05),详见表1。
2.2 两组治疗后临床指标比较
两组均无子宫切除病例。HIFU组清宫术中出血量<100 mL比例高于UACE组,住院费用低于UACE组,差异均有统计学意义(P<0.05)。两组术后2周β-hCG 转阴率、住院天数、治疗有效率比较,差异无统计学意义(P>0.05),详见表2。
2.3 两组术后2个月月经恢复情况、血β-人绒毛膜促性腺激素转阴率及并发症发生率比较
术后2个月,HIFU组月经恢复正常率高于UACE组,差异有统计学意义(P<0.05);血β-hCG转阴率及并发症发生率比较,差异无统计学意义(P>0.05)。两组均未发生血栓、肺栓塞等严重并发症,详见表3。
2.4 两组术后输卵管通畅率及再妊娠结局比较
HIFU组术后1~2年内正常宫内妊娠26例,异位妊娠1例,复发性剖宫产瘢痕妊娠(recurrent cesarean scar pregnancy,RCSP)3例,2~3年正常宫内妊娠13例,异位妊娠1例;UACE组术后1~2年正常宫内妊娠3例,2~3年正常宫内妊娠10例,异位妊娠1例,RCSP 1例。HIFU组术后3个月输卵管通畅率、术后3年正常宫内妊娠率均高于UACE组,差异有统计学意义(P<0.05),详见表4。

表1 两组一般资料比较
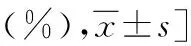
表2 两组治疗后临床指标比较[例

表3 两组术后2个月月经恢复正常率、β-hCG 转阴率及并发症发生率比较[例(%)]
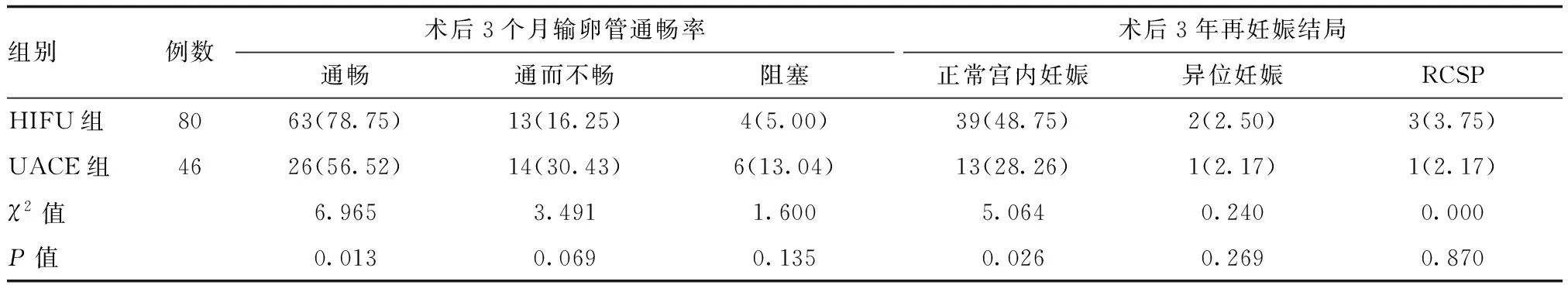
表4 两组术后3个月输卵管通畅率及术后3年再妊娠结局比较[例(%)]
3 讨论
UACE和HIFU是临床上广泛采用的CSP预治疗方法。UACE不仅可有效阻断CSP孕囊血供、减少术中出血,还能使滋养细胞失去血供而凋亡,促使胚胎坏死而具有治疗作用。因UACE治疗CSP的临床效果确切,目前已越来越多地应用于CSP 治疗,在国内治疗方案中已占到50%以上[8-9]。但该治疗方法存在术后发热、栓塞、不可逆闭经等并发症和严重感染导致子宫切除的风险[10],此外其对卵巢功能和生育能力可能产生潜在的不利影响[11-12]。
HIFU是利用超声波来切割病变组织,同时超声能量瞬间转化为热能,使病变组织发生凝固坏死并破坏其血供的一种微创疗法[13]。近年来随着HIFU在子宫肌瘤、子宫腺肌病等妇科良性疾病治疗中的应用成熟,逐渐用于CSP治疗。HIFU不仅可促使病变靶组织发生凝固坏死,还能有效破坏直径<200 μm的小血管[14]。而在消融治疗过程中,丰富的血流可降低组织的局部温度,不会对较大的血管造成损伤,因此HIFU消融既有预防术中出血的作用、又能避免生殖器官缺血性受损[15]。HIFU预处理后超声引导下清宫术是CSP 的一种安全有效的治疗方式,适用于β-hCG升高显著、病灶较大、血供丰富、有生育需求的育龄女性[16]。CSP的病灶经 HIFU消融处理后,孕囊可发生凝固性坏死和血供丧失,再行清宫术可显著降低术中出血风险。临床上应根据孕囊大小选择不同的治疗能量和治疗时长,对于直径>30 mm的孕囊,给予较高的超声能量和较长的辐照时间可有效规避清宫术中的出血风险[17]。
本研究中,HIFU组采用HIFU病灶消融联合超声引导下清宫术治疗,UACE组采用UACE预处理后超声引导下清宫术治疗,两组均无子宫切除病例和血栓、肺栓塞等严重并发症发生,表明两种治疗方式的有效性和安全性都较高。研究显示,清宫术中HIFU组出血量<100 mL病例比例明显高于UACE组,HIFU组的住院费用明显低于UACE组,说明HIFU与UACE相比,能够明显减少清宫术治疗中的出血量、降低住院费用。本研究还显示,术后2个月,HIFU组月经恢复正常率高于UACE组,术后3个月输卵管通畅率、术后3年正常宫内妊娠率高于UACE组,表明HIFU联合超声引导下清宫术治疗,有利于保留患者的生育能力。有研究对HIFU联合清宫术与阴式病灶清除术进行比较,结果表明HIFU联合清宫术在精确消融病灶、减少病灶血供及减轻对正常周围组织损伤等方面更具优势[18]。有文献指出,对于孕囊过大、特别是已形成丰富脉管系统的早期胎盘的CSP患者,HIFU 消融治疗时,超声能量难以沉积在靶病灶内,治疗效果不满意[19]。有研究提出,HIFU 联合清宫术治疗对于孕龄<8周的患者疗效较好[20]。临床上孕囊直径超过6 cm、孕龄超过8周的病例较少,对于此类患者,应采用更为直接的治疗方式(如阴式手术)[21]。本研究观察发现HIFU 或UACE联合清宫术治疗Ⅱ型CSP安全有效,有良好的预后,且两种方法比较差异无统计学意义。但对于血β-hCG高、病灶大的 CSP,由于HIFU消融困难,实施清宫术有较大的出血风险。
综上,本研究探讨HIFU联合超声引导下清宫术治疗CSP的有效性及安全性表明,HIFU联合超声引导下清宫术与UACE预处理后超声引导下清宫术相比,治疗CSP的疗效相近,但术中出血量少、住院费用低,正常再妊娠率高,更符合患者再次生育的伦理学原则。
