TCDD和汞、镉、铅、砷联合毒性效应及机理研究进展
2021-03-23张元元郭少娟王菲菲杨立新
张元元,郭少娟,王菲菲,杨立新
环境基准与风险评估国家重点实验室,中国环境科学研究院
随着科学技术的进步和人类社会的发展,人类生产活动向环境中释放了大量有毒、有害化学污染物,如重金属、杀虫剂和持久性有机污染物等,使得人类和动物不可避免地暴露其中,进而引发肥胖、糖尿病、代谢紊乱、心血管疾病和癌症等多种疾病以及死亡、发育异常和生物多样性下降[1]。有机化学物质和重金属是环境中普遍存在的两大类污染物,有机化学物质污染物一般具有高毒性、持久性和生物累积性,而重金属汞、镉、铅等在环境中难以降解。有机化学污染物和汞、镉、铅、砷一般通过影响细胞中关键蛋白质功能、信号通路和代谢途径,进而影响生命个体的新陈代谢,造成毒性效应和健康损害。在分析、总结芳香族致癌化学物质2,3,7,8-四氯代二苯并二英(TCDD)和汞、镉、铅、砷单一、复合毒性效应及机理的基础上,归纳不同污染物复合毒性效应与其诱导基因表达水平之间的关系,并讨论基于基因表达水平来评价复合毒性效应的可行性。
1 污染物来源与暴露途径
1.1 TCDD
TCDD是一类毒性极强的芳香族化合物,作为工业过程的副产品,主要来源于农药制造、垃圾焚烧、纸张氯漂白等过程,其中废物燃烧是二英的最大来源[2]。我国珠江三角洲水域二英浓度与分布的测定结果显示,部分水体TCDD浓度最高达到了50.189 0 ngL,呈重度污染[3]。排放到环境中的TCDD通过食物链在人体和野生动物体内累积,人体内TCDD的半衰期为7.1~11.3 a[4-5]。人类暴露于TCDD的主要途径是食用受污染的食物,尤其是奶制品、肉类和鱼类。Perelló等[6]研究了一些食物中的TCDD浓度发现,蔬菜、水果、豆类和谷物中约为1 pgkg,鱼类和海鲜为21 pgkg,肉类和乳制品分别为4和6 pgkg。根据美国国家环境保护局(US EPA)2012年提出的TCDD每日最大允许摄入量为0.7 pgkg,部分人群正面临着低剂量和慢性TCDD暴露。
1.2 汞
汞在自然界以3种化学形态存在:金属汞或汞蒸气(Hg0)、无机汞化合物(Hg2+)和有机汞化合物。甲基汞是环境中最常见的有机汞化合物,主要由微生物将无机汞甲基化而形成。环境中的汞主要来源于人类活动和自然排放。化石燃料生产与燃烧、有色金属冶炼等是大气汞的主要来源[7-9]。据估计,在全球范围内,通过自然、人为来源和过去活动再排放产生的汞为6 000~11 000 ta,其中约80%来自人类活动[10]。中国大气中汞的观测值超过了北半球的背景值,显著高于北美和欧洲的观测值[11-12]。食物是无脊椎动物、鱼类和陆生野生动物甲基汞暴露的主要途径[13-15]。美国500个湖泊采集的鱼类样本中,汞浓度大于2 μgkg,食鱼动物体内的汞浓度为23~6 605 μgkg[16]。同样,分布在非洲12个国家的166种不同鱼类的总汞浓度为5.5~1 865.0 μgkg[17]。鱼类和海产品的消费被认为是大多数非职业人类汞暴露的主要途径。
1.3 镉
镉是我国最严重的土壤重金属污染物之一,属于致癌物质。环境中的镉主要来源于自然和人类活动的排放。Zhou等[18]对我国宁波市重金属污染现状进行了调查,在所有检出重金属的蔬菜样品中,工业、郊区和农村种植的蔬菜镉超标率分别为43.9%、27.5%和5.0%,表明宁波市镉污染较为严重。Zhao等[19]对我国南方17个地点采集的30个大豆籽粒样品和17个大豆田土壤样品中的金属进行分析发现,12个土壤样品的镉浓度高于土壤最大允许值,大豆籽粒样品中镉浓度为0.11~0.91 mgkg。食用镉污染的食物是镉暴露的主要途径,在世界范围内膳食镉摄入量从较清洁地区的10~40 μgd到重污染地区的几百μgd[20]。烟草中含有镉,主动吸烟和被动吸烟被认为是镉暴露的另一重要途径。
1.4 铅
铅在植物和土壤中自然存在,铅污染来源包括铅的冶炼、蓄电池的生产和处理以及含铅燃料的燃烧等[21]。我国作为铅生产大国和消费大国,铅污染形势较严峻,仅2014年我国铅产量达到422.13万t,其中蓄电池行业是污染的主要来源[22]。吸入铅污染的灰尘颗粒或气溶胶,食用和饮用铅污染的食物、水等是铅暴露的途径[23],其中食物是铅暴露的主要途径。婴儿和儿童比成年人更容易受到铅毒性的影响。从我国江苏省23个食品类别中采集的2 077份食品样本分析显示,城市和农村人口的膳食铅平均摄入量分别为1.494和1.822 μg(kg·d);而2~6岁儿童的膳食铅摄入平均水平为3.019 μg(kg·d),在不同年龄阶段的群体中浓度最高[24]。
1.5 砷
砷属于致癌物质,在环境中主要以硫化物矿形式存在,被广泛应用于某些杀虫剂和药物。环境中砷污染主要源于岩石风化和火山喷发等自然活动。采矿、冶炼、化石燃料燃烧和半导体生产等过程也释放砷。全球每年由于人类活动排入水体中的砷约为120万t,而自然作用释放到水环境中的砷约为2.2万t。我国183个湖泊、531个水库的调查结果显示,水环境中的砷浓度逐年增高[25]。此外,我国土壤中砷浓度的平均值为世界平均值的2倍,我国有58万km2的土壤砷浓度超过10 μgL,近2 000万人生活在土壤砷污染高风险区[26]。砷暴露主要通过摄入、吸入、皮肤接触等途径。
2 单一毒性效应与作用机理
2.1 TCDD
TCDD的毒性效应与其诱导芳香烃受体(AhR)能力密切相关。AhR是一种核转录因子,除了调节细胞生长、分化和迁移等过程[35-37],还具有化学和微生物防御、干细胞祖细胞的稳态维持以及皮肤和胃肠道等屏障器官的免疫调节等生理功能[38]。TCDD与AhR结合后,激活AhR使之与HSP90XAP2P23伴侣蛋白复合物解离,与配体结合转位到细胞核,与芳香烃受体核转位蛋白(ARNT)形成活性异源二聚体,配体AhRARNT复合物作为转录因子与响应元件(XRE)结合,进而引起一系列基因转录调节的变化[39-41],产生毒性效应。TCDD介导的具体信号通路见图1。AhR激活可上调多种代谢酶表达,包括Ⅰ期酶细胞色素P4501A1 (CYP1A1)、P4501A2 (CYP1A2)、P4501B1 (CYP1B1)以及Ⅱ期代谢酶如GST-A1和UGT1-06等[42-43],其中CYP1A1是AhR激活后最有效的诱导基因[35]。Ⅱ期酶参与有毒化合物的解毒过程;Ⅰ期酶可将多种环境中的有机物转化为细胞毒素或其他致癌物质,从而增加癌症发生的风险。此外TCDD也可以通过诱导氧化应激,造成DNA损伤,引发毒性[44]。TCDD有害结局途径(adverse outcome pathway,AOP)见图2。

图1 TCDD介导的芳香烃受体信号通路Fig.1 TCDD-mediated aromatic hydrocarbon receptor signaling pathway
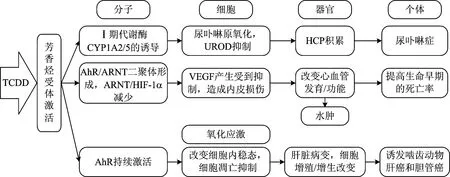
图2 TCDD有害结局途径(AOP)Fig.2 Adverse outcome pathway (AOP) of TCDD
2.2 汞、镉、铅、砷
汞、镉、铅、砷在人体内累积会对各器官造成严重的伤害,尤其是呼吸系统、神经系统、生殖系统和消化系统。汞慢性暴露引起中枢神经系统症状,如震颤、妄想和神经认知障碍[45]。毒性最强的甲基汞可以引起言语、行动和视觉障碍以及周围神经病变和共济失调[46]。镉易在人体骨骼、肺、肝、肾和神经组织中积聚,扰乱或损伤组织功能[47],其中骨骼毒性是镉暴露引发的典型特征。Cd2+在低剂量下也会引起大鼠肾功能衰竭和自噬[48]。铅中毒对神经系统影响最大,婴幼儿对低水平的铅尤其敏感,可导致行为紊乱和智商下降。低剂量铅暴露导致斑马鱼胚胎毒性、行为改变和斑马鱼成年学习记忆缺陷[49]。暴露于2 000 mgkg的铅浓度下,蚯蚓死亡率升高,体重显著下降,繁殖受到抑制[50]。砷暴露可造成皮肤损伤、循环障碍、神经系统并发症、肝和肾功能障碍等[51]。幼年小鼠暴露于砷会减少对流感病毒的清除并加剧炎症反应,导致肺和气道结构发生急性和长期变化[52]。成年小鼠暴露于10 mgL的砷4周后,肠道微生物组成与代谢明显紊乱[53]。
汞、镉、铅、砷可通过几个关键机制引起毒性,包括破坏重要的酶功能,诱导产生活性氧(ROS),破坏离子调节平衡,形成DNA和蛋白质加合物等[54]。汞、镉、铅、砷的AOP见图3,其在体内积累时诱导生成活性氮(RNS)和ROS,导致质膜脂质过氧化。生成的RNS和ROS可能干扰电子传递系统[55]。此外,细胞质中过量的金属离子会破坏细胞内的氧化还原平衡,引起细胞质pH和蛋白构象的改变,阻碍蛋白功能,最终导致细胞功能障碍、凋亡或坏死。汞、镉、铅、砷能与硫醇、咪唑等官能团中的硫、氮和氧原子以及蛋白质的羧基相互作用[19,56-57]。汞、镉、铅、砷可以通过抑制超氧歧化酶的酶活性,减少抗氧化功能蛋白质表达,结合细胞内氧化还原平衡蛋白质的—SH基团来诱导氧化应激[58-60]。TCDD、汞、镉、铅、砷单一暴露毒性效应见表1。
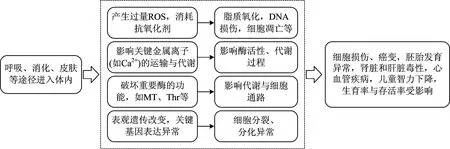
图3 汞、镉、铅、砷有害结局途径(AOP)Fig.3 Adverse outcome pathway(AOP) of mercury,cadmium,lead and arsenic

表1 TCDD、汞、镉、铅、砷单一暴露毒性效应
3 联合暴露毒性效应及作用机理
3.1 TCDD与汞联合暴露
重金属和TCDD在环境中联合暴露可以通过改变CYP1A1基因的表达来增强或降低多环芳烃的致癌性[77-79]。金属离子可以改变小鼠肝癌Hepa 1c1c7细胞和人类肝癌HepG2细胞中几种AhR调控基因的表达。Hg2+在HepG2细胞中抑制TCDD介导的CYP1A1的表达[80],而在Hepa 1c1c7细胞中显著增强了TCDD介导的CYP1A1蛋白的诱导作用[78]。C57BL/6小鼠肝外组织的联合暴露试验也证明了Hg2+以时间、组织和分子水平依赖的方式调节TCDD诱导的AhR调控基因[81]。目前TCDD与汞联合暴露的研究主要集中于对特定基因(如CYP1A1、CYP1A2、CYP1B1、NQO1、GSTA1和HO-1)的影响[81-83]。然而联合暴露的结果可能比对特定基因和通路的影响更广泛,联合暴露导致一些基因的表达呈加性或拮抗效应,还会诱导一些不同于单一暴露的基因表达与疾病产生[84]。Jagannathan等[84]对汞和TCDD联合暴露的人类支气管上皮细胞(BEAS-2B)进行转录组分析,发现与单一不可见效应浓度(no-observed effect concentration,NOEC)暴露相比,联合暴露的细胞中与慢性阻塞性肺疾病(COPD)以及心血管疾病相关的几个过程(如IL9信号、动脉粥样硬化信号和脂肪生成信号)的通路显著富集,表明联合暴露导致发生气道组织重构、COPD以及心血管疾病的风险更高。
3.2 TCDD与镉联合暴露
镉和TCDD联合暴露可通过抑制CYP1A1的诱导水平和活性降低TCDD的代谢率,从而降低TCDD的致癌性。在斑马鱼肝细胞系中,Cd2+抑制TCDD介导的CYP1A1蛋白、酶活性和mRNA表达水平,Cd2+还下调AhR2和ARNT2b的mRNA的水平。与TCDD(3 nmol/L)单一暴露相比,Cd2+(0~30 μmol/L)和TCDD(3 nmol/L)联合暴露显著抑制了CYP1A1远端启动子区域的荧光素酶报告基因和合成的3XRE基因启动子的活性。表明Cd2+通过转录抑制降低了TCDD诱导的CYP1A1水平。蛋白质组学分析结果显示,TCDD单一暴露导致一些与糖酵解有关的蛋白表达下调,而与Cd2+联合暴露则表达上调,表明Cd2+和TCDD可以通过影响糖酵解通路相关基因来干扰能量代谢。蛋白酶体是在细胞暴露于Cd2+和TCDD后表达改变的另一组重要蛋白质。4种亚型的蛋白酶体(PMSA1、PMSA2、PMSA4和PMSA7)在TCDD暴露后表达下调,但与Cd2+联合暴露后表达上调。蛋白酶体途径可能通过降解异常蛋白来保护斑马鱼肝细胞免受Cd2+和TCDD的毒性,也可能促进AhR/ARNT2b的降解,从而减少该复合物在细胞核中的积累[85]。
3.3 TCDD与铅联合暴露
在人肝癌HepG2细胞中,Pb2+能够以浓度依赖性的方式降低TCDD介导的CYP1A1基因在mRNA、蛋白和催化活性水平上的表达。HepG2细胞的试验结果证明,Pb2+可能通过诱导血红素氧合酶-1 (HO-1)基因表达以及活性氧的产生,从而降低CYP1A1的活性[86]。而在小鼠Hepa 1c1c7细胞中,相同浓度的Pb2+显著增强TCDD对CYP1A1 mRNA的诱导[78]。Pb2+对CYP1A1基因调控的物种特异性作用可以归因于核易位、通过染色质重塑活化转录以及AhR的蛋白酶体降解的差异[87]。
3.4 TCDD与砷联合暴露
Chen等[88]在斑马鱼肝细胞系中,通过蛋白质组学方法研究了TCDD和As3+单一及联合暴露导致的相关胞质蛋白表达差异,鉴定了42种蛋白质,主要涉及新陈代谢、应激反应和氧化等相关蛋白。TCDD通过改变相关酶的活性来破坏糖酵解和糖异生[89]。与糖酵解有关的蛋白中,二磷酸醛缩酶A/C-B(ALDO)、烯醇化酶1/3(ENO)和乳酸脱氢酶(LDH)经TCDD暴露后表达均下调,而与As3+联合暴露则表达上调。糖酵解途径是许多细胞的主要能量来源,因此TCDD和As3+对这些蛋白的影响表明TCDD可能破坏糖酵解过程,降低能量生产,而这种抑制可以被As3+逆转。此外,参与糖异生的线粒体酶苹果酸脱氢酶(MDH)在TCDD暴露后表达上调,但与As3+共同暴露后表达下调,证明TCDD也可能促进糖异生,而As3+可能逆转TCDD引起的能量代谢失衡。受TCDD和As3+影响的另一个重要途径是对化学胁迫的应激反应。在蛋白质组学研究中,鉴定了5种热休克蛋白(HSPs)和1种应激诱导的磷蛋白(STIP),这些蛋白在TCDD单一暴露后表达均显著下调,而与As3+联合暴露后表达上调。金属诱导热休克蛋白被认为是对金属暴露的一种防御机制[90-91]。HSP90在AhR复合体中的主要作用是保持AhR的适当折叠和稳定性,蛋白丰度的降低表明AhR复合物水平降低,而AhR/ARNT2b异源二聚体增加。与As3+联合暴露后这些蛋白表达上调表明可能需要更多的热休克蛋白来形成AhR复合物并将其保存在细胞质中,抑制AhR的核转位与ARNT结合。TCDD通过诱导CYP1A1基因表达,增加电子向分子氧的转移,导致活性氧的形成和脂质过氧化,产生毒性[92]。包括As3+在内的微量金属可通过氧化状态循环或与抗氧化剂相互作用而增加炎症,从而导致细胞内自由基的积累,诱导氧化应激。谷胱甘肽还原酶(GTR)可以催化谷胱甘肽二硫化物还原成巯基状谷胱甘肽(GSH),是抵抗氧化应激和维持细胞还原环境的关键分子[93]。TCDD暴露导致GTR表达上调,可能是机体对氧化应激诱导的一种保护性反应,而与As3+联合暴露时其表达下调,表明As3+可能抑制了这一防御系统。TCDD与汞、镉、铅、砷联合暴露毒性效应与机理见表2。

表2 TCDD与汞、镉、铅、砷联合暴露毒性效应与机理
4 小结
(1)TCDD与汞、镉、铅、砷联合暴露的生态效应和健康风险,与每种化合物的毒性机制所预期的效应相比有显著差异。联合暴露导致一些生物效应与基因的表达呈现协同、加性或拮抗效应,还会诱导一些不同于单一暴露导致的疾病和基因表达。
(2)单一污染物不可见效应浓度组成的混合物长期暴露,仍然导致生态效应和健康损害。
(3)TCDD和汞、镉、铅、砷在环境中联合暴露时,重金属可以通过改变CYP1A1基因的表达来增强或降低TCDD的致癌性。不同重金属与TCDD联合暴露的生物反应与基因表达有显著差异。
5 展望
建立有效的有机化学物质和重金属混合物毒性效应评价方法是一个急需解决的问题。尽管面临着全面搞清环境中存在的有害、有毒化学污染物种类,揭示化学污染物联合毒性效应机理,建立化学物质混合物毒性效应评价方法的挑战,但是随着遗传学、转录组学、蛋白质组学、代谢组学、暴露组学、高通量化学物质毒性效应评价技术和生物信息学的快速发展,化学物质AOP打开了从分子层面揭示化学物质毒性效应本质的大门,为建立基于基因表达水平来评价化学物质联合毒性效应方法提供了基础。目前,我们仍然面临着如何将化学物质毒性效应分子机理与毒性效应导致的形态变化联系起来这个毒理学要解决的核心问题。
