四环素类抗生素环境行为及其生态毒性研究进展
2021-03-23敖蒙蒙魏健陈忠林刘利宋永会
敖蒙蒙,魏健,陈忠林,刘利,宋永会*
1.中国环境科学研究院水生态环境研究所 2.辽宁大学环境学院
四环素类抗生素(tetracycline antibiotics,TCs)是一类广谱抗菌药物,在临床上被广泛用于多种细菌及立克次体、支原体、衣原体等所致感染性疾病的治疗,其还是一类常用的饲料添加剂,可作为生长促进剂促进机体生长[1]。TCs包括天然四环素和半合成四环素两大类,天然四环素主要有金霉素(chlotetracycline,CTC),土霉素(oxytetracycline,OTC),四环素(tetracycline,TET),去甲金霉素(demeclocycline,DMCT)等;半合成四环素主要有强力霉素(doxycycline,DOC),甲烯土霉素(methacycline),二甲胺四环素(minocycline)等。其中使用最多的是土霉素、四环素和金霉素[2]。TCs由4个六元环构成,包含二甲胺基〔—N(CH3)2〕、酰胺基(—CONH2)和酚羟基3个官能团,此外还有包含酮基和烯醇基的共轭双键系统[3](图1)。TCs属于两性化合物,能与多种酸、碱形成盐,其中盐酸盐性质最为稳定,广泛应用于实际中[4-5]。
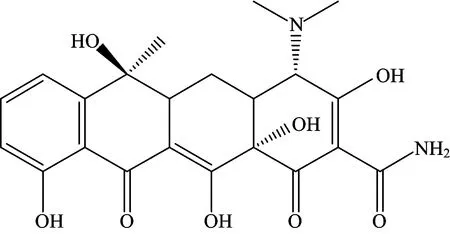
图1 TCs的分子结构Fig.1 Molecular structure of TCs
TCs在临床疾病治疗和畜牧业生产方面发挥着巨大的作用,但该类药物的大量使用并进入环境,导致水体、土壤等环境介质中污染物残留浓度升高,诱导大量耐药性致病菌出现,给生态环境安全带来严重威胁。笔者梳理分析了环境中TCs的来源及污染现状,阐述了其在环境中的迁移转化和降解,并对其生态毒性效应进行了总结,指出了该类污染物的生态风险,并对未来的研究方向进行了展望,以期为TCs污染环境风险防控提供参考。
1 TCs的来源与污染现状
根据文献计量学统计对中国知网(CNKI)数据库关键词四环素、污染进行检索,得到2009—2019年TCs文献数量变化,如图2所示。由图2可知,近10年TCs在环境污染中的相关文献共有140篇,其中涉及水环境污染文献有56篇(占比40%),土壤污染文献有55篇(占比39%),禽畜粪便污染文献有13篇(占比9%),沉积物污染文献有5篇(占比4%),区域污染文献有11篇(占比8%),水环境和土壤污染文献数量较多;检出频率较高的4种TCs为TET、OTC、CTC和DOC;涉及抗性基因的文献有36篇,占总文献数量的26%,说明抗生素抗性基因引发的问题引起了广大学者的关注,是当前的研究热点。
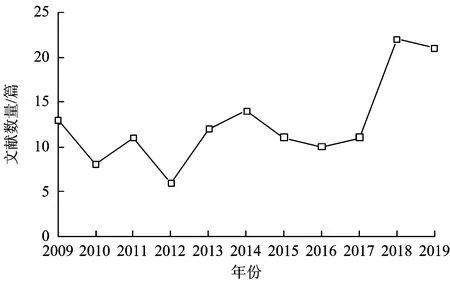
图2 2009—2019年TCs文献数量变化Fig.2 Change of TCs literature quantity from 2009 to 2019
1.1 来源
TCs在环境中的迁移途径如图3所示。由图3可知,临床医疗和畜禽养殖是环境中抗生素污染的主要来源。TCs通过人体代谢由医院污水处理系统排出,通过市政管网进入城镇污水处理系统,残留TCs及中间降解产物最终进入环境中。在畜禽养殖行业,TCs主要作为饲料添加剂和预防动物疾病药物被大量使用,TCs在动物体内难以被完全吸收,一半以上以动物排泄物的形式排出,包括代谢产物在内的污染物最终进入到水体、土壤等环境中[6]。环境中残留的TCs不但给生态系统带来不良影响,还会导致多种耐药性细菌的产生,从而引发生态毒性效应,其在环境中的迁移转化和毒性效应引起广泛关注。
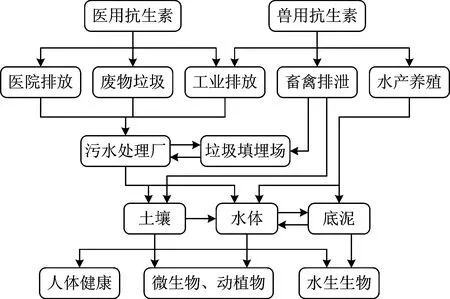
图3 环境中TCs的来源和环境迁移途径Fig.3 Sources and migrating pathways of TCs in the environment
1.2 污染现状
1.2.1水体TCs污染
水环境中TCs以OTC、CTC和TET污染较为普遍,不同地区水环境(地表水、养殖废水、污水处理厂)中TCs污染物的种类及污染水平如表1所示。
由表1可知,TCs在不同水体中残留量与污水的来源和特性有关,一般而言养殖废水和污水处理厂的TCs浓度较高(μgL级)。如在日本的养殖废水中检测到CTC浓度为0.002~68 μgL[18],发达地区养殖场周围水体中TCs的污染水平相对较高,废水中残留浓度较大[30]。中国北方污水处理厂中检测到TET的浓度为0~1.11 μgL[28]。污水处理厂中TCs残留与所在地的气候环境、居住人口密度、污水量和人类对此类抗生素的使用量等均有关系,通常污水处理厂对抗生素去除率为60%~90%。尽管城市污水大部分进入污水处理系统,仍会存在TCs对地表水、饮用水源和地下水造成污染的情况,如德国、韩国部分地区地表水中检测到TCs浓度最高达

表1 不同地区水体中TCs污染水平
563和254.82 μg/L[6,8],我国多数城市地表水中检测到的浓度在ng/L级。
1.2.2土壤沉积物中TCs污染
土壤/沉积物中TCs以OTC、TET和CTC为主,浓度在ng/kg~mg/kg数量级[31]。不同地区土壤/沉积物中TCs种类及污染水平如表2所示。
表2 不同地区土壤沉积物中TCs的污染水平
Table 2 Concentrations of TCsin soils and sediments of different regions
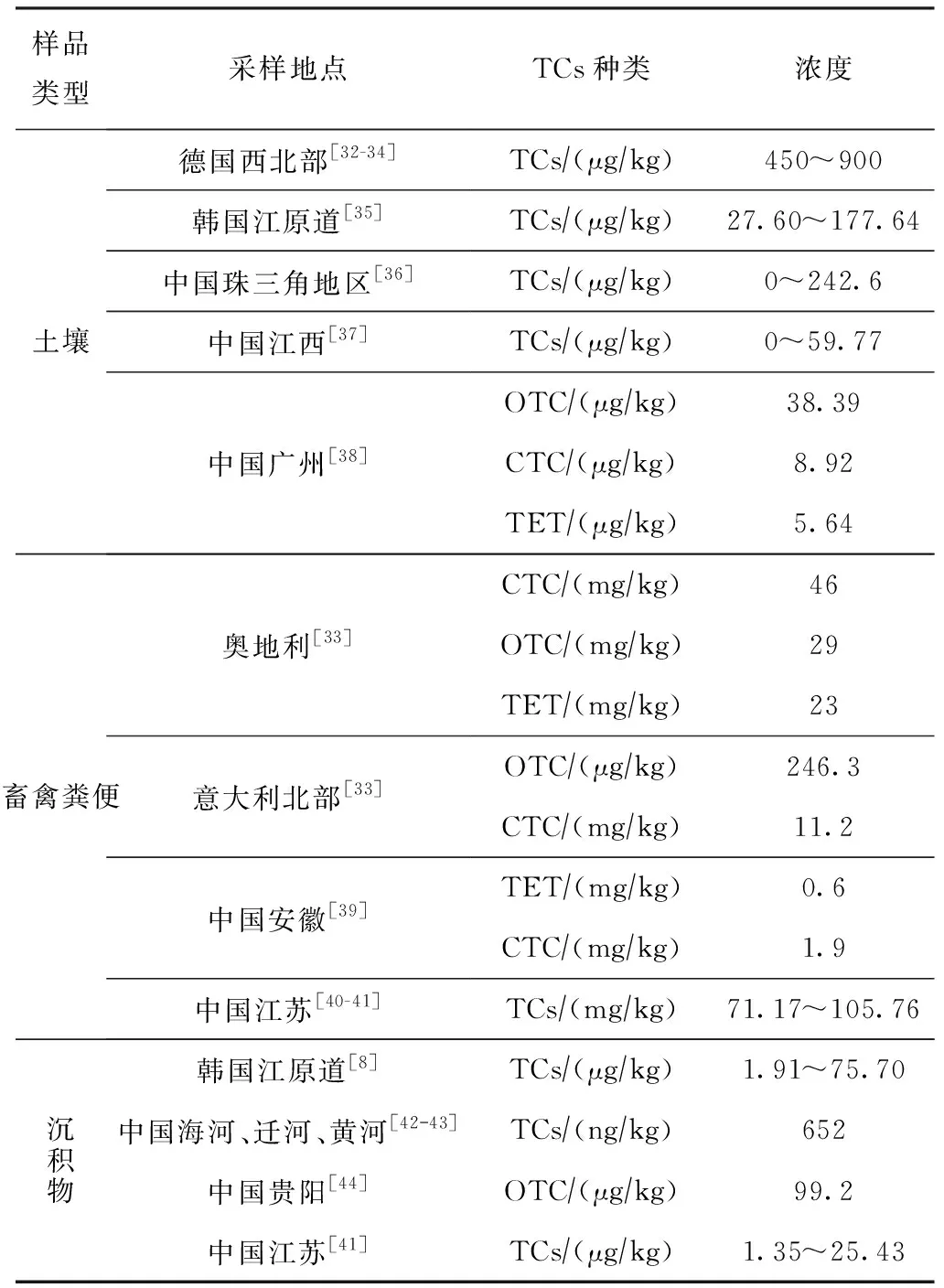
表2 不同地区土壤沉积物中TCs的污染水平
样品类型采样地点TCs种类浓度土壤德国西北部[32-34]韩国江原道[35]中国珠三角地区[36]中国江西[37]中国广州[38]TCs∕(μg∕kg)450~900TCs∕(μg∕kg)27.60~177.64TCs∕(μg∕kg)0~242.6TCs∕(μg∕kg)0~59.77OTC∕(μg∕kg)38.39CTC∕(μg∕kg)8.92TET∕(μg∕kg)5.64畜禽粪便奥地利[33]意大利北部[33]中国安徽[39]中国江苏[40-41]CTC∕(mg∕kg)46OTC∕(mg∕kg)29TET∕(mg∕kg)23OTC∕(μg∕kg)246.3CTC∕(mg∕kg)11.2TET∕(mg∕kg)0.6CTC∕(mg∕kg)1.9TCs∕(mg∕kg)71.17~105.76沉积物韩国江原道[8]TCs∕(μg∕kg)1.91~75.70中国海河、迁河、黄河[4243]TCs∕(ng∕kg)652中国贵阳[44]OTC∕(μg∕kg)99.2中国江苏[41]TCs∕(μg∕kg)1.35~25.43
由表2可知,由于抗生素用量、畜禽粪肥施用量、环境条件等差异,导致不同地区土壤/沉积物中TCs污染水平存在差异。畜禽粪便中TCs的浓度最高,均在mg/kg级,检出最多的为CTC。由于畜禽粪便普遍存在,且往往不经无害化处理便作为有机肥直接还田,且TCs与土壤亲和力强、不易迁移,导致土壤中残留浓度较高。河流沉积物中的抗生素由于长期蓄积而导致残留浓度偏高,如贵阳市某河流沉积物中OTC浓度高达99.2 μg/kg[43]。
2 TCs的环境行为
抗生素通过各种途径进入到环境后,在土壤、水、沉积物和植物等不同环境介质中发生吸附、降解和转化等物理化学过程,深入了解这类污染物的环境行为,对开展抗生素污染防治和风险防控具有重要意义。
2.1 TCs的吸附和迁移
吸附是抗生素在环境中的常见环境行为之一,吸附过程对抗生素在环境中的迁移和转化有重要影响,吸附能力强弱取决于抗生素种类和土壤特性。有研究表明[45],抗生素较强的吸附性导致其在底泥中的浓度远高于水体。抗生素在土壤中的迁移主要取决于其自身的光稳定性、键合、吸附特性等,一般情况弱酸、弱碱性和亲脂性类抗生素与土壤有良好的亲和力,在土壤中不易迁移。
抗生素进入水环境后被水中的颗粒物和沉积物吸附,吸附方式主要包括物理吸附、化学吸附、氢键结合、配位键结合等[46]。吸附行为主要发生在土壤中,吸附方式包括物理吸附和化学吸附,污染物的化学结构和理化性质均会影响其吸附能力。有研究表明[47],不同环境条件下,TCs可被土壤强烈吸附,在酸性黏土中吸附作用更强。土壤对抗生素的吸附能力主要与土壤黏粒、有机质和氧化铁含量呈正相关,与其他土壤性质的相关性较小[48]。抗生素吸附作用强弱为四环素类>大环内酯类>氟喹诺酮类>磺胺类>氨基糖苷类>青霉素类[49-50]。武庭瑄等[51]采用吸附试验考察了TET在黄土中的吸附行为,结果表明:黄土对TET有较强的吸附能力,添加可溶性腐殖酸会导致吸附量降低;在pH为4.0~9.0时,黄土对TET的吸附能力随着pH的增大而减小。
2.2 TCs的降解
TCs的降解分为非生物降解和生物降解,非生物降解包括光降解、水解和氧化降解,生物降解包括微生物降解和植物吸附。
2.2.1光降解
光降解是分子吸收光能后从基态跃迁变成激发态从而引发的各种反应,分为直接光解和间接光解[52-54]。抗生素分子直接吸收光子发生跃迁,产生化学变化称为直接光解;间接光解则是借助环境中对光敏感的吸光物质(光敏剂)进行[55]。影响光降解效率的因素主要有pH、光敏剂、水的硬度、介质类型、季节和纬度等[56]。有研究表明[57],仅使用不同光源对TET溶液照射不会发生任何降解,加入光敏剂TiO2后TET迅速发生降解。Doi等[58]研究了OTC的光降解行为,发现随着溶液pH升高OTC降解速率加快,水中有机矿物质能促进OTC的降解。一般情况下,反应温度升高有助于化学反应进行,温度每升高10 ℃,OTC的降解速率可增加2倍,降解速率常数的对数与温度存在线性关系[59]。
2.2.2水解
水解是抗生素在水环境的主要降解途径之一,主要发生在易溶于水的抗生素中。TCs分子中含有多个功能团,在酸性条件下C—6羟基和C—5上的氢处于反式构型,易发生消除反应,生成无活性橙黄色脱水物,而C—4二甲胺基易发生可逆的差向异构化反应,在碱性条件下TCs可生成具有内酯结构的异构体。因此,TCs水解速率主要受pH和温度的影响[60]。郑丽英等[61]研究了CTC在不同温度、和pH条件下的降解情况,结果表明CTC较易水解,水解速率受温度和pH影响较明显,在碱性和中性条件下水解速率大于酸性条件,并且高温环境(70 ℃)下水解速率大于室温环境(20 ℃)。Loftin等[62]通过分析氯四环素、OTC和TET等在不同温度和pH条件下的水解速率,发现随着pH和温度的升高污染物水解速率明显加快,但离子强度对其水解无显著影响。
2.2.3氧化降解
TCs在强氧化剂的作用下可以迅速氧化降解,常见的氧化剂主要有臭氧、HClO、H2O2、K2FeO4等,其中臭氧氧化对TCs具有较好的降解效果,在水处理中被广泛应用[63]。臭氧氧化法预处理含有CTC的废水,处理后废水可生化性增强,污染物对活性污泥微生物的抑制作用显著降低,臭氧氧化降解速率主要取决于pH和臭氧剂量[64],但单独臭氧氧化过程难以将TET彻底矿化[65-66]。李国亭等[67]研究了高锰酸钾对TET的降解过程,在不同反应条件下高锰酸钾对TET的降解率为27.2%~90.9%。
2.2.4微生物降解
微生物降解是抗生素在环境中降解的重要途径。微生物可以改变抗生素的结构和理化性质,将抗生素残留物从大分子化合物降解成小分子化合物,直至转变成H2O和CO2,实现抗生素污染物的无害化。耐药菌在抗生素的降解过程中发挥着重要作用,通过水解、乙酰转移和氧化还原机制直接破坏抗生素分子结构而使其失活[68-69]。Huang等[70]从制药厂排污口的污水样品中分离出一株酵母菌,其对四环素降解率达到78.28%。Maki等[71]从养殖海水鱼的底泥中驯化筛选出具有高效降解作用并有较强耐受能力的效应菌株,其对OTC、DOC和TET等有显著降解功能。在抗生素微生物降解过程中,主要影响因素有pH、温度、含氧量及环境介质等[72-73]。在同样环境条件下,不同类型TCs的微生物降解速率也不同,研究发现在猪粪中添加外源微生物可以提高其中TCs的降解率,不同污染物的降解率为CTC>OTC>TET,且外源微生物的降解能力随时间逐渐增强[74-76]。微生物降解法处理抗生素污染物具有成本低、特异性强、无二次污染等优点,在抗生素污染物的处理中被广泛应用。
2.2.5植物吸附
植物吸附通过绿色植物对污染物降解、转化、吸收、代谢和去毒来修复已被污染的土壤、水体和大气环境[77],是一项绿色技术。由于植物拥有庞大的叶冠和发达的根系,其可在环境中进行复杂的物质交换和能量交换,对生态环境的平衡起重要作用[78]。陈小洁等[79]发现,大漂和凤眼莲对水中的TCs有清除作用,将大漂和凤眼莲在污水中培养一段时间后,其对盐酸四环素的去除率分别达80%和90%以上。廖杰等[80]研究表明,水芹和空心菜对TCs都有较好的吸收和去除效果,其中水芹对TCs的吸收去除效果明显高于空心菜,且夏季吸收效果明显优于冬季,植物吸收的抗生素主要积累在茎部,叶子部位相对较少。Kumara等[81]研究发现,玉米、洋葱和卷心菜3种植物对土壤中的CTC具有较好的吸收效果,但对泰乐菌素吸收去除效果有限。
3 TCs的生态毒性
TCs在环境中的生态毒性主要表现在:通过影响环境中各种微生物的种群数量以及水生生物、动物、植物等高等生物的种群结构和营养方式,破坏环境中固有的食物链和生态系统的平衡;诱发产生各种耐药菌,其通过大量繁殖和传播威胁人类健康。
3.1 影响环境生态系统平衡
3.1.1对微生物的生态毒性
抗生素能直接杀死环境(土壤和水体等)中某些微生物或抑制其生长,影响环境中微生物群落结构,导致土壤微生物对其他污染物的降解能力降低[82]。抗生素可有效抑制菌类生长,一般来说,四环素类药物对微生物的影响为细菌>放线菌>真菌[83]。Dijck等[84]研究发现,含有抗生素的饲料添加剂对土壤和水中多种微生物有显著影响。TCs可以显著地降低微生物数量,导致土壤微生物群落结构发生改变,其抑制作用随抗生素浓度的增加而增强[85-86]。Thiele-Beuhn等[87]研究表明,不同种类抗生素对发光细菌的毒性有差异,微毒(microtox)毒性测试结果显示,OTC、TET和CTC的半最大效应浓度(EC50)分别为6.119、20.72和64.32 mg/L。张劲强等[88-89]研究表明,牛奶中的OTC对费氏弧菌和青海弧菌有抑制作用,一定浓度范围内其毒性抑制率随时间呈对数趋势增加。TCs对微生物的毒性见表3。
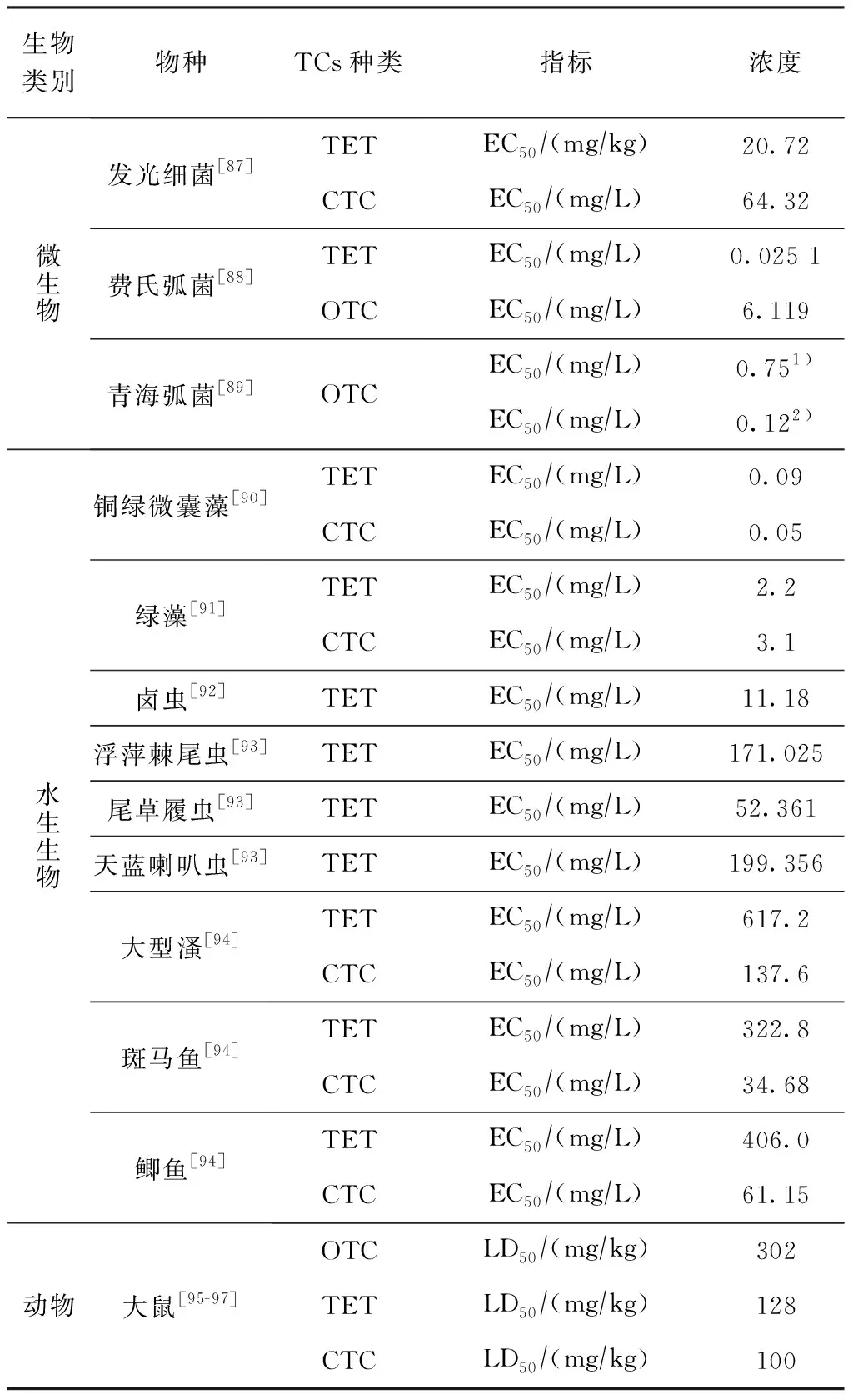
表3 TCs对生物的毒性
3.1.2对水生生物的生态毒性
TCs对水生生物有很强的毒害作用。以藻类为例,当淡水绿藻暴露在TCs下,DOC可使细胞膜通透性降低,CTC和TET在低浓度下可以增加绿藻细胞膜的通透性。徐冬梅等[90-91]研究表明,TET和CTC对铜绿微囊藻的EC50分别为0.09和0.05 mg/L,对绿藻的EC50分别为2.2和3.1 mg/L,铜绿微囊藻对TCs的敏感程度比绿藻要高。王慧珠等[98]以大型溞、斑马鱼和鲫鱼等进行测试,结果表明:TET和CTC对水生动物毒性敏感顺序为鲫鱼>斑马鱼>大型溞,CTC毒性明显高于TET;经毒性分级标准判断,TET对3种水生动物均属于低毒物质,CTC对大型溞属低毒,对斑马鱼和鲫鱼属中毒。曲甍甍等[99-100]研究表明,TCs对鲫鱼肾细胞DNA有损伤,对鲫鱼胚胎有致畸现象。Gagne等[92]研究表明,OTC对河蚌的免疫系统有一定毒性影响,可严重抑制海胆性腺的生长(表3)。
3.1.3对植物的生态毒性
TCs随动物粪便和污水排放进入土壤中,进而被植物吸收,并对植物的根和芽等产生生态毒性。Bradel等[101]研究发现,当TET达到一定浓度时,植物芽和根的生长均被抑制,其中根对TET的生态毒性比芽更敏感,TET被植物吸收后主要富集在根部。张乙涵等[102]研究表明,不同植物对TCs的吸收能力不同,一般顺序为番茄>黄瓜>黑麦草>苜蓿>胡萝卜>南瓜>莴笋>玉米。Kong等[93]研究表明,紫花苜蓿对TCs的吸收过程为主动吸收,最后TCs积累在根部,随着浓度升高会出现叶子变黄现象,主要是由于TCs与叶绿体合成酶结构相似,抑制了叶绿体的翻译活性所致。
TCs对植物生长发育的影响与其化学性质、使用剂量和土壤吸附能力等因素均有关。Batchelder等[103-104]研究发现,红扁豆对CTC和OTC 2种抗生素表现非常敏感,当营养液中浓度为160 mg/L时,植物全部死亡;但在土壤中,对红扁豆进行同样浓度的处理却未表现出相应的毒性效应,主要原因是TCs与土壤中二价金属离子形成了螯合物,降低了其在土壤中的有效浓度。
3.1.4对哺乳动物的生态毒性
抗生素随肥料进入土壤后,对土壤中的动物会产生生态毒性效应。Baguer等[105]研究了OTC对土壤中蚯蚓、跳虫和线虫的影响,结果表明,OTC对土壤中动物的毒性都很低,观察到的最低效应浓度为3 000~5 000 mg/kg。Boleas等[82]研究了OTC对土壤生物的影响,将OTC浓度为0.01、1和100 mg/kg的土壤添加到表层土壤中,结果发现蚯蚓无死亡,但对土壤生物酶(磷酸酶、脱氢酶)活性有抑制作用。土壤环境中的抗生素不会对土壤动物产生直接毒性效应,但由抗生素引起的土壤微生物群落的变化可能会对土壤动物产生间接影响。
临床上TCs主要用于治疗细菌感染,其过程会引起部分生化功能紊乱,对肾、肝脏和生殖系统产生影响。已有研究表明[95-97,106],当大鼠体内OTC积累到一定浓度,会产生肾毒性,引起血清尿素和肌酐显著升高,同时抗氧化酶活性降低,低分子量抗氧化剂含量减少。TET可使大鼠睾丸、附睾和精囊相对重量减少,精子形态异常增加,睾丸组织病理学改变。此外,TET可使大鼠超氧化物歧化酶、过氧化氢酶(CAT)、葡萄糖-6-磷酸脱氢酶活性显著降低,谷胱甘肽S-转移酶(GST)和血清GSH、睾酮和γ-谷氨酰转肽酶活性显著升高,对大鼠生殖系统毒性比较显著[107](表3)。
3.2 诱发和传播耐药基因
抗生素的大量使用会诱导产生抗性基因,严重威胁生态系统安全。长期使用抗生素病人的排泄物和畜牧水产养殖业的动物粪便含有大量残留抗生素,进入环境后会促使产生抗性基因,并通过水流、雨水冲刷和地表径流等多种途径进行传播和扩散。有研究表明[108],许多国家的地表水、养殖场废水、污水厂排水、医疗废水、空气、土壤沉积物,甚至是饮用水中均检出了不同程度的抗性基因,对人类的健康造成严重威胁。
近年来,关于水环境中抗性基因被频频检出的报道引起了广泛关注,鱼塘等养殖水体和土壤是耐药基因产生的重要场所[109]。Dang等[110]在我国沿海养殖场中分离到了OTC抗性基因,在海胆和海参的养殖池中检测到OTC抗性基因tetA、tetB和tetD。Agerso等[111]在泰国的综合养鱼场中检测到TET耐药基因tet39。Tao等[112]在我国珠江流域检测出4个TET抗性基因tetA、tetB、tetC和tetD,其中tetA和tetB基因多次被检出,检测频率分别为43%和40%。Chee-Sanford等[113]在养猪场附近的化粪池中发现8种TET抗性基因tet(O)、tet(Q)、tet(W)、tet(M)、tetB(P)、tet(S)、tet(T)和otrA;抗性基因会渗到地下水中,在养猪场下游的地下水中依然能检测到抗性基因,对土壤中土著微生物产生不利影响。Auerbach等[114]在污水处理厂和2个淡水湖也检测到TET抗性基因,与湖水相比,污水处理厂中TET抗性基因的种类更多,并且活性污泥中也存在高浓度的TET抗性基因。
世界卫生组织曾表示,抗生素抗性基因将成为人类21世纪重要的公共健康问题[115]。抗生素抗性基因在同种生物个体甚至不同生物种之间的传播和扩散,给生态安全和人类健康带来风险。作为新的全球性污染问题,抗生素抗性基因及其在环境中的传播、扩散应引起高度重视。
4 结论与展望
作为新型污染物,TCs在环境中普遍存在,对人类健康和生态环境的危害日趋明显,受到人们的广泛关注。TCs在水体中浓度为ng/L~μg/L级,在土壤/沉积物中浓度为ng/L~mg/L级,其中OTC、CTC、TET浓度相对较高。环境行为和生态毒性研究表明:TCs在环境介质中吸附能力较强,更易在土壤中发生降解;TCs降低微生物活性,抑制植物和动物生长发育,对水生生物产生明显毒害作用。我国是抗生素的生产和使用大国,但对TCs在环境中污染状况、归趋和生态毒性的研究还不够,仅局限于表面现象的描述,缺乏机理研究。今后需系统研究TCs在环境中污染现状和迁移转化的作用机理,加强TCs与重金属、杀虫剂等其他污染物形成复合污染的研究,深入了解抗性基因的传播、扩散以及防治,研发降低抗性基因危害的废水处理技术和管理措施。
