高灵敏靶标自环化滚环扩增检测的动态接头构建❋
2021-03-23王晨儒梁兴国
王晨儒,安 然,2❋❋,梁兴国,2
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003; 2.青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237)
滚环扩增(Rolling circle amplification,RCA)是指以环状DNA为扩增模板,在具有链置换活性的DNA聚合酶作用下,扩增产生具有重复序列长链DNA的一种等温扩增技术[1-2]。RCA具有等温反应、扩增效率高、可进行原位扩增和易与其他技术联合等优势,适合应用于微生物的现场检测和高通量初筛[3-4]。近年来,随着RCA技术的快速发展,研究者们已开发了针对miRNA[5-6]、病原菌[7-8]、蛋白质[9-10]、毒素[11]甚至重金属[12-13]等多种物质的RCA检测技术。此外,RCA还被用于DNA纳米结构的构建、药物载体的制备[14-16]和生化分析等领域[17-19]。
为使RCA可检测线性DNA靶标,大多RCA技术通过锁式探针将线性靶标转化为环状模板。锁式探针两端分别与靶标片段互补配对,并在靶标的辅助下环化,然后DNA聚合酶以环化的锁式探针为模板进行扩增[3,8]。然而,这种方法的实质是对人为加入的锁式探针进行扩增,并非真正扩增靶标片段,因此存在特异性较差、假阳性率高等问题。针对此问题,Wang等[18,20]建立了一种将靶标环化的新型RCA技术,称为靶标自环化滚环扩增(Target-circularization RCA,TC-RCA)。具体原理是通过IIS型限制性内切酶(产生随机黏性末端)切割目标基因,产生两端具有不同黏性末端的靶标片段;再利用可与靶标黏性末端互补配对的特异性接头(两条部分互补的单链DNA杂交形成的带有黏性末端的接头)捕获靶标片段,并在连接酶的作用下使靶标环化为带有缺口(Gap)的双链环状DNA;最后以此缺口的3’端为引物进行RCA(见图1a)。TC-RCA是直接对靶标片段的扩增,特异性得到显著提高,并可用于全基因组扩增、基因测序等领域。
然而,TC-RCA在均相体系中的检测灵敏度仅为6×106copies/μL,难以进一步提高。分析原因如下:为使接头在大量背景基因中快速捕获微量靶标,通常接头的加入量是靶标的102~109倍[18];因此,过量的双链接头极易同时杂交于靶标两端,导致大部分靶标片段无法环化为环状模板,大大降低了RCA效率(见图1b)。
为确定TC-RCA灵敏度低的原因并提高检测效率,本研究构建了一种带有发卡结构的动态接头(18 nt),使接头的两端产生连接活性差异,通过发卡接头打开与闭合的动态平衡抑制靶标两端双链接头的同时连接。通过研究发卡动态接头的环化效率以及发卡的稳定性和磷酸化对连接的影响,揭示了TC-RCA灵敏度低的根本原因。在此基础上,本研究采用了一种10 nt的短链动态接头进一步提高了环化效率,实现TC-RCA靶标的高灵敏度环化。新型动态接头的构建为TC-RCA中接头的设计提供了新思路,可大大提高TC-RCA的检测灵敏度;同时可为双链DNA环化机理研究提供重要参考。

(a:靶标自环化RCA(TC-RCA)技术;b:两接头同时连接于靶标两侧,导致靶标无法环化,继而无法进行RCA。a: the principle of target-circularization RCA (TC-RCA). b: the problem that two adaptors are connected, resulting in the failure of cyclization as well as RCA.)
1 实验方法
1.1 试剂与材料
DNA序列由金唯智(苏州)合成(见表1)。TaqDNA连接酶、TspRI限制性内切酶及ATP购自英国New England Biolabs(NEB)公司;Eva Green qPCR Mix(2×)购自美国Biotium公司;T4 DNA ligase和琼脂糖胶纯化试剂盒等均购自美国Thermo Fisher Scientific公司。
1.2 发卡动态接头连接线性靶标(W或P)
1.2.1 发卡动态接头单侧与靶标连接 在含有0.1 μmol/L的线性靶标W(或P)体系中添加其中一个发卡动态接头(Ha或Hb)0.1 μmol/L,8 UTaqDNA ligase,1×TaqDNA Buffer,总体积为10 μL。实验平行进行2次以上。55 ℃温育6 h。10%非变性聚丙烯酰胺凝胶电泳检测连接产物。
1.2.2 发卡动态接头双侧与靶标连接 在含有线性靶标W(0.2 μmol/L)和P(0.1 μmol/L)的体系中添加Ha(0.1 μmol/L)和Hb(0.2 μmol/L)发卡动态接头,8 UTaqDNA ligase,1×TaqDNA Buffer,总体积为10 μL。实验平行进行2次以上。55 ℃温育6 h。10%非变性聚丙烯酰胺凝胶电泳检测连接产物。

表1 寡核苷酸序列
1.3 发卡动态接头连接271 bp靶标DNA
1.3.1 靶标单侧连接发卡接头 在10 μL体系中,加入靶标DNA(浓度可以为10 nmol/L~10 amol/L),一对发卡动态接头(终浓度10 nmol/L),8 UTaqDNA ligase,1×TaqDNA Buffer(10 mmol/L Tris-HCl,50 mmol/L KCl,1 mmol/L DTT,0.1 mmol/L EDTA,200 μg/mL BSA,50% Glycerol,pH=7.4, 25 ℃)。实验平行进行3次。55 ℃温育6 h。采用实时荧光定量PCR法检测产物浓度。
1.3.2 靶标双侧连接发卡接头 在反应体系中同时加入相同体积和浓度的两对发卡接头(H1a+H1b或H2a+H2b),其余条件及操作与上述只有一对接头单侧连接相同。
1.4 短链动态接头环化558 bp靶标
在含有558 bp靶标DNA(10 nmol/L~10 amol/L)的10 μL反应体系中添加一对短链接头(10 nmol/L),2.5 U T4 DNA ligase,1×T4 DNA Buffer。实验平行进行3次。25 ℃温育6 h。采用实时荧光定量PCR法检测产物浓度。
1.5 实时荧光定量PCR分析动态接头的连接产率
将1 μL连接产物加入含有0.4 μmol/L引物和1×Eva Green qPCR Mix的10 μL反应体系中进行荧光定量PCR。反应条件:95 ℃预变性5 min;95 ℃ 30 s,65 ℃ 30 s,75 ℃ 1 min (30循环);75 ℃ 5 min终止延伸。
2 结果与讨论
2.1 环化靶标DNA的发卡动态接头设计
构建的发卡动态接头如图2a所示,双链茎干区长3 bp,带有9 nt长的3’端凸出末端。其特点是在溶液中处于打开与闭合的动态平衡:当发卡形成时,可在连接酶作用下以黏性末端的方式连接到靶标上,而且由于发卡结构茎干区很短,其5’端不发生连接;当发卡打开为单链结构时,也难以连接[21]。Yu等研究发现[21],黏性末端的连接效率显著高于同等长度单链的连接。只有当单链接头分别连接到靶标后,才能形成黏性末端(9 nt互补)并完成环化。值得注意的是,未发生连接时,由于互补部分很短,在连接温度下难以杂交,避免生成双链接头,造成两端同时发生双链连接。两端单链连接后形成了9 nt的黏性末端,可在连接酶的辅助下杂交并连接。此外,环化是分子内连接,连接效率大大高于形成二聚物的分子间连接。由于其中一个发卡接头的5’端未进行磷酸化,因此靶标环化后形成一条链具有切口的双链环状DNA,聚合酶以此切口为引物进行RCA反应(见图2b)。
为验证上述设计思路,即避免双链接头的形成与连接,本研究在Wang[18,20]等的研究结果基础上,设计了发卡接头用来环化TspRI酶切的靶标[22]。为形成相对稳定的发卡,将一个接头的环部序列设计为5’-GAA-3’[24],另一个发卡接头的环部序列为5’-TTC-3’(见图2a)。

(a:发卡接头的设计原理;b:发卡接头连接靶标的原理。a: The design principle of hairpin adaptors. b: The principle of the target circulization with hairpin adaptors.)
2.2 发卡接头连接效率比较
为了减少对发卡接头连接效率评价的影响,设计了如图3a所示的连接体系。将4条单链DNA通过互补杂交形成2条带有3’凸出末端的双链DNA(W和P)。其中W由Wa(79 nt)和Wb(55 nt,5’端磷酸化)构成,含有55 bp双链且两端分别有15和9 nt单链凸出端;P由Pa(79 nt)和Pb(47 nt,5’端磷酸化)构成,含有47 bp双链且两端分别有23和9 nt的单链部分。W与发卡接头H1b互补(5’端未磷酸化);P与H1a互补(5’端已磷酸化)。
图3c为TaqDNA ligase在55 ℃下连接发卡接头与W和P(0.1 μmol/L)的结果。W与H1b连接后形成“15 nt单链+64 bp双链+9 nt单链”的结构;P与发卡接头H1a连接后将形成“23 nt单链+56 bp双链+9 nt单链”的结构(见图3b)。结果表明,W与H1b(Lane 3)和P与H1a(Lane 4)连接后均可获得浓度较高的单一条带产物,说明发卡结构可分别与单侧靶标发生高效连接。然而,连接产物条带与W和P原条带位置极其接近,这可能是由于W与H1b、P与H1a连接后,发卡的5’端仍可回折形成双链发卡结构,而W和P模板的3’端则具有凸出的9 nt单链末端,较为舒展的单链DNA末端会减慢DNA在电泳凝胶中的迁移速率[25]。

(a:线性靶标模板以及发卡接头示意图;b:线性靶标与发卡接头连接的三种连接产物;c:连接结果电泳图。a: The scheme of linear targets and hairpin adaptors. b: Three kinds of ligation products of linear targets and hairpin adaptors. c: The ligation results.)
然后我们将W、P、H1a和H1b同时添加至连接体系中,以探索发卡接头是否可在与W和P分别连接后进行黏性末端的连接。若连接成功,将形成W+Hb+Ha+P(见图3b(3))的双链DNA结构(15 nt单链+129 bp双链+23 nt单链,且具有一个切口)。图3c中Lane 5为W+Hb+Ha+P的连接结果,图中可看出产生了较长的双链DNA产物且产物浓度较高,说明发卡接头可发生高效连接。同时,这一结果也进一步说明发卡接头优先与线性靶标的一侧发生连接,然后再完成接头间的连接。同样,与类似长度的Ladder相比,双链DNA产物迁移率较慢的原因是双链两端的单链末端减慢了DNA在凝胶中的迁移速率。此外,连接中有少量副产物产生,可能是由于W浓度较高,少量H1b接头也连接到了W上。为了便于评价连接效率,加入的W是P的2倍,因此有H1a与W连接后的产物剩余。
2.3 发卡动态接头的稳定性对连接的影响
发卡结构的稳定性是影响发卡接头与靶标连接的关键因素。根据Wang等[23-24]的研究成果,环部序列为5’-GNA-3’的发卡结构稳定性远高于其他序列。如环部序列为5’-GAA-3’的发卡的Tm比环部为5’-AAG-3’的发卡高10℃以上。因此,本部分重新设计了环部序列为5’-AAG-3’和5’-CTT-3’的一组发卡接头H2a与H2b,与2.2中环部序列为5’-GAA-3’和5’-TTC-3’的发卡接头H1a和H1b进行对比。此外,为探究发卡接头磷酸化对连接的影响,分别选用了5’端磷酸化的发卡接头和5’端未磷酸化的发卡接头进行了对比。
当进行单侧连接时,5’端磷酸化的发卡接头与靶标连接后可获得较为单一的产物(见图4,Lane 3、5、7和9),说明发卡接头与靶标发生了高效连接且接头的稳定性对连接效率影响较小。对于5’未磷酸化的发卡接头,自身稳定性较高的H1发卡接头与靶标的连接结果与磷酸化接头的结果相似,可产生条带位置相同的单一产物。然而,对于自身稳定性较低的H2发卡接头,其与靶标连接后产生了一条迁移率较慢的连接产物。原因是未磷酸化的H2a和H2b发卡接头稳定性较低,在电泳过程中打开形成单链,导致迁移率降低。当进行双侧连接时,发卡接头的稳定性以及是否含有磷酸基对连接效率影响较大。结果显示,当H2a磷酸化、H2b未磷酸化时,与靶标连接后剩余底物最少(Lane 13),说明连接效率最高。可能的原因是稳定性较低的H2a和H2b更易打开进行互相连接;而对于熔点较高的H1a和H1b,较难打开从而导致双侧连接的产率较低。

图4 发卡接头稳定性及磷酸化对连接靶标的影响
2.4 发卡动态接头连接灵敏度评价
本部分选取了高浓度靶标下连接效率较高的H2a和H2b发卡接头,精准评价H2a和H2b发卡接头对痕量靶标的连接情况。采用荧光定量PCR法测定接头与靶标连接后的产物量,从而对发卡接头的连接效率和环化靶标的灵敏度进行评价。具体原理是采用pUC18质粒中的271 bp双链DNA作为靶标(末端具有9 nt凸出的黏性末端),将靶标稀释至不同浓度后与发卡接头连接,然后利用荧光定量PCR检测连接产物,通过Ct值评价连接产物的含量。单侧连接后进行PCR时,位于发卡侧的下游引物3’端与靶标仅互补3 bp,剩余序列与发卡接头序列相同(见图5a)。因此,仅当发卡接头与靶标成功连接后才可发生PCR扩增。针对H2a单侧连接产物的PCR引物为F-H2a和R-H2a,针对H2b单侧连接产物的PCR引物为F-H2b和R-H2b(序列见表1)。当双侧连接时,发卡接头可将271 bp的靶标连接为环状双链DNA,PCR的引物设计于发卡接头两侧的靶标区。若双侧连接成功,则可跨越接头发生PCR扩增;若双侧连接未成功,则扩增区域不连续,无法发生PCR。双侧连接产物的PCR引物为F-271和R-271(见表1)。
图5b中分别表示了不同浓度靶标(103~109copies/μL)与H2a或H2b的单侧连接结果及靶标与H2a+H2b的双侧连接结果。结果显示,发卡动态接头与靶标连接后可成功扩增,且空白组无Ct值(数据未列出),说明发卡接头可以成功对痕量靶标进行单侧连接和双侧连接。随着靶标浓度的降低,Ct值均逐渐升高,说明连接产物量逐渐减少。单侧连接时,靶标浓度降低至105copies/μL以下Ct值不再变化,说明发卡接头单侧连接的灵敏度达105copies/μL。双侧连接时,靶标浓度低于106copies/μL时无法获得Ct值,说明发卡动态接头环化靶标的灵敏度为106copies/μL。
上述结果证实,发卡动态接头可通过使靶标两端产生连接活性差异提高靶标的环化灵敏度。而传统双链接头连接靶标两黏性末端的活性基本一致,在黏性末端长度为9 nt时,双链接头连接靶标两端难以形成一定的先后性。因此,传统TC-RCA灵敏度低的原因极有可能是两个双链接头同时占据靶标两端,且同种接头间无法互补配对,继而影响靶标环化。
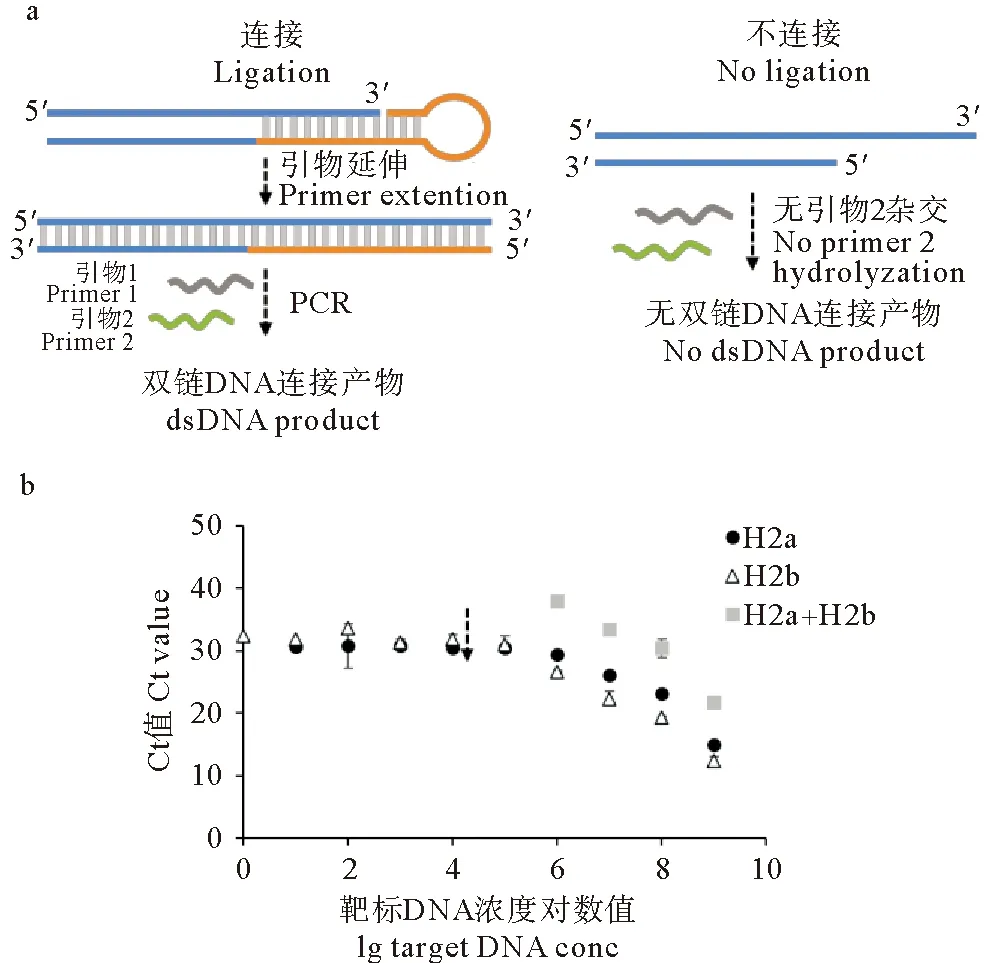
(a:单侧连接产物的PCR扩增方案;b:H2a、H2b与271 bp靶标连接后的荧光定量PCR结果。a: The PCR scheme of one-side ligation products. b: The RT-PCR results of the ligation products of 271 bp target with H2a and H2b.)
2.5 短接头环化558 bp靶标DNA
为进一步提高靶标环化的灵敏度,本研究又设计了一种长度为10 nt的短链动态接头,期望通过不稳定短链接头增加接头对靶标两端的连接活性差异,实现靶标的高灵敏度环化。短链接头的设计为将互补区域缩短至5 bp,且两端分别有5 nt的黏性末端。较短的互补区域使短链接头的稳定性降低,难以形成双链接头。又因接头两端的黏性末端GC含量不同,导致两端连接活性具有差异,从而抑制靶标两端同时连接两个双链接头。本部分设计的短链接头互补区域的GC含量为100%,两端黏性末端为HgaI限制性内切酶的酶切序列(见图6a),具体序列见表1。
短链动态接头连接的靶标长度为558 bp,序列也来自pUC18质粒。使用T4 DNA liagse在25 ℃的条件下连接不同浓度靶标并获得连接产物;随后,利用引物Ex-558a以及Ex-558b(见表1)进行荧光定量PCR检测环化后产物浓度。从图6b中可以看出,在靶标浓度为109~104copies/μL均有环化产物生成,当靶标浓度低于104copies/μL无Ct值测出且空白组也无有效Ct值,说明短链接头环化靶标的灵敏度为104copies/μL。

(a:短链接头的设计图;b:短链接头环化558 bp靶标DNA的产物进行RT-PCR的结果。a: The design of the short adaptors. b: The RT-PCR results of the circularization products of the target DNA with short adaptors.)
本研究构建了一种新型的发卡动态接头,探究了对靶标的环化情况,并且研究了发卡接头的稳定性和磷酸化位置等对接头环化靶标的影响。最初Wang等[18]设计的传统双链接头是由两条26 nt的单链部分互补,形成中间17~19 bp双链、两端各9 nt单链凸出末端的双链结构。17~19 bp的双链结构在连接温度55 ℃下难以打开,双链接头与靶标连接时会作为一个整体连接,且双链接头对于靶标两端的连接活性几乎无差异,因此接头会同时连接到靶标的两端,导致大多靶标两端均具有双链接头而最终无法环化为RCA的环状模板,致使RCA灵敏度降低。对于发卡动态接头,由于发卡结构的存在,两条发卡接头难以在体系中互补为双链接头,而是分别与靶标两端连接,然后在分子内黏性末端连接的优势下打开并发生环化,这样可极大程度避免靶标难以环化的问题。本研究设计的发卡接头最低可连接1×106copies/μL的靶标DNA。通过增大接头两端连接活性差异并减少互补部分的长度,改进后的短链动态接头的连接灵敏度可达1×104copies/μL。可见,利用结构、互补长度等产生的连接活性差异,可有效避免抑制环化的连接发生。后续还可通过进一步优化接头设计以及反应条件来提高接头对靶标的灵敏度。
3 结语
本研究通过探究发卡动态接头对TC-RCA靶标的环化情况以及发卡灵敏度和磷酸化对连接效率的影响,解释了TC-RCA灵敏度低的根本原因。即双链接头分别连接在靶标两端,导致无法进行环化。此外,通过设计一种新型的短链动态接头进一步提高了靶标的环化灵敏度,达104copies/μL。本研究构建的发卡动态接头和短链动态接头可应用于双链环状DNA制备、RCA扩增及基于RCA的基因检测和全基因组扩增等多个领域。本研究对于完善双链DNA的环化机理、进一步提高TC-RCA的检测灵敏度具有重要意义,同时对反向PCR等其他生物技术中双链DNA的连接和环化研究也具有很高的参考价值。
