豫西浅山区不同世代刺槐林土壤生物学特性
2021-03-23王雅慧彭祚登
王雅慧,彭祚登,李 云
(1.北京林业大学 林学院,省部共建森林培育与保护教育部重点实验室,北京 100083;2.北京林业大学 生物与技术学院,北京 100083)
土壤微生物是森林生态系统的重要组成部分,是土壤中生理生化反应的重要参与者。作为土壤养分重要的源和汇[1],对土壤物质周转起到重要的作用,并对土壤环境变化和养分有效性有很强的响应[2-3]。由于微生物个体微小,需要分子生物学方法克服传统观察法的局限,磷脂脂肪酸(Phospholipid fatty acid,PLFA)生物标记法被Frostegard[4]应用到土壤微生物分析后,开始被广泛用于土壤微生物群落结构的检测。土壤酶主要来源于土壤微生物、根系分泌及动植物残体释放[5],催化土壤中的生化反应,其活性可以反映土壤中生物化学反应的强度,是物质循环中最活跃的生物活性物质[6]。土壤可溶性碳、氮源自土壤微生物的生命活动和有机物的溶解[7],是微生物生长和生物分解过程中的重要能量来源,在森林土壤碳氮循环等养分循环中起到重要作用[8-9]。因此,本研究中的土壤生物学特性以土壤微生物群落结构、酶活性、可溶性有机碳和有机氮为特征指标。
河南省洛宁县在20 世纪60~70年代开始刺槐Robinia pseudoacacia种植,引种于朝鲜,造林40 余万亩,面积占当地用材林面积的60%以上[10]。作为该县的主要造林树种,在出产木材、水土保持等方面发挥了巨大的作用,又经过多次砍伐萌蘖更新,形成了不同世代及林龄的林分,为不同世代刺槐林土壤变化的研究提供了较为理想的对象,同时对豫西黄土类型区土壤条件的了解有一定的参考性。
目前刺槐对土壤作用的研究主要可分为横向和纵向两大类。按时间梯度上刺槐对土壤性质作用的纵向研究包括随刺槐生长年限的变化,土壤酶活性[11]、化学计量学[12]、养分的变化[13]、生态修复作用[14],小的时间尺度上的季节动态变化[15]等。随刺槐林龄的增加土壤微生物量、酶活性等土壤生物学特性得到改善的结论相对较多,而关于刺槐林世代经营过程中对土壤生物学特性影响的研究相对匮乏,多代刺槐林地与地力的关系如何还是个未知数,因此本研究选取相同林龄(地上部分)不同世代的林分,从土壤生物学特性的角度分析刺槐人工林多代经营中土壤性质的变化,为土壤地力维持机制及调控提供理论依据。
1 研究区概况与研究方法
1.1 试验地概况
试验地位于河南省西部的洛宁县国有吕村林场(111°15′~111°35′E、34°20′~34°32′N),地处崤山南部浅山区,海拔约700 m,是黄土高原的边缘地带。属大陆季风性气候,年均温13.9℃,年均降水量568 mm,年日照约2 006 h。土壤类型为幼褐土,母质为黄土。试验区内主要灌木为荆条Vitex negundovar.heterophylla、酸枣Ziziphus jujubavar.spinosa、野蔷薇Rosa multiflora,主要开花草本有蒲公英Taraxacum mongolicum、翅果菊Lactuca indica、黄花蒿Artemisia annua、夏至草Lagipsis supina等。
1 代刺槐人工林为实生苗造林形成的林分,2代林为1 代林皆伐后萌蘖形成,2 代林皆伐后萌蘖更新形成3 代林。轮伐期为15~20 a,对照地为灌木草地。
1.2 土壤样品采集方法
在2018年4月结合当地造林记录实地考察后,确定选择同世代的刺槐人工林样地以及对应的乡土植被作为对照样地。选取了东偏北的半阴坡、上坡位,人为干扰较弱的位置较为接近、立地条件一致的4 种样地,各样地基本情况见表1。在每代林分样地及对照样地中分别设置3 个20 m×20 m的样方。于2018年10月上旬在每个样方选定两株平均标准木,具有该样地的生长环境代表性,于其侧挖掘剖面,按前期土壤剖面调查,参考《LY/T1958—2011 森林可持续状况评价导则》从上到下分为枯落物层A、腐殖质层B(也称为淋溶层,到深20 cm 左右)、淀积层C(>90 cm),因此实际取样深度分别对应去掉表层枯落物后的0~5 cm,10~20 cm,40~60 cm,60~80 cm(本文中表示为A、B、C1、C2)的土壤约1 kg(避开20~40 cm 存在的过渡层),一份冷冻保存用于微生物的测定,一份风干处理用于测定酶活性等。

表1 样地基本信息†Table 1 General situation of sites
1.3 测定方法
土壤微生物群落结构采用磷脂脂肪酸(PLFA)法,冻土称量8 g,软件:MIDI Sherlock Microbial Identification System 6.0 (Microbial ID,Inc.125 Sandy Drive.Newark,DE 19713.);色谱:安捷伦6850N;检测器:FID;进样量2 μL;内标19∶0。脲酶测定用苯酚钠次氯酸钠显色法,活性以37℃下培养24 h 后每克土壤产生的铵态氮的质量(mg)表示。蔗糖酶活性测定用3,5-二硝基水杨酸比色法,以37℃培养24 h 后每克土壤产生的葡萄糖的质量(mg)表示。中性磷酸酶测定用磷酸苯二钠比色法,活性以37℃下培养24 h 后每克土壤中酚的质量(mg)表示。多酚氧化酶测定用邻苯三酚显色法,以30℃培养2 h 后每克土壤中紫色没食子素的毫克数表示(mg)。可溶性有机碳氮采用总有机碳分析仪测定[7]。
1.4 数据分析
采用SPSS 软件进行统计分析,单因素方差分析显著性(P<0.05),多重比较采用LSD 和Tukey 检验法(各组样本量不相等和相等时)[16],方差不齐时采用Cruskal-Wallis 秩和检验,Excel 2010制图。利用Canoco 4.5进行主成分分析并作图。
建立隶属度函数,参考翟辉等[17]的方法,用因子在各土层的平均值进行计算,因本文中各指标的作用均为正向,所以确定隶属度值的公式采用:

式中:Qi表示各因子的隶属度值,Xij表示实际值,Ximin和Ximax分别表示i项中的最小值和最大值。
各活性因子的作用大小权重Wi:

式中:Li为第i个因子的的因子负荷量。
土壤生物学活性指数(Soil biological activity index,SAI):

土壤微生物多样性指数(H)参考文献[18]:

式中:Pi是样品中某一特征PLFA 的含量在总PLFA 量中的比值,S是样品中所有特征PLFA 的总数。
2 结果与分析
2.1 多世代刺槐林的经营对土壤微生物群落的影响
不同样地土壤样品中共鉴定出46 种特征PLFA,细菌(a11:0、a12:0、i13:0、a13:0、i14:0、a14:0、i15:0、a15:0、i16:0、a16:0、i17:0、a17:0、i18:0、i19:0、10:0 3OH、12:0、13:0、14:0、15:0、i16:0、16:1w9c、16:1w7c、16:1w5c、16:0、cy17:0w7c、17:0、18:1w7c、18:1w5c、18:0、cy19:0w9c、cy19:0w7c、20:4w6c、20:0、22:0),放线菌(10Me16:0、10Me17:1w7c、10Me 17:0、10Me18:1w7c、10Me18:0、10Me19:1 w7c、10Me20:0),真菌(18:3 w6c、18:2w6c、18:1w9c、20:5w3c、20:1w9c),来表征微生物种类[19-26]。
4 个土层取样中各特征类群含量变化范围如图1,各微生物类群含量随土壤深度增加而降低(二代林地的A 层表现异常),上层土壤数值较大,下层土壤数值小。表征细菌的PLFA 含量在刺槐林世代经营过程中表现为二、三代林地>一代林地>对照地,最大值出现在二代林地B 层,为23.12 nmol·g-1,最小值出现在对照地的C2 层,为1.85 nmol·g-1。放线菌的特征PLFA 含量的变化趋势为二代林地>三代林地>一代林地、对照地,最大值出现在三代林地A 层,4.74 nmol·g-1,最小值出现在对照地的C2 层,0.33 nmol·g-1。真菌的特征PLFA 含量在各样地间的差异幅度小于其他菌群,与放线菌、细菌的变化趋势不太一致,最大值出现在一代林地A 层,2.62 nmol·g-1,最小值出现在对照地的C2 层,0.27 nmol·g-1。PLFA 生物标记的多样性代表着微生物群落的多样性,土壤微生物群落PLFA 生物标记的多样性指数结果显示,二、三代林地的表土层多样性指数稍高于对照地和一代林地,在深土层高于对照地和一代林地且差异较大,三代林地比对照地、一代林地在C2 土层的微生物多样性指数分别高30.77%、34.53%。

图1 各林地土壤特征微生物类群PLFA 量及微生物多样性指数在各样地土层的分布Fig.1 Content of soil soluble organic carbon and nitrogen in different generations of Robinia pseudoacacia
2.2 不同世代刺槐林土壤酶活性的比较
由表2可知,脲酶、蔗糖酶、中性磷酸酶三种酶活性的垂直差异比较明显,表层土酶活性高于深层土,多酚氧化酶则变化不大。在不同世代刺槐林地间土壤酶活性存在差异(P<0.05),总体随世代增加是上升的,表层变幅大于深层。
在A 土层,三代林地的脲酶和蔗糖酶活性最强(P<0.05),脲酶活性相比于一、二代林、对照地分别高180.95%、202.56%、187.80%,在一、二代林、对照地间差异不显著,蔗糖酶则分别高37.32%、18.72%、7.67%。二代林地中性磷酸酶和多酚氧化酶活性最强,但中性磷酸酶在各样地间差异不显著(P>0.05)。土深B 处,除脲酶在三代林地活性最强外,蔗糖酶、中性磷酸酶和多酚氧化酶均在二代林地出现最高值。土深C1 处,各样地间脲酶无显著性差异,蔗糖酶活性在二、三代林地显著高于一代林地和对照地(P<0.05),中性磷酸酶活性表现为一二带林地高于三代林地、对照地,多酚氧化酶是二代林>三代林>对照>一代林地,土深C2 处,脲酶和多酚氧化酶在各样地间均间差异不显著(P>0.05),蔗糖酶活性表现为三代林>二代林>一代林>对照地,中性磷酸酶在样地间差异很小,有林地间差异不显著(P>0.05),对照地相对较低。
2.3 各样地土壤微生物群落与酶性质组成特征差异
对4 个样地的46 种微生物磷脂脂肪酸含量及4 种酶活性综合进行主成分分析,可以从整体看1、2、3 代刺槐林与CK 对照样地中土壤基本生物学性质是否有差异。如图2所示,第一主成分(PC1)解释了微生物群落结构总变异的93.2%,第二主成分(PC2)解释了5.9%。A 层和B 层土壤的各样地及对照地明显可以区分开来,而土层越深,本试验中的C1、C2 层,样地间差异较小,各样地间区分不明显。

表2 各土层不同样地的土壤酶活性†Table 2 Soil enzyme activity in different soil layers of different sites mg·g-1
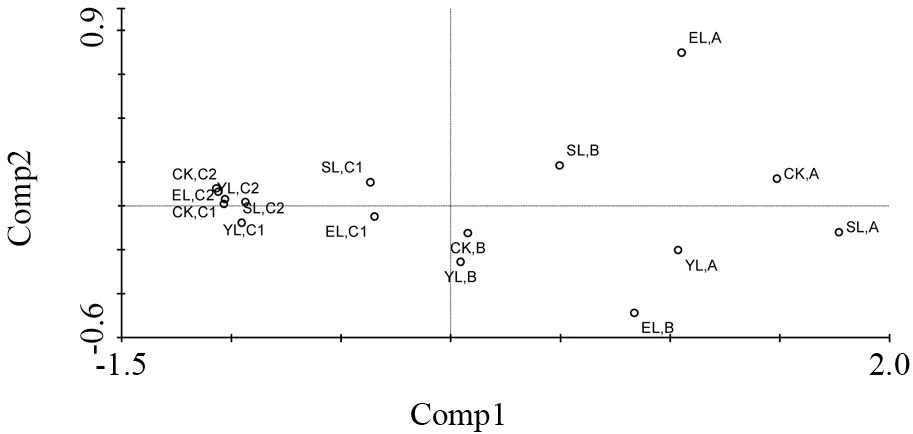
图2 各样地土层土壤微生物PLFA 与酶活性综合主成分分析Fig.2 Principal component analysis of microbial group’s PLFA and enzyme activity in in different soil layers of different sites
2.4 不同世代刺槐林土壤可溶性有机碳氮的比较
本试验种土壤可溶性有机碳量含量范围为11.41~26.67 mg·kg-1,由图3a 可以看出,在B、C1、C2 层各样地间差异不显著,在A 层二代林地高于一、三带林地,显著高于对照地(P<0.05)。在表土层中,二代林>三代林、一代林>对照地。
土壤可溶性有机氮含量范围为4.34~6.52 mg·kg-1(图3b)。同一土层均表现出二、三代林地略高于一代机林地、对照地的趋势。总体上可溶性有机碳氮含量由高到低分别为二代林、三代林、一代林、对照地。

图3 不同世代刺槐林土壤可溶性有机碳、氮含量Fig.3 Content of soil soluble organic carbon and nitrogen in different generations of Robinia pseudoacacia
2.5 土壤生物学活性指数
选取的7 个指标的第一主成分贡献率为60.25%,第二主成分贡献率为24.44%,两主成分可以代表原变量的信息,因此可用各指标的因子负荷量确定权重,可溶性有机碳、可溶性有机氮、脲酶、蔗糖酶、中性磷酸酶、多酚氧化酶、总PLFA量的权重分别为0.075、0.177、0.157、0.183、0.116、0.140、0.153,经计算得一代刺槐林地、二代刺槐林地、三代刺槐林地、对照地的土壤生物学活性指数(SAI)分别为0.22、0.77、0.75、0.09。即各样地土壤生物学特性综合比较结果从大到小依次为二代林地、三代林地、一代林地、对照地,二、三代林地差值非常小。

表3 土壤生物学活性因子隶属度值Table 3 Membership function value of soil biological activity factor
3 讨 论
通过主成分分析发现,两个主成分足以把各样地的土壤微生物群落和酶区分开,说明在种植刺槐林后,当地的土壤生物性质发生了明显的变化。同时,浅层土和深层土区分度的差异可以说明原始微生物群落组成相近,而刺槐种植年限的影响及根系、枯落物的作用显著影响了浅层土性质的变化。
细菌、真菌、放线菌是构成土壤微生物的主要生物种群。随着刺槐世代的增加,土壤微生物量总体呈增加趋势,与以往的研究结果中林龄是造成这种差异主要因素相似[24,27],都是时间梯度上变化。在有林地中,随着刺槐种植时间的增加,植物生长、生物量积累,林下的物质积累也较大。刺槐林内环境在一代林中处于开始发展阶段,经历了整地造林,二、三代林林下植被恢复,且更新过程中没有重新整地,为土壤微生物提供更多的生存条件,可能因此有着较高的微生物多样性。有林地与对照地相比,微生物总量高于对照地,可能跟刺槐是固氮树种有关,固氮树种提高了氮的可利用性[28],生产力较高,可为更多的微生物提供基础代谢物质。真菌在养分较低的条件下更具有竞争力[29],甚至高含氮量的土壤真菌菌落生物量会减少。此外,有研究发现真菌群落的减少有利于复杂有机复合物在土壤中的积累[30],所以这可能是研究中真菌群落与其他微生物类群分布差异较大的原因。
可表征土壤生物活性的土壤酶[31]的活性高低与土壤肥力高低有关。脲酶是参与土壤氮转换的关键酶,可把有机氮转化为有效态氮[32]。蔗糖酶参与土壤有机碳的循环,其活性反映了有机碳的转化速率及土壤呼吸强度,因而可表征微生物活性和土壤肥力[5]。本研究试验地pH值在7.06~7.14之间,所以所测磷酸酶为中性磷酸酶,磷酸酶影响着土壤中有机磷的生物有效性,因此这三种酶可以反映土壤碳氮磷养分的供应状况。土壤多酚氧化酶在芳香族有机化合物转化为腐殖质的过程中起作用。杨承栋等[33]的研究表明多酚氧化酶活性与真菌多样性呈极显著正相关,与本文中多酚氧化酶在同样地各土层间的变化量较小,而真菌也相较于其他类群在土层间的变化量较小这两个结果相一致。土壤酶活性与土壤养分,植被类型,立地环境等条件有关,本研究中二、三代林地土壤酶活性整体均高于一代林和对照地,反映了其养分状况较好(与本课题的试验结果一致)及较强的微生物活性。上层土壤通气性好,养分含量高,微生物更活跃,因此土壤酶也表现出垂直性差异。
土壤可溶性碳和可溶性氮作为生物活性碳、氮,主要来自于植物根系、土壤腐殖质以及微生物分泌物等,是微生物生长和生物分解过程中的重要能量来源[34],可被微生物直接利用[35]。本试验中,同一土层可溶性氮含量均表现出二、三代林地高于一代林地、对照地的趋势,总体上由高到低分别为二代林地、三代林地、一代林地、对照地。原因可能是刺槐及其林下植被给土壤可溶性有机氮提供了较多的来源,同时,与一代林地和对照地相比,二、三代林地的土壤微生物多样性较高,可能是与氮转换有关的微生物在刺槐林地中较为活跃。相较于可溶性有机氮,可溶性有机碳表现出相似的趋势,但其在各样地间的差异相对于可溶性有机氮而言较小。以表土层为例,本研究发现二、三代林地的可溶性有机碳、氮含量是高于一代林地的,但各样地可溶性有机碳与土壤有机碳含量的比值从一代林低到对照地分别是0.37%,0.24%,0.2%,0.16%,可溶性有机氮与土壤全氮含量的比值从一代林地到对照地分别是0.83%,0.54%,0.60%,0.51%,二、三代林地反而较低,其原因可能是一代林地的有机碳和全氮的、含量低于二、三代林地,因此两者比值较大。此外,可能是一代林地目前正在处于初始积累阶段,更多的碳氮以活性较高的可溶性碳、氮存在,可看作是一种负反馈,一代林地的增长幅度高于二、三代林地。
本研究中未涉及不同龄级对土壤性质的影响,林木不同发育阶段生理机能及组成是不一样的,伴生动植物组成可能会有差别,同时未进一步确定各种环境因子与土壤微生物等生物特性因子的关系。在对刺槐土壤生物学特性的研究中,大型土壤动物,各种昆虫和蚯蚓等,它们与土壤微生物共同作用于土壤,促进能量流动和养分周转,与刺槐固氮作用相关的微生物等都需要进一步研究。
4 结 论
1)细菌、放线菌磷脂脂肪酸含量、微生物群落的多样性指数在刺槐林各代经营过程中整体表现为二、三代林地>一代林地>对照地。土壤微生物PLFA 的主成分分析结果表明,不同经营世代导致四个样地的微生物群落结构差异明显,在刺槐种植及世代经营过程中整体土壤微生物结构含量发生了变化。
2)脲酶、蔗糖酶、中性磷酸酶在表层土中活性高于深层土,多酚氧化酶垂直变化较小。在各代刺槐林地间土壤酶活性存在差异(P<0.05),二、三代林地土壤酶活性整体均高于一代林和对照地,且表层增幅大于深层。
3)试验地土壤可溶性有机碳量范围为11.41~26.67 mg·kg-1,整体表现为二代林地>一、三代林地>对照地。土壤可溶性有机氮范围为4.34~6.52 mg·kg-1,整体表现为为二、三代林地>一代林地>对照地。
4)一代刺槐林地、二代刺槐林地、三代刺槐林地、对照地的土壤生物学活性指数(SAI)分别为0.22、0.77、0.75、0.09,在豫西浅山黄土丘陵区种植刺槐能有效提升土壤生物学活性,多代经营到第三代也保持着较高的水平。
