二茂铁卟啉化合物的合成及其取代基效应
2021-03-23张听雨李雪梅张加研庄长福
张听雨,崔 旭,王 瑛,李雪梅,张加研,庄长福
(西南林业大学 化学工程学院,昆明 650224)
卟啉化合物在自然界中广泛存在,可构成细胞色素、叶绿素及血红蛋白等生物大分子. 利用卟啉化合物进行功能分子设计、合成和应用基础研究,在电化学、材料化学、有机化学、光物理与光化学、仿生学、药物化学、分析化学等领域已引起人们广泛关注[1-5]. 二茂铁具有芳香性富电子体系,以及可逆氧化还原电对的特点. 将二茂铁与卟啉连接,由于二茂铁的氧化电势低,可作为电子的给体将电子传递给卟啉化合物,进而降低卟啉的氧化电势,使卟啉更易氧化;引入二茂铁还可减小π电子最高占据分子轨道(HOMO)和最低未占分子轨道(LUMO)的能级差,改善卟啉的光吸收和发光性能. 因此二茂铁修饰的卟啉分子是性能优良的光敏剂,可应用于光电化学传感及器件、光诱导电子转移及模拟光合反应、主客体化学、氧化还原催化剂、分子水平信息存贮等领域. 由于键连二茂铁基的卟啉具有独特的电子和空间结构、特殊的光谱和电化学性质,因此卟啉化合物的合成及应用已引起研究者的广泛关注[6-10]. 若将二茂铁卟啉的大环上连接不同取代基,通过改变二茂铁卟啉的结构影响其电子效应,则可设计和开发新型的二茂铁卟啉类功能分子. 本文合成3种不同取代基的二茂铁卟啉,用紫外-可见吸收光谱、荧光光谱、Raman光谱以及循环伏安法研究二茂铁卟啉化合物的光谱与电化学特征,并分析不同取代基效应对二茂铁卟啉化合物的影响,为卟啉的结构功能设计提供依据.
1 实 验
1.1 仪器与试剂
Shimadzu UV-365型紫外吸收光谱仪和Shimadzu RF-5301型荧光光谱仪(日本Shimadzu公司);Varian MERCORY-300型核磁共振波谱仪(美国Varian有限公司);Nicolet 5PC FT-IR型红外光谱仪(美国Thermo Fisher Scientific公司);Renishaw in Via型共聚焦显微Raman光谱仪(英国Renishaw plc公司);CHI660型电化学工作站(美国CH公司). 所用试剂均为分析纯化学试剂.
1.2 实验过程
二茂铁卟啉的合成路线如图1所示.
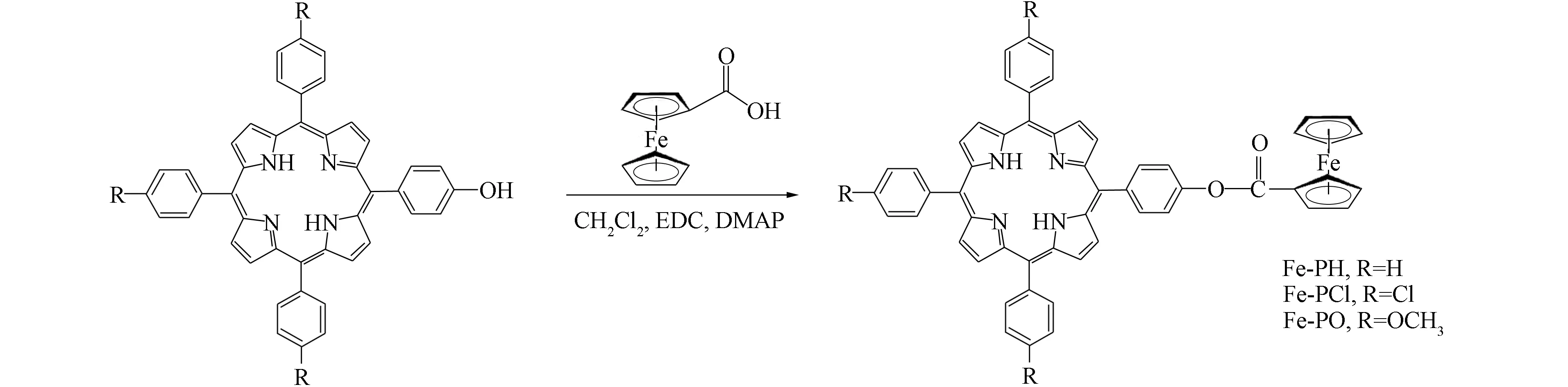
图1 二茂铁卟啉的合成路线线Fig.1 Synthesis route of ferrocene porphyrins
1.2.1 不同取代基的单羟基卟啉化合物合成
四苯基卟啉(TPP),5-(4-羟基)苯基-10,15,20-三苯基卟啉(PH)、5-(4-羟基)苯基-10,15,20-三(4-甲氧基)苯基卟啉(PO)和5-(4-羟基)苯基-10,15,20-三(4-氯)苯基卟啉(PCl)按文献[11]方法合成.
1.2.2 不同取代基的二茂铁卟啉化合物合成
以5-(对-甲酰基二茂铁)苯基-10,15,20-三苯基卟啉(Fe-PH)为例. 向装有二氯甲烷(20 mL)的三口瓶中加入二茂铁甲酸(50 mg)和4-二甲氨基吡啶(DMAP,50 mg),再加入三乙胺(2 mL),用冰浴冷却,然后加入1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐(100 mg). 搅拌0.5 h后,将5-(4-羟基)苯基-10,15,20-三苯基卟啉(150 mg)加入反应液中,在常温下反应24 h. 反应结束后加入250 mL水,通过二氯甲烷萃取浓缩,用硅胶进行柱层析,淋洗剂为V(二氯甲烷)∶V(乙酸乙酯)=5∶1,收集第一色带,5-(对-甲酰基二茂铁)苯基-10,15,20-三苯基卟啉(Fe-PH)产率为63%.
5-(对-甲酰基二茂铁)苯基-10,15,20-三(对-甲氧基)苯基卟啉(Fe-PO)、5-(对-甲酰基二茂铁)苯基-10,15,20-三(对-氯)苯基卟啉(Fe-PCl)的合成方法类似. 其UV-Vis,IR,1H NMR,MS数据如下.
1) Fe-PH: UV-Vis(CHCl3)λabs/nm: 420,515,551,590,649;IR(cm-1): 498w,798w,966w,1 198s,1 268vs,1 518s,1 596s,1 734vs,3 317w;1H NMR(CDCl3,500 Hz,δ): -2.78(2H,吡咯 N—H),4.45~4.46(5H,—C5H5),4.61~4.63(2H,m-C5H4COO),5.13~5.15(2H,o-C5H4COO),7.59~7.63 (2H,ArO-o-H),7.74~7.83(9H,Ar-m,p-H),8.22~8.32(8H,Ar-o-H),8.86~8.94 (8H,—吡咯);MS(m/z,计算值): 841.6(842.2).
2) Fe-PO: UV-Vis(CHCl3)λabs/nm: 421,516,553,591,650;IR(cm-1): 498w,798w,966w,1 198s,1 250vs,1 268w,1 518s,1 596s,1 734vs,3 317w;1H NMR(CDCl3,500 Hz,δ): -2.75(2H,吡咯 N—H),4.10~4.12(9H,—OCH3),4.44~4.46(5H,—C5H5),4.61~4.62(2H,m-C5H4COO),5.14~5.15(2H,o-C5H4COO),7.28~7.33(6H,Ar-m-H),7.59~7.62(2H,ArO-m-H),8.13~8.17(6H,Ar-o-H),8.28~8.29(2H,Ar-o-H),8.88~8.93(8H,—吡咯);MS(m/z,计算值): 931.7(932.3).
3) Fe-PCl: UV-Vis (CHCl3)λabs/nm: 418,515,551,590,649;IR(cm-1): 498w,798w,966w,1 092vs,1 198s,1 268w,1 518s,1 596s,1 734vs,3 317w;1H NMR(CDCl3,500 Hz,δ): -2.84(2H,吡咯N—H),4.36~4.48(5H,—C5H5),4.59~4.63 (2H,m-C5H4COO),5.13~5.15(2H,o-C5H4COO),7.60~7.63(2H,ArO-m-H),7.75~7.78(6H,Ar-m-H),8.14~8.17(6H,Ar-o-H),8.25~8.28(2H,Ar-o-H),8.85~8.88(6H,—吡咯),8.95~8.96(2H,—吡咯);MS(m/z,计算值): 943.3(944.1).
2 结果与讨论
2.1 不同取代基二茂铁卟啉的表征
不同取代基效应对二茂铁卟啉的质子化学位移影响:δ在-2.84~-2.75 处为卟啉环中吡咯 N—H 质子的特征峰,与 Fe-PO 和 Fe-PH 相比,Fe-PCl卟啉环吡咯的 N—H化学位移峰-2.84向高场移动0.09,可能是因为吸电子基(Cl)使H质子的屏蔽效应增强所致;对于Fe-PH,7.74~7.83(9H,Ar-m,p-H)处是与卟啉相连苯环的对位和间位质子的化学位移;对于Fe-PO和Fe-PCl,因为受对位取代基影响,苯环的邻位和对位质子化学环境不同,分别裂分为两组多重峰,Fe-PCl 的苯环邻位质子的化学位移分别为8.14~8.17(6H,Ar-o-H)和8.25~8.28(2H,Ar-o-H),间位质子的化学位移分别为7.60~7.63(2H,ArO-m-H) 和7.75~7.78(6H,Ar-m-H);Fe-PO的化学位移分别裂分为两组多重峰,邻位质子的化学位移分别为8.13~8.17(6H,Ar-o-H)和 8.28~8.29(2H,Ar-o-H),间位质子的化学位移分别为7.28~7.33(6H,Ar-m-H) 和7.59~7.62(2H,ArO-m-H); 对于Fe-PO,δ在4.10~4.12处的化学位移单峰是甲氧基的质子,二茂铁靠近酯基键的茂环质子化学位移出现在较低场5.14~5.15(2H,o-C5H4COO)处,远离酯基键的茂环质子化学位移出现在4.61~4.62(2H,m-C5H4COO) 处,由于未取代茂环的化学位移远离酯基键,因此出现在较高场4.44~4.468(5H,—C5H5)处. 通过核磁共振氢谱,证明不同取代基的卟啉环上已连接二茂铁[8-10].
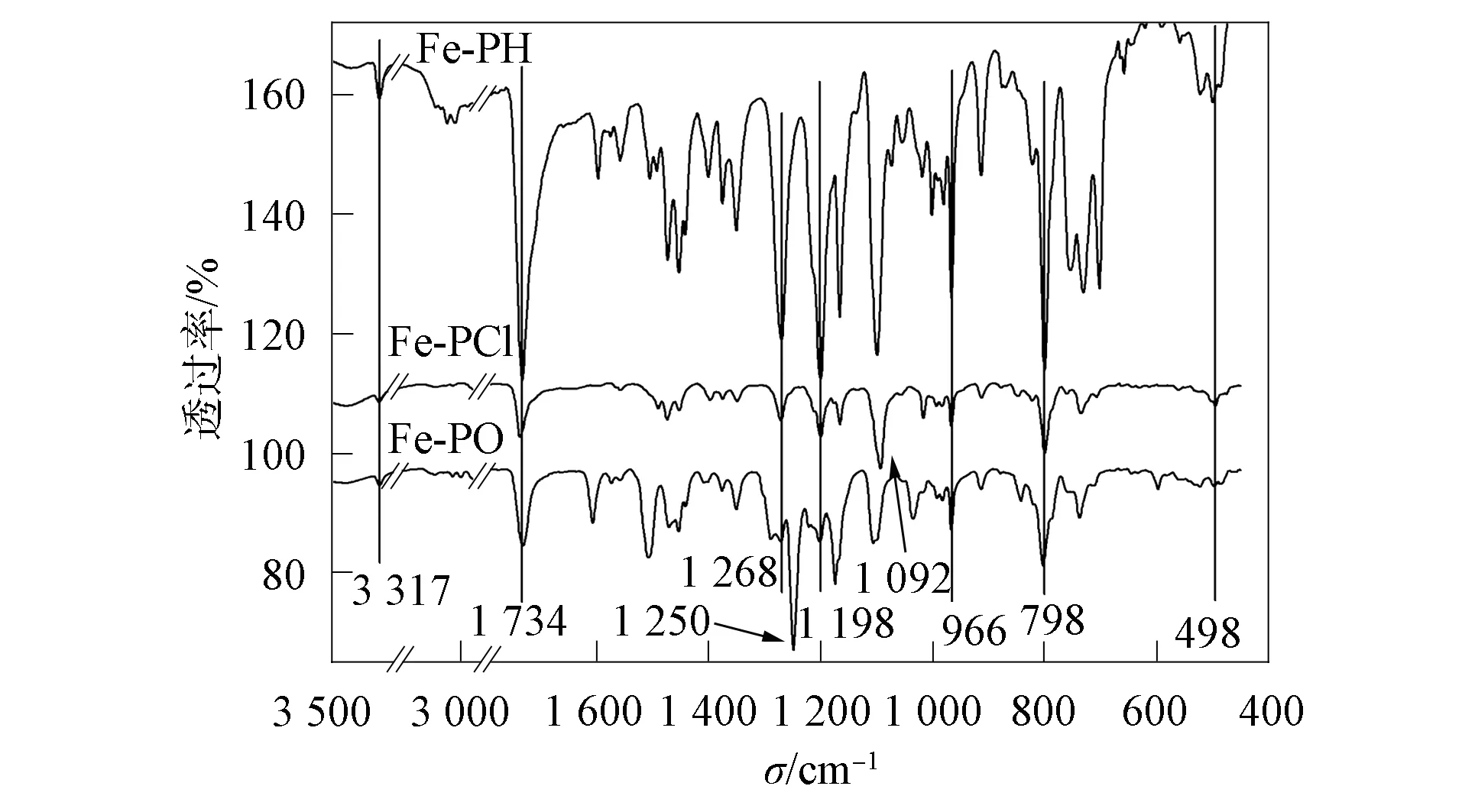
图2 Fe-PH,Fe-PCl 和 Fe-PO 的红外光谱Fig.2 IR of Fe-PH,Fe-PCl and Fe-PO

2.2 不同取代基效应对二茂铁卟啉的影响
2.2.1 不同取代基二茂铁卟啉的紫外-可见光谱
紫外-可见光谱可反映Fe-PH 在基态电子上的相互作用情况. 不同卟啉的紫外-可见光谱如图3所示. 由图3可见,由Fe-PH 分子a1μ(π)-eg(π*) 跃迁产生的 Soret带出现在420 nm处,由a2μ(π)-eg(π*) 跃迁产生的4个Q带分别位于515,550,590,650 nm处. 四苯基卟啉(TPP)的Soret带出现在419 nm处,4个Q带分别位于515,551,590,649 nm处. Fe-PH 的吸收带相对于TPP峰宽变化较小,仅移动了1 nm,表明二茂铁和卟啉在基态几乎未发生相互作用[11-12]. 不同取代基二茂铁卟啉相对Fe-PH 的紫外吸收发生相反作用: 给电子基(CH3O)使Fe-PO(421 nm)的吸收相对Fe-PH(420 nm)发生微小红移;吸电子基(Cl)使Fe-PCl的紫外吸收(418 nm)相对Fe-PH(420 nm)发生微小蓝移. 由于移动均较小,因此不同取代基对二茂铁卟啉间的相互作用影响均较小[13].
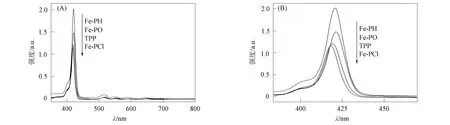
图3 TPP,Fe-PH,Fe-PCl 和 Fe-PO 的紫外-可见光谱(A)及局部放大图(B)Fig.3 UV-Vis spectra of TPP,Fe-PH,Fe-PCl,Fe-PO (A) and partial enlargment (B)
2.2.2 不同取代基二茂铁卟啉的荧光光谱
图4为连接不同取代基二茂铁卟啉的荧光光谱,不同取代基卟啉的荧光数据列于表1. 由表1可见,Fe-PH的荧光量子产率(Φ=0.033)远小于羟基卟啉P-OH的荧光量子产率(Φ=0.168),即发生了荧光淬灭,淬灭率约为80%,表明Fe-PH在激发态时卟啉和二茂铁间发生了电子转移[13]. 由图4可见,连接不同取代基的二茂铁卟啉,荧光强度按Fe-PO,Fe-PH 和 Fe-PCl依次递减. 相对于Fe-PH,给电子基 (CH3O) 使Fe-PO的发射光谱强度增加,荧光量子产率增大,吸电子基(Cl) 使Fe-PCl的发射光谱强度减小. 这可能是因为给电子基增大了卟啉环的电子云密度,增强了卟啉大环的π共轭能力,同时二茂铁卟啉的HOMO和LUMO能量差增加,减少了卟啉的S1→T1系间窜跃和S1→S0间内转化,导致荧光量子产率增加. Fe-PH与Fe-PO的量子产率相差较小,与Fe-PCl的量子产率相差较大,表明给电子基比吸电子基对卟啉荧光的影响小,因此通过调控卟啉周边的取代基,可获得不同荧光强度的卟啉化合物[14].
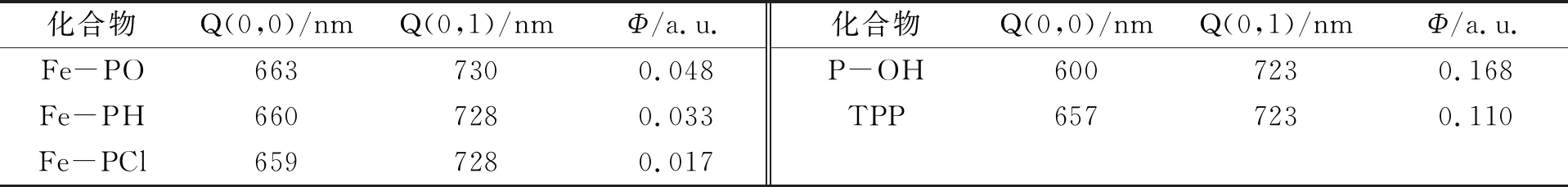
表1 不同取代基卟啉的荧光数据
Fe-PO的荧光 (663,730 nm) 位于 663 nm 处,与Fe-PH(660,728 nm),Fe-PCl (659,728 nm) 的660,659 nm相比有3~4 nm 红移,可能是由于卟啉周边取代基CH3O—的给电子能力强于苯环的H—基,而且CH3O—上孤对电子的电子云和卟啉环的共轭π电子的电子云平行,使给电子基CH3O—孤对电子和卟啉环共同分享共轭π轨道,扩大了卟啉环的共轭体系,这种作用表现在发射波谱中为波长红移. 而Fe-PCl由于连接吸电子基(Cl—)表现为谱带蓝移. 因此发射谱中波长的位置是蓝移和红移因素共同作用结果,取决于取代基种类、分子内作用等影响因素相互竞争的结果[14].
2.2.3 不同取代基二茂铁卟啉的Raman光谱
Raman光谱可反映由外围取代作用引起的卟啉环面外和面内的变形情况. 不同取代基二茂铁卟啉的Raman光谱如图5所示,Raman光谱数据及其归属列于表2[11,15]. 由图5可见:在1 567~1 599 cm-1,1 453~1 460 cm-1,1 001~1 002 cm-1,808~827 cm-1处出现卟啉的苯环特征谱带;在1 547~1 554 cm-1,1 494~1 499 cm-1,1 240~1 242 cm-1,1 082~1 084 cm-1,323~336 cm-1处出现卟啉环的骨架振动带. 由表2可见,Fe-PH在827 cm-1处的峰归属为苯环的形变振动,不同取代基使 Fe-PCl(808 cm-1)和Fe-PO(811 cm-1)处的峰均向低波数移动,其中吸电子取代基影响较大,产生了19个波数的频移. 1 460 cm-1处的峰归属于Fe-PH 的苯环对称振动Raman频移,Fe-PCl 和Fe-PO对应的峰分别在1 455,1 453 cm-1处,可见取代基团对该振动模式影响较大,分别有5,7个波数的频移,两种取代基对苯环的影响相近. Fe-PH中出现的1 576 cm-1处振动峰归属于苯环振动,Fe-PCl和Fe-PO 的Raman谱带分别出现在1 567,1 599 cm-1处,可见给电子基团使振动谱带向低频移动,吸电子基团使苯环吸收谱带向高频移动,表明不同取代基对苯环振动产生了不同影响[15].
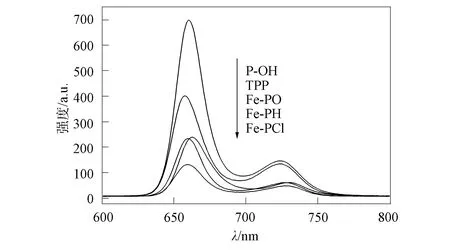
图4 不同取代基卟啉的荧光光谱Fig.4 Fluorescence spectra of porphyrins with different substituents
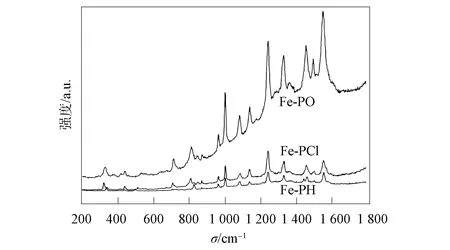
图5 Fe-PH,Fe-PCl和Fe-PO的Raman光谱Fig.5 Raman spectra of Fe-PH,Fe-PCl and Fe-PO
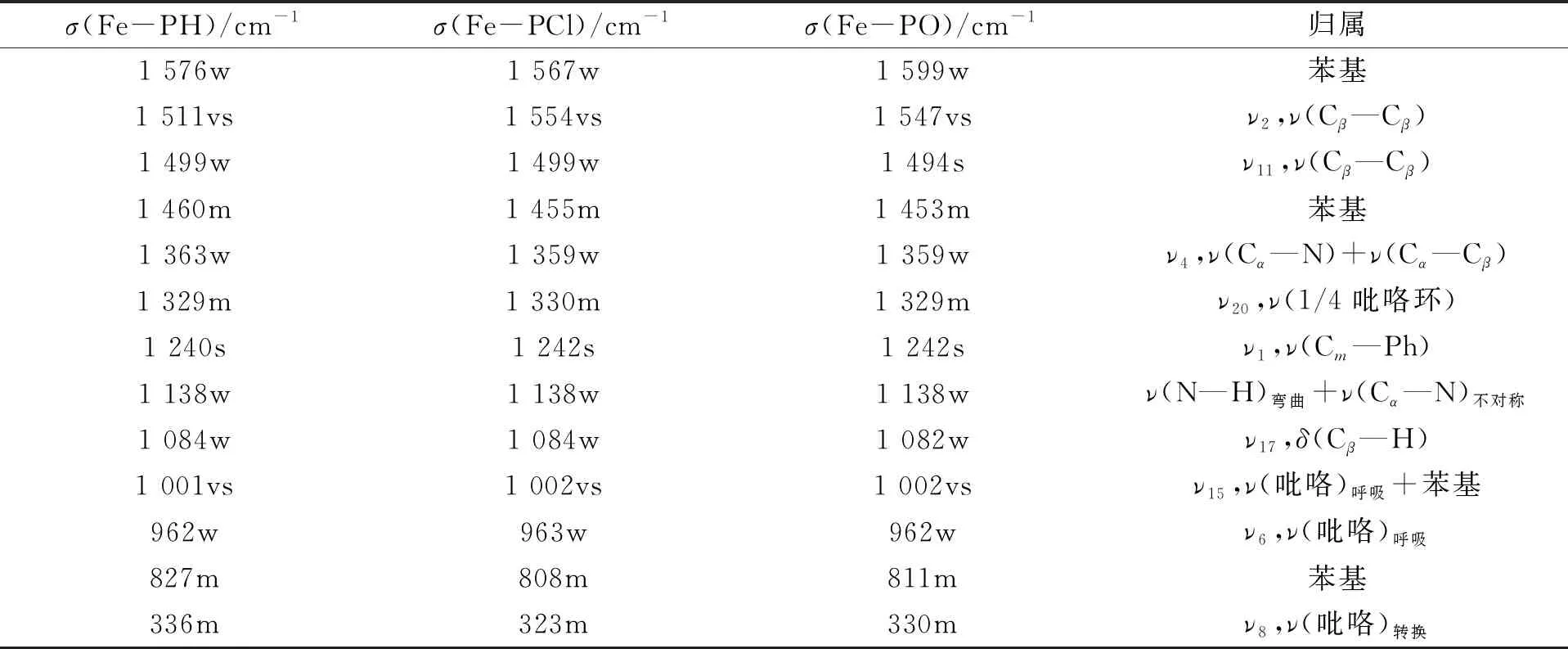
表2 Fe-PH,Fe-PCl和Fe-PO的Raman光谱数据及其归属
Fe-PH,Fe-PCl 和 Fe-PO 的Raman峰分别位于336,323,327 cm-1处,归属于对称模式的吡咯环跃迁振动,可见给电子基对该振动频率影响较小,而吸电子基对该频率影响较大,产生了13个波数的频移. Fe-PH,Fe-PCl和Fe-PO的Raman频移分别位于1 551,1 554,1 547 cm-1处,归属于全对称模式Cβ—Cβ的伸缩振动,表明给电子基和吸电子基对Cβ—Cβ键长的影响不同:给电子基使Cβ—Cβ键长变短,吸电子基使Cβ—Cβ键长变长[15]. 上述结果表明:不同取代基对苯环振动影响较大,但对卟啉环的骨架振动影响较小;不同取代基对Cβ—Cβ键振动影响较大;在二茂铁卟啉中,二茂铁与卟啉的Raman振动重叠,所以没有归属二茂铁的Raman振动带[15-17].
2.2.4 不同取代基二茂铁卟啉的电化学
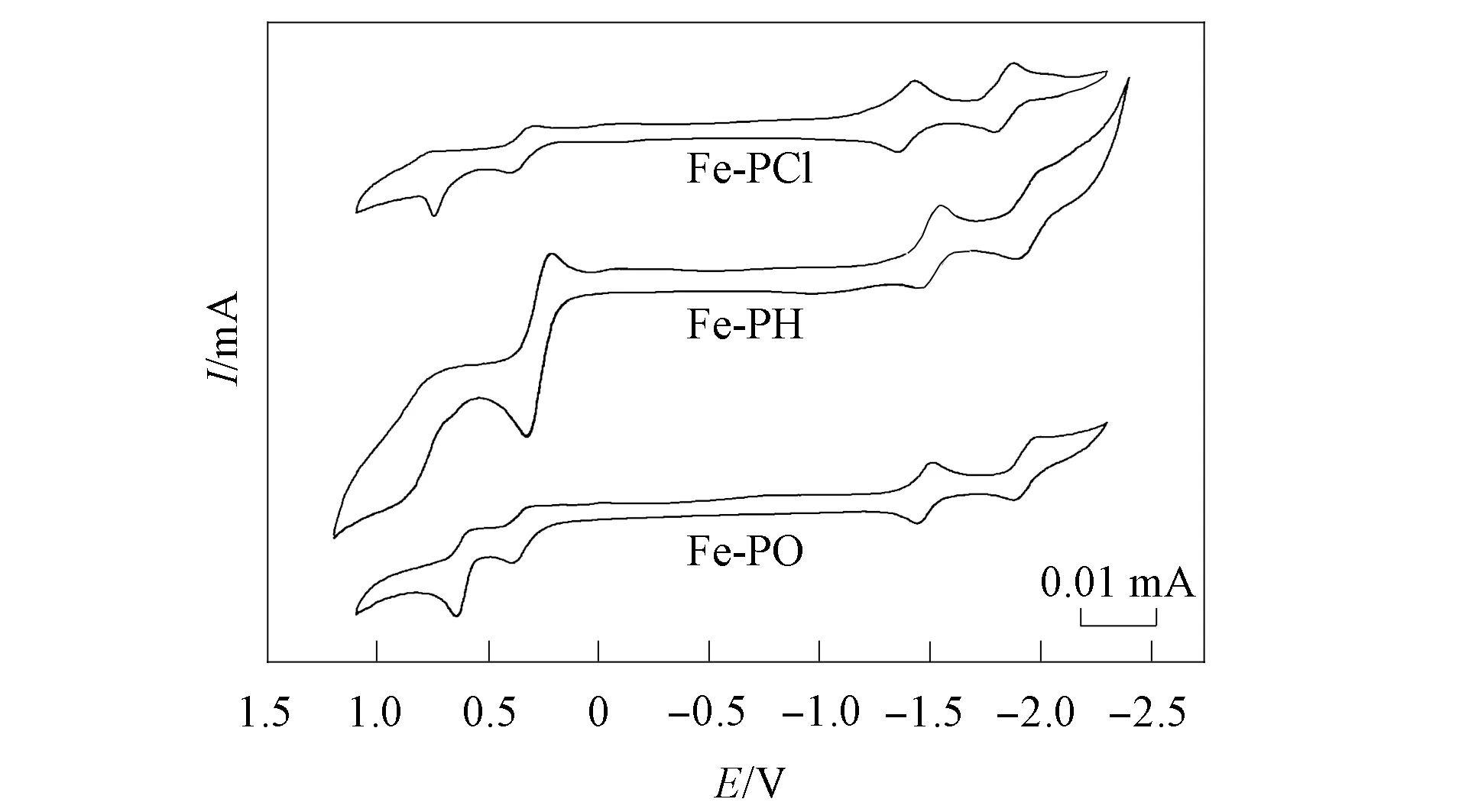
图6 Fe-PH,Fe-PCl和Fe-PO的循环伏安曲线Fig.6 Cyclic voltammetry curves ofFe-PH,Fe-PCl and Fe-PO
图6为不同取代基卟啉的循环伏安曲线,其半波电位(E1/2=(Epa+Epc)/2) 数据归属列于表3. 由图6和表3可见,卟啉的第一氧化电位和第一还原电位差值与卟啉环发生氧化还原反应的理论差值ΔE=(2.25±0.15)V一致,且每对氧化还原峰的差值均大于59 mV,判断为准可逆氧化还原过程[17]. Fe-PH的第一氧化半波电位相对四苯基卟啉(TPP)发生了明显负移,从1.00 V降到0.70 V,可见在卟啉分子中引入具有给电子作用的二茂铁取代基,可增大卟啉大π键共轭大环上的电子云密度,因此在电化学反应中易失去电子,使Fe-PH的半波电位负移,同时卟啉的HOMO和LUMO的能量差增加,导致Fe-PH比TPP更易被氧化[16]. 而二茂铁的氧化电势降低幅度较大,峰电位由0.49 V移动到0.35 V附近,表明在二茂铁通过酯基桥连的卟啉中,卟啉对二茂铁的氧化还原电势影响较大,主要是由于卟啉与二茂铁单元的电子作用较强,使二茂铁单元更不易失去电子所致[8-10].

表3 Fe-PO,Fe-PH和Fe-PCl的半波电位及其归属
相对于Fe-PH与Fe-PO的氧化还原半波电位均向负电位移动,Fe-PCl的情形相反. Fe-PH的第一和第二还原半波电位分别从-1.45,-1.90 V 负移至-1.47,-1.93 V 处,第一氧化半波电位发生了明显的负移,从0.70 V负移至0.61 V. 根据前线轨道理论,分子的HOMO和LUMO与分子的的起始氧化电位(Eoneset-ox)和还原电位 (Eoneset-red)间的计算公式可表示EHOMO=(Eoneset-ox+4.72)eV,ELUMO=(Eoneset-red+4.72)eV,计算的分子前线轨道能量列于表4. 在 Fe-PO卟啉环中以给电子基(CH3O—)取代Fe-PH的H后,由于给电子能力更强的取代基(CH3O—)使卟啉环电子云密度增加,使其在电化学反应中易失去电子,使Fe-PO的半波电位负移,同时卟啉的EHOMO和ELUMO的能量差从1.59 V 增加至1.62 V,导致Fe-PO比Fe-PH更易失去电子被氧化;而Fe-PH中苯环的吸电子取代基(Cl—)使卟啉环的电子密度减小,导致其易得到电子被还原,使Fe-PCl的氧化电位正移,同时卟啉的EHOMO和ELUMO的能量差从1.59 V 减小至1.47 V,即Fe-PCl更易被还原[9-12].

表4 Fe-PO,Fe-PH和Fe-PCl的氧化还原电位
综上所述,本文设计合成了不同取代基的二茂铁卟啉化合物,并用核磁共振氢谱、紫外可见光谱和红外光谱表征了其结构. 结果表明:不同取代基对苯环振动影响较大;给电子基 (CH3O—)使卟啉荧光光谱红移,量子产率增大,在电化学反应中易失去电子,更易被氧化;吸电子基(Cl—)的结果相反. 因此可通过改变卟啉周边不同的取代基调控二茂铁卟啉光谱和电化学性能,为卟啉功能化合物的设计与研究提供参考依据.
