水环境下甲硫氨酸混合体系手性转换反应物的电子激发特性
2021-03-23陈洪斌
李 莹,陈洪斌
(吉林医药学院 生物医学工程学院,吉林 吉林 132013)
甲硫氨酸(Met)是组成生物体蛋白质的重要氨基酸之一. 文献[1]用热重分析法(DTA-TGA)研究了甲硫氨酸的热分解行为及动力学规律,结果表明,甲硫氨酸在熔融过程中伴随着分解反应;文献[2]研究了D-Met与联合应用周期特异性化疗药物诱导胃癌细胞凋亡的机制和途径,结果表明,D-Met诱导胃癌细胞凋亡至少部分是通过p53非依赖途径所介导,且可能以caspase非依赖方式进行; 文献[3]计算了隐式溶剂下左旋体S-Met手性对映体激发态的波函数,并基于原子电荷计算片段间的电荷转移百分数; 文献[4]分析了口服甲硫氨酸片对噪声性听力损伤的预防作用. 隐式溶剂甲醇下,关于水溶剂与Met混合体系手性转换反应物电子激发特性的图解研究目前尚未见文献报道,基于此,本文对隐式溶剂甲醇下Met与水链分子以1∶1和1∶2混合体系手性转换反应物的分子轨道(MO)及空穴-电子分布等值面图进行分析,研究电子激发特征,从而为隐式溶剂甲醇下显式溶剂作用Met分子体系手性转变机制的研究提供参考依据. 先用密度泛函理论(DFT)中的B3LYP[5]方法,在6-311+G(2df)基组水平上优化气相条件下Met分子的几何构型,再在PBE0/def2-TZVPP[6-7]基组下,用含时密度泛函理论(TDDFT)方法进行电子激发计算.
1 理论和计算方法
电子激发实际上是电子态的跃迁,某个电子态的密度矩阵是其波函数的一种变相表现形式,2个态间的跃迁可定义为跃迁密度矩阵,其中蕴含2个态间跃迁所对应的单电子性质,可考察电子激发本质. 用空穴-电子分析可得电子激发过程中电子和空穴的分布并绘制等值面图,通过空穴和电子的等值面图可直接指认电子激发类型.
所有计算均在Gaussian 16[8]软件包内完成,用Multiwfn_3.7(dev)程序[9-12]进行波函数分析,用GaussView 5.0软件绘制图形.
2 结果与讨论
2.1 气相Met分子体系的基态构型
气相条件下S-Met,Met+1H2O,Met+2H2O混合体系的几何构型[3]如图1所示. 用空穴-电子分析理论对隐式溶剂甲醇下Met+1H2O和Met+2H2O混合体系手性转换反应物的电子激发特征进行研究.
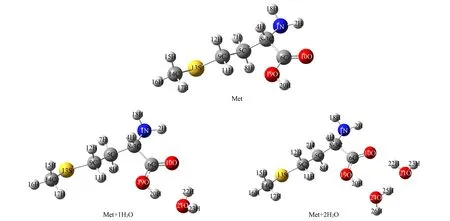
图1 Met,Met+1H2O和Met+2H2O混合体系手性转换反应物的结构示意图Fig.1 Schematic diagram of structure of chiral conversation reactants in Met,Met-1H2O and Met-2H2O mixed system
2.2 水链环境Met混合体系手性转换反应物电子激发特征
在PBE0/def2-TZVPP下,用TDDFT方法进行电子激发计算,得到隐式溶剂甲醇下Met与水链分子以1∶1和1∶2混合即Met+1H2O和Met+2H2O分子体系手性转换反应物的MO及空穴-电子分布等值面图,并用图解对比分析电子激发特征.
2.2.1 隐式溶剂甲醇下单体Met分子体系的价层激发特征
在单体S-Met-CH3OH分子体系激发态S3和S4中均有一对跃迁轨道占绝对优势,可直接通过MO特征判断其电子激发类型,其中激发态S3的跃迁轨道为MO39→MO41,其贡献值为85.1%,激发态S4的跃迁轨道为MO38→MO41,其贡献值为86.7%,而其他各激发态均没有一对跃迁轨道占绝对优势,因此不能通过MO特征判断其电子激发类型. 该分子体系激发态S3,S4的分子轨道MO38,MO39,MO41特征如图2所示(等值面数值为ρ),其中: MO38可指认10O原子的孤对电子轨道,对3C—6C,3C—5C,5C—7H的σ键略有贡献,可忽略该次要特征;MO39可指认1N原子的孤对电子轨道,对3C,5C原子略有贡献,可忽略其特征;MO41是6C—10O和6C—19O键的反π(π*)轨道. 判断指认结果为激发态S3,S4的激发模式均为n→π*激发.
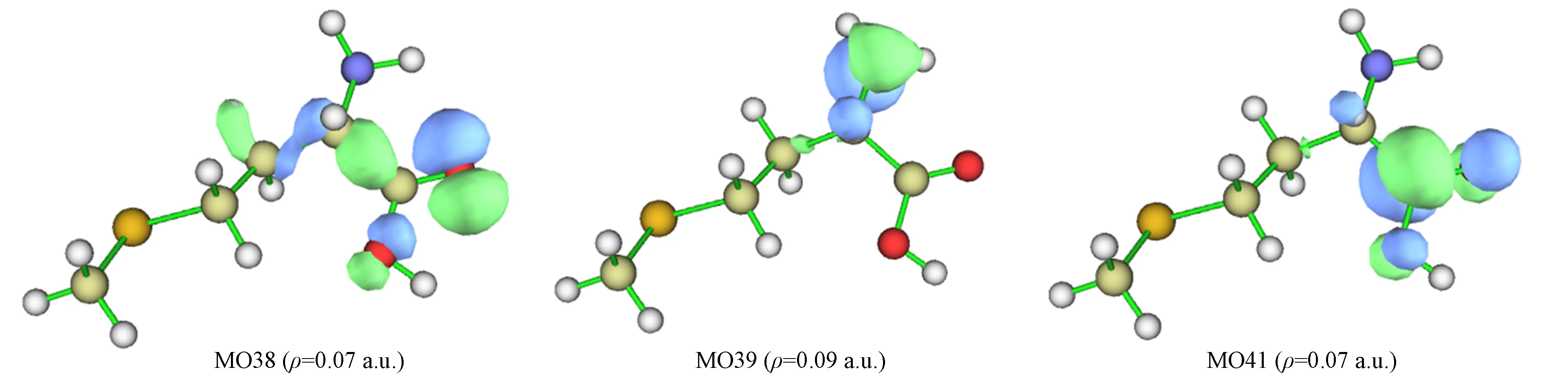
图2 S-Met-CH3OH分子体系激发态S3和S4的MO特征Fig.2 MO characteristics of excited states S3 and S4 of S-Met-CH3OH molecular system
S-Met-CH3OH分子体系激发态S1,S2,S5~S9的空穴-电子分布等值面如图3所示,其中:激发态S1,S2的激发模式为n→π*激发;激发态S5,S7,S8,S9的激发模式为n→s型Rydberg激发;激发态S6的激发模式为n→反σ(σ*)激发.
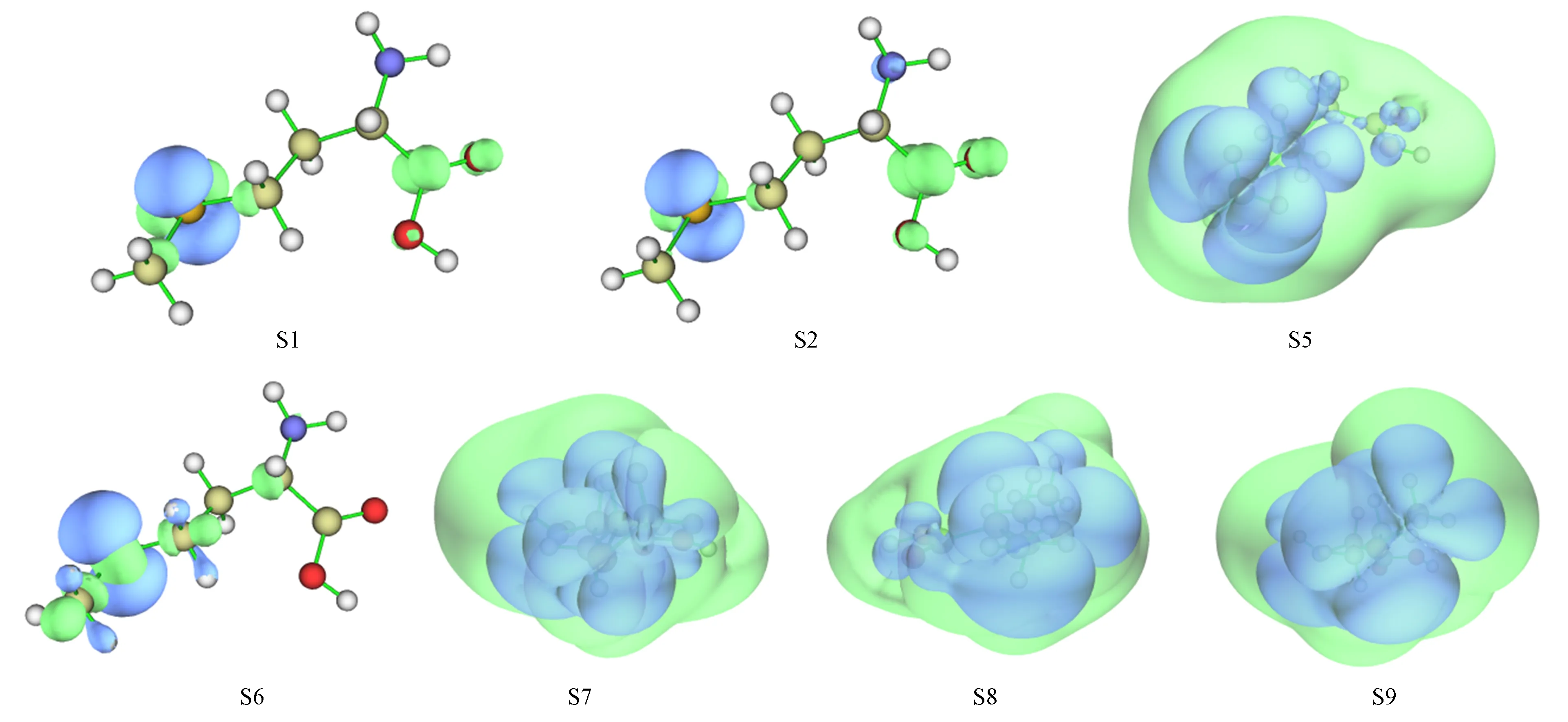
图3 S-Met-CH3OH分子体系激发态S1,S2,S5~S9的空穴-电子分布等值面Fig.3 Hole-electron distribution isosurface maps of excited states S1,S2,S5—S9 of S-Met-CH3OH molecular system
2.2.2 隐式溶剂甲醇下Met+1H2O混合体系手性转换反应物的价层激发特征
在隐式溶剂甲醇下S-Met+1H2O混合体系手性转换反应物激发态S3,S4,S9中均有一对跃迁轨道占绝对优势,可直接通过MO特征判断其电子激发类型,其中激发态S3的跃迁轨道为MO44→MO46,其贡献值为82.9%,激发态S4的跃迁轨道为MO43→MO46,其贡献值为85.4%,激发态S9的跃迁轨道为MO44→MO47,其贡献值为85.3%. 该分子体系激发态S3,S4,S9的分子轨道MO43,MO44,MO46,MO47特征如图4所示(等值面数值为ρ),其中: MO43可指认10O原子的孤对电子轨道,对19O原子和21O原子及5C—6C的σ键略有贡献,可忽略该次要特征;MO44可指认1N原子的孤对电子轨道,对3C,5C原子略有贡献,可忽略其特征;MO46是6C—10O和6C—19O键的反π*轨道;MO47是9C—13S和13S—14C键的反σ*轨道. 判断指认结果: 激发态S3,S4的激发模式为n→π*激发; 激发态S9的激发模式为n→σ*激发.
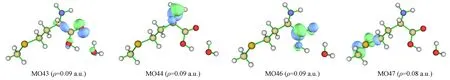
图4 S-Met-CH3OH+1H2O分子体系激发态S3,S4,S9的MO特征Fig.4 MO characteristics of excitated states S3,S4,S9 of S-Met-CH3OH+1H2O molecular system
S-Met-CH3OH+1H2O分子体系激发态S1,S2,S5~S8的空穴-电子分布等值面如图5所示,其中: 激发态S1,S2的激发模式为n→π*激发;激发态S5,S7,S8的激发模式为n→s型Rydberg激发;激发态S6的激发模式为n→σ*激发.
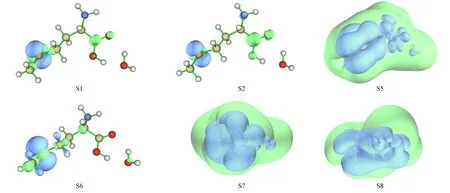
图5 S-Met-CH3OH+1H2O分子体系激发态S1,S2,S5~S8的空穴-电子分布等值面Fig.5 Hole-electron distribution isosurface maps of excited states S1,S2,S5—S8 of S-Met-CH3OH+1H2O molecular system
2.2.3 隐式溶剂甲醇下Met+2H2O混合体系手性转换反应物的价层激发特征
在隐式溶剂甲醇下S-Met+2H2O混合体系手性转换反应物激发态S3,S4,S9中均有一对跃迁轨道占绝对优势,可直接通过MO特征判断其电子激发类型,其中激发态S3的跃迁轨道为MO49→MO51,其贡献值为80.6%,激发态S4的跃迁轨道为MO48→MO51,其贡献值为84.6%,激发态S9的跃迁轨道为MO49→MO52,其贡献值为85.0%. 该分子体系激发态S3,S4,S9的分子轨道MO48,MO49,MO51,MO52特征如图6所示(等值面数值为ρ),其中: MO48可指认10O原子的孤对电子轨道,对19O原子和21O原子及5C—6C的σ键略有贡献,可忽略该次要特征;MO49可指认1N原子的孤对电子轨道,对3C原子略有贡献,可忽略其特征;MO51是6C—10O和6C—19O键的π*轨道;MO52可指认9C—13S和13S—14C键的σ*轨道. 判断指认结果: 激发态S3,S4的激发模式为n→π*激发;激发态S9的激发模式为n→σ*激发.
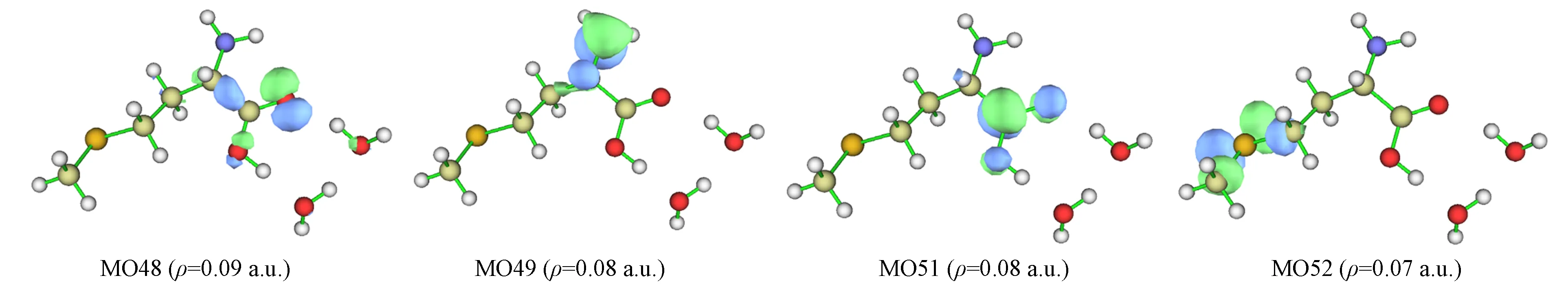
图6 S-Met-CH3OH+2H2O分子体系激发态S3,S4,S9的MO特征Fig.6 MO characteristics of excited states S3,S4,S9 of S-Met-CH3OH+2H2O molecular system
S-Met-CH3OH+2H2O分子体系激发态S1,S2,S5~S8的空穴-电子分布等值面如图7所示,其中:激发态S1,S2的激发模式为n→π*激发;激发态S5,S8的激发模式为n→s型Rydberg激发;激发态S6,S7的激发模式为n→σ*激发.
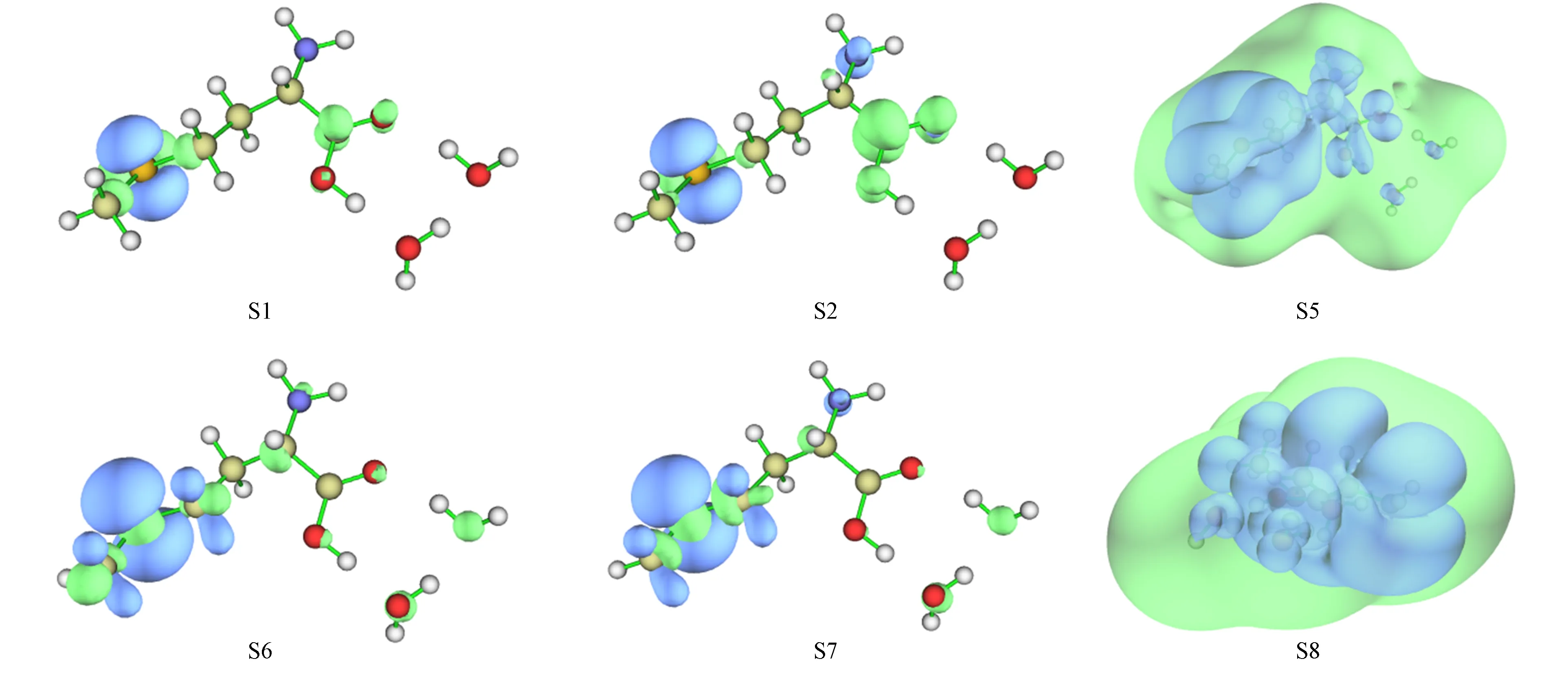
图7 S-Met-CH3OH+2H2O分子体系激发态S1,S2,S5~S8的空穴-电子分布等值面Fig.7 Hole-electron distribution isosurface maps of excited states S1,S2,S5—S8 of S-Met-CH3OH+2H2O molecular system
三者定性分析结果基本一致,但S-Met-CH3OH与S-Met-CH3OH+1H2O和S-Met-CH3OH+2H2O激发态S9的定性结果不一致;S-Met-CH3OH+2H2O与S-Met-CH3OH+1H2O激发态S7的定性结果不一致;水链对S-Met-CH3OH分子体系的电子激发特性有一定影响.
综上,本文用图解方法对S-Met-CH3OH+1H2O和S-Met-CH3OH+2H2O混合体系手性转换反应物的电子激发特征进行了理论比较分析,结果表明:二者结构与S-Met-CH3OH的分子结构对比发生显著变化,H原子迁移形成混合体系手性转换反应物; 混合体系手性转换反应物的电子结构受到影响,显式水溶剂引起H键弱相互作用,导致分子结构和功能发生演变,进而达到氨基酸手性转变的目的.
